Chủ đề cấu tạo nguyên tử và định luật tuần hoàn: Bài viết này cung cấp cái nhìn tổng quan về cấu tạo nguyên tử và định luật tuần hoàn – nền tảng của hóa học hiện đại. Từ cấu trúc các nguyên tử đến sự sắp xếp các nguyên tố trong bảng tuần hoàn, chúng ta sẽ khám phá các quy luật biến đổi tính chất hóa học và ứng dụng trong thực tiễn.
Mục lục
- Cấu Tạo Nguyên Tử Và Định Luật Tuần Hoàn
- 1. Giới Thiệu Cấu Tạo Nguyên Tử
- 2. Định Luật Tuần Hoàn Các Nguyên Tố Hóa Học
- 3. Sự Biến Đổi Tuần Hoàn Cấu Hình Electron Nguyên Tử
- 4. Tính Chất Các Nguyên Tố Trong Bảng Tuần Hoàn
- 5. Các Công Thức Toán Học Liên Quan Đến Cấu Tạo Nguyên Tử
- 6. Ứng Dụng Thực Tiễn Của Định Luật Tuần Hoàn
- 7. Bài Tập Và Thực Hành
- 8. Kết Luận
Cấu Tạo Nguyên Tử Và Định Luật Tuần Hoàn
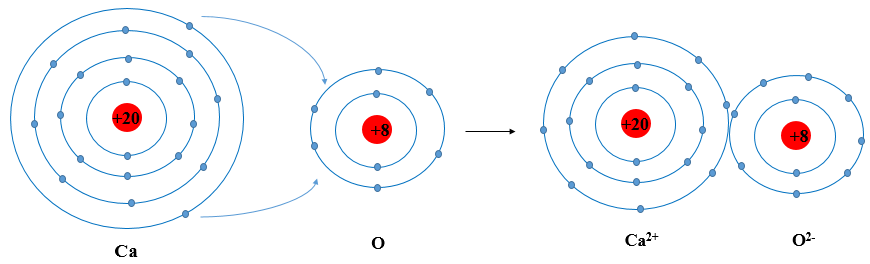
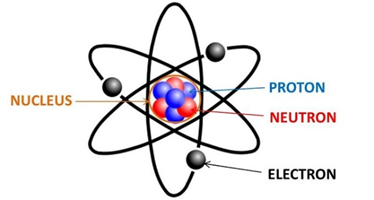
Nguyên tử là đơn vị cơ bản của vật chất, bao gồm ba loại hạt chính: proton, neutron và electron. Cấu tạo nguyên tử đóng vai trò quan trọng trong việc xác định tính chất hóa học của các nguyên tố.
Cấu Tạo Nguyên Tử
Mỗi nguyên tử bao gồm:
- Hạt proton: Có điện tích dương, nằm trong hạt nhân nguyên tử.
- Hạt neutron: Không có điện tích, nằm trong hạt nhân cùng với proton.
- Hạt electron: Có điện tích âm, quay quanh hạt nhân trong các lớp vỏ electron.
Số lượng proton xác định nguyên tố, trong khi số neutron có thể thay đổi tạo ra các đồng vị khác nhau của cùng một nguyên tố. Cấu hình electron xác định tính chất hóa học và khả năng phản ứng của nguyên tố.
Định Luật Tuần Hoàn
Định luật tuần hoàn do nhà hóa học người Nga Dmitri Mendeleev phát minh vào năm 1869. Theo định luật này, các nguyên tố được sắp xếp theo chiều tăng dần của số hiệu nguyên tử \(Z\), và các tính chất hóa học của chúng lặp lại theo chu kỳ.
Bảng tuần hoàn các nguyên tố hóa học, được xây dựng dựa trên định luật tuần hoàn, là công cụ quan trọng giúp dự đoán tính chất của các nguyên tố và sự phản ứng giữa chúng.
Ý Nghĩa Của Bảng Tuần Hoàn
Vị trí của một nguyên tố trong bảng tuần hoàn cho biết:
- Cấu hình electron của nguyên tử.
- Tính chất hóa học cơ bản, bao gồm tính kim loại, phi kim, và á kim.
- Khả năng phản ứng và liên kết với các nguyên tố khác.
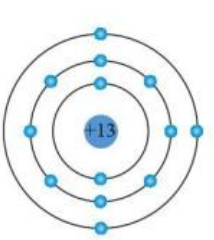
Ví dụ, nguyên tố \(S\) (Sulfur) có số hiệu nguyên tử là 16, nằm ở nhóm VIA, chu kỳ 3, nên cấu hình electron của nó là \([Ne]3s^23p^4\). Điều này cho biết Sulfur có 6 electron ở lớp vỏ ngoài cùng, làm cho nó có xu hướng nhận thêm 2 electron để đạt cấu hình bền vững giống khí hiếm, dẫn đến tính chất phi kim và khả năng tạo liên kết hóa học mạnh mẽ với các kim loại.
Kết Luận
Cấu tạo nguyên tử và định luật tuần hoàn là hai khái niệm cơ bản và quan trọng trong hóa học, giúp giải thích và dự đoán tính chất của các nguyên tố và hợp chất. Bảng tuần hoàn không chỉ là công cụ học tập, mà còn là cơ sở cho nhiều nghiên cứu và ứng dụng trong khoa học và công nghệ hiện đại.

.png)
1. Giới Thiệu Cấu Tạo Nguyên Tử
Nguyên tử là đơn vị cơ bản của vật chất, được cấu tạo từ ba loại hạt cơ bản: proton, neutron, và electron. Proton và neutron nằm trong hạt nhân nguyên tử, trong khi electron chuyển động xung quanh hạt nhân trong các lớp vỏ hoặc orbital. Hạt nhân mang điện tích dương do sự hiện diện của proton, trong khi electron mang điện tích âm và di chuyển quanh hạt nhân tạo nên một cấu trúc ổn định cho nguyên tử.
Các nguyên tử khác nhau về số lượng proton, neutron và electron, tạo nên các nguyên tố hóa học đa dạng. Để hiểu rõ hơn về cấu trúc của nguyên tử, cần xem xét chi tiết các thành phần và các lực tương tác giữa chúng:
- Proton: Hạt mang điện tích dương, số lượng proton quyết định tính chất hóa học của nguyên tố và được gọi là số hiệu nguyên tử (\(Z\)).
- Neutron: Hạt không mang điện tích, cùng với proton tạo nên khối lượng nguyên tử. Số lượng neutron có thể thay đổi mà không ảnh hưởng đến số hiệu nguyên tử, tạo ra các đồng vị khác nhau của một nguyên tố.
- Electron: Hạt mang điện tích âm, có khối lượng rất nhỏ so với proton và neutron. Các electron chuyển động xung quanh hạt nhân trong các lớp vỏ với các mức năng lượng khác nhau.
Các khái niệm toán học quan trọng liên quan đến cấu tạo nguyên tử bao gồm:
- Số khối nguyên tử (A): Là tổng số proton và neutron trong hạt nhân, tính theo công thức: \(A = Z + N\), trong đó \(Z\) là số proton và \(N\) là số neutron.
- Số neutron (N): Được tính bằng hiệu số giữa số khối và số proton: \(N = A - Z\).
- Năng lượng ion hóa: Năng lượng cần thiết để loại bỏ một electron khỏi nguyên tử: \(E_i = \frac{13.6 \, \text{eV}}{n^2}\), với \(n\) là số lượng tử chính.
- Bán kính Bohr: Khoảng cách từ hạt nhân đến electron trong mô hình Bohr, được tính theo công thức: \(r_n = n^2 \cdot r_1\), với \(r_1\) là bán kính Bohr (khoảng 0.529 Å).
Cấu tạo nguyên tử và các nguyên lý cơ bản giúp chúng ta hiểu sâu hơn về hóa học và sự tương tác giữa các nguyên tố, là nền tảng cho định luật tuần hoàn và các phản ứng hóa học khác nhau.
2. Định Luật Tuần Hoàn Các Nguyên Tố Hóa Học
Định luật tuần hoàn, do Dmitri Mendeleev đề xuất vào năm 1869, là một trong những khám phá quan trọng nhất trong hóa học. Định luật này tuyên bố rằng tính chất của các nguyên tố hóa học là một hàm tuần hoàn của số hiệu nguyên tử. Điều này có nghĩa là khi các nguyên tố được sắp xếp theo số hiệu nguyên tử tăng dần, những tính chất hóa học sẽ lặp lại theo chu kỳ.
2.1. Lịch Sử Phát Triển Và Ý Nghĩa Của Định Luật Tuần Hoàn
Ban đầu, bảng tuần hoàn được sắp xếp dựa trên khối lượng nguyên tử. Mendeleev đã nhận thấy rằng có những khoảng trống trong bảng tuần hoàn, và ông dự đoán sự tồn tại của các nguyên tố chưa được phát hiện tại thời điểm đó. Những nguyên tố này sau đó đã được tìm thấy và khẳng định tính chính xác của định luật tuần hoàn.
Ngày nay, bảng tuần hoàn hiện đại sắp xếp các nguyên tố theo số hiệu nguyên tử - số proton trong hạt nhân của mỗi nguyên tố. Điều này không chỉ giúp chúng ta hiểu rõ hơn về cấu trúc nguyên tử mà còn giúp dự đoán tính chất hóa học của các nguyên tố dựa trên vị trí của chúng trong bảng.
2.2. Bảng Tuần Hoàn Các Nguyên Tố Hóa Học Và Cách Sử Dụng
Bảng tuần hoàn các nguyên tố hóa học là công cụ quan trọng giúp học sinh và nhà khoa học dễ dàng tìm hiểu về các nguyên tố. Bảng tuần hoàn được chia thành các nhóm (cột dọc) và các chu kỳ (hàng ngang). Những nguyên tố trong cùng một nhóm có tính chất hóa học tương tự do có cấu hình electron tương tự.
- Chu kỳ: Các nguyên tố trong cùng một chu kỳ có số lớp electron bằng nhau. Ví dụ, tất cả các nguyên tố trong chu kỳ 2 đều có hai lớp electron.
- Nhóm: Các nguyên tố trong cùng một nhóm có số electron ở lớp vỏ ngoài cùng tương tự nhau. Điều này dẫn đến tính chất hóa học tương đồng. Ví dụ, nhóm Halogen bao gồm Fluor (F), Clo (Cl), Brom (Br) có 7 electron lớp ngoài cùng và đều có tính chất rất hoạt động hóa học.
2.3. Sự Biến Đổi Tuần Hoàn Của Các Tính Chất Hóa Học
Các tính chất hóa học và vật lý của các nguyên tố biến đổi một cách có hệ thống trong bảng tuần hoàn:
- Tính kim loại và tính phi kim: Trong một chu kỳ, tính kim loại giảm dần từ trái sang phải, trong khi tính phi kim tăng dần. Ngược lại, trong cùng một nhóm, tính kim loại tăng dần từ trên xuống dưới, và tính phi kim giảm dần.
- Độ âm điện: Độ âm điện là khả năng hút electron của một nguyên tử trong liên kết hóa học. Trong cùng một chu kỳ, độ âm điện tăng từ trái sang phải. Trong cùng một nhóm, độ âm điện giảm dần từ trên xuống dưới.
- Bán kính nguyên tử: Bán kính nguyên tử giảm dần trong một chu kỳ khi điện tích hạt nhân tăng lên, nhưng lại tăng dần trong một nhóm khi di chuyển từ trên xuống dưới do số lớp electron tăng.
- Tính axit và bazơ của oxit và hiđroxit: Trong một chu kỳ, tính axit của oxit tăng dần từ trái sang phải, trong khi tính bazơ giảm. Ngược lại, trong một nhóm, tính axit giảm dần từ trên xuống dưới, và tính bazơ tăng lên.
Hiểu rõ các quy luật này giúp ta không chỉ dự đoán được tính chất của các nguyên tố chưa biết mà còn giúp áp dụng trong thực tiễn như sản xuất công nghiệp và nghiên cứu khoa học.

3. Sự Biến Đổi Tuần Hoàn Cấu Hình Electron Nguyên Tử
Cấu hình electron của nguyên tử thay đổi tuần hoàn khi số hiệu nguyên tử tăng dần. Sự biến đổi này là do sự sắp xếp của các electron vào các lớp và phân lớp theo quy luật của nguyên lý vững bền, định luật Hund và nguyên lý Pauli. Những thay đổi trong cấu hình electron dẫn đến sự biến đổi tính chất hóa học của các nguyên tố.
3.1. Quy luật phân bố electron trong các lớp và phân lớp
- Các electron trong nguyên tử được sắp xếp vào các lớp và phân lớp theo thứ tự tăng dần của mức năng lượng: \(1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p...\).
- Cấu hình electron của nguyên tử xác định vị trí của nguyên tố trong bảng tuần hoàn và tính chất hóa học của nguyên tố đó.
3.2. Sự thay đổi cấu hình electron theo chu kỳ và nhóm
Khi di chuyển từ trái sang phải trong một chu kỳ của bảng tuần hoàn, số electron trong nguyên tử tăng lên, và các electron được thêm vào các lớp ngoài cùng. Ví dụ:
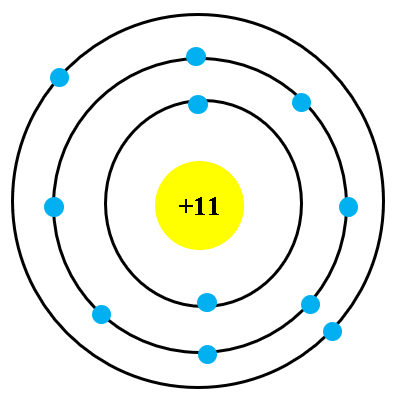
- Nguyên tố Natri (Na): \(1s^2 2s^2 2p^6 3s^1\)
- Nguyên tố Magie (Mg): \(1s^2 2s^2 2p^6 3s^2\)
- Nguyên tố Nhôm (Al): \(1s^2 2s^2 2p^6 3s^2 3p^1\)
Điều này dẫn đến sự thay đổi tính chất hóa học từ kim loại kiềm đến phi kim khi di chuyển qua các nhóm trong bảng tuần hoàn.
3.3. Tính chất tuần hoàn của các nhóm
- Các nguyên tố trong cùng một nhóm có cấu hình electron lớp ngoài cùng giống nhau, dẫn đến tính chất hóa học tương tự nhau. Ví dụ, các nguyên tố trong nhóm IA đều có một electron trong lớp ngoài cùng (\(ns^1\)), nên chúng đều là kim loại kiềm.
- Trong nhóm VIIA, các nguyên tố đều có cấu hình \(ns^2 np^5\), và có xu hướng nhận thêm một electron để đạt cấu hình bền vững của khí hiếm.
3.4. Bài tập minh họa
Hãy xác định cấu hình electron và vị trí trong bảng tuần hoàn của các nguyên tố có cấu hình electron sau:
- \(1s^2 2s^2 2p^6 3s^1\)
- \(1s^2 2s^2 2p^6 3s^2 3p^1\)
- \(1s^2 2s^2 2p^5\)

XEM THÊM:
4. Tính Chất Các Nguyên Tố Trong Bảng Tuần Hoàn
Bảng tuần hoàn các nguyên tố hóa học là công cụ quan trọng để xác định tính chất hóa học của các nguyên tố. Các tính chất này thay đổi tuần hoàn theo chu kỳ và nhóm, thể hiện qua các yếu tố như tính kim loại, tính phi kim, độ âm điện, và bán kính nguyên tử.
4.1. Tính kim loại, phi kim và sự biến đổi tính chất dọc và ngang trong bảng tuần hoàn
- Trong một chu kỳ: Khi đi từ trái sang phải, tính kim loại giảm dần, trong khi tính phi kim tăng dần. Ví dụ, chu kỳ 2 bắt đầu với Li (kim loại mạnh) và kết thúc với F (phi kim mạnh) và Ne (khí hiếm).
- Trong một nhóm: Khi đi từ trên xuống dưới, tính kim loại tăng dần do bán kính nguyên tử tăng và lực hút giữa hạt nhân và electron lớp ngoài cùng giảm. Ngược lại, tính phi kim giảm dần.
4.2. Độ âm điện và sự biến đổi tuần hoàn của độ âm điện
Độ âm điện của các nguyên tố thể hiện khả năng hút electron của nguyên tử trong liên kết hóa học. Trong cùng một chu kỳ, độ âm điện tăng dần từ trái sang phải. Tuy nhiên, trong cùng một nhóm, độ âm điện giảm dần khi đi từ trên xuống dưới. Ví dụ, trong nhóm halogen, F có độ âm điện cao nhất, trong khi Iod có độ âm điện thấp hơn do bán kính nguyên tử lớn hơn.
4.3. Sự biến đổi tuần hoàn của tính axit và bazơ của oxit và hiđroxit
- Oxit: Trong bảng tuần hoàn, tính axit và bazơ của các oxit biến đổi tuần hoàn theo chu kỳ và nhóm. Oxit của các kim loại kiềm (nhóm IA) và kiềm thổ (nhóm IIA) thường có tính bazơ mạnh, trong khi oxit của các phi kim ở nhóm VIA và VIIA có tính axit mạnh.
- Hiđroxit: Tương tự, tính axit-bazơ của các hiđroxit cũng thay đổi. Hiđroxit của kim loại (như NaOH, Ca(OH)₂) có tính bazơ mạnh, trong khi hiđroxit của phi kim (như H₂SO₄) có tính axit.
Như vậy, sự biến đổi tuần hoàn của tính chất hóa học trong bảng tuần hoàn giúp chúng ta hiểu rõ hơn về bản chất của các nguyên tố và cách chúng tương tác trong các phản ứng hóa học.

5. Các Công Thức Toán Học Liên Quan Đến Cấu Tạo Nguyên Tử
Trong hóa học, các công thức toán học liên quan đến cấu tạo nguyên tử đóng vai trò quan trọng trong việc tính toán các đặc tính của nguyên tử, như số neutron, năng lượng ion hóa, và bán kính Bohr. Dưới đây là một số công thức cơ bản và ý nghĩa của chúng:
5.1. Số khối nguyên tử và công thức tính số neutron
Số khối (\(A\)) của một nguyên tử là tổng số proton (\(Z\)) và neutron (\(N\)) trong hạt nhân:
\[
A = Z + N
\]
Để tính số neutron trong hạt nhân, ta sử dụng công thức:
\[
N = A - Z
\]
Trong đó:
- \(A\) là số khối nguyên tử.
- \(Z\) là số proton (cũng là số hiệu nguyên tử).
- \(N\) là số neutron.
5.2. Năng lượng ion hóa và công thức tính năng lượng ion hóa
Năng lượng ion hóa (\(E_{\text{ion}}\)) là năng lượng cần thiết để tách một electron ra khỏi nguyên tử hoặc ion trong trạng thái cơ bản:
\[
E_{\text{ion}} = -13.6 \times \frac{Z_{\text{eff}}^2}{n^2} \text{ eV}
\]
Trong đó:
- \(Z_{\text{eff}}\) là điện tích hiệu dụng.
- \(n\) là số lượng tử chính của electron.
- Giá trị 13.6 eV là năng lượng ion hóa của nguyên tử hydro.
5.3. Công thức bán kính Bohr và ý nghĩa của nó
Bán kính Bohr (\(r_n\)) là khoảng cách từ hạt nhân đến electron trong quỹ đạo thứ \(n\) theo mô hình nguyên tử Bohr:
\[
r_n = \frac{n^2 \cdot h^2}{4 \pi^2 \cdot m_e \cdot k \cdot Z \cdot e^2}
\]
Trong đó:
- \(n\) là số lượng tử chính.
- \(h\) là hằng số Planck.
- \(m_e\) là khối lượng của electron.
- \(k\) là hằng số Coulomb.
- \(Z\) là số hiệu nguyên tử (tức là số proton trong hạt nhân).
- \(e\) là điện tích của electron.
Bán kính Bohr đặc trưng cho kích thước của các quỹ đạo electron và là một yếu tố quan trọng trong việc xác định các tính chất vật lý của nguyên tử.
6. Ứng Dụng Thực Tiễn Của Định Luật Tuần Hoàn
Định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học là một trong những công cụ quan trọng nhất trong hóa học, giúp chúng ta phân loại và dự đoán tính chất của các nguyên tố. Ứng dụng của định luật tuần hoàn không chỉ giới hạn trong việc giảng dạy và nghiên cứu mà còn mở rộng ra nhiều lĩnh vực công nghiệp và công nghệ khác nhau.
6.1. Sử dụng trong phân loại và dự đoán tính chất hóa học
Bảng tuần hoàn được sử dụng rộng rãi trong việc phân loại các nguyên tố dựa trên cấu hình electron và tính chất hóa học của chúng. Với việc dựa trên vị trí của nguyên tố trong bảng tuần hoàn, chúng ta có thể dự đoán các tính chất như:
- Tính kim loại, phi kim, hay á kim.
- Tính axit, bazơ của oxit và hiđroxit.
- Độ âm điện và khả năng tạo liên kết.
- Năng lượng ion hóa và độ âm điện.
Ví dụ, các nguyên tố ở nhóm 1 thường có tính kim loại mạnh, dễ dàng mất electron để tạo ion dương, trong khi các nguyên tố ở nhóm 17 lại có độ âm điện cao và dễ dàng nhận thêm electron để tạo ion âm.
6.2. Ứng dụng trong ngành công nghiệp hóa học và công nghệ
Định luật tuần hoàn cũng đóng vai trò quan trọng trong ngành công nghiệp và công nghệ hiện đại. Một số ứng dụng tiêu biểu bao gồm:
- Ngành luyện kim: Bảng tuần hoàn giúp các kỹ sư vật liệu lựa chọn các kim loại và hợp kim phù hợp với các tính chất cần thiết như độ bền, độ dẻo, hay khả năng chống ăn mòn.
- Sản xuất phân bón: Các nguyên tố như nitơ, photpho, và kali, được biết đến qua bảng tuần hoàn, là những thành phần chính trong các loại phân bón giúp cải thiện năng suất cây trồng.
- Công nghiệp điện tử: Nguyên tố silicon, nằm trong bảng tuần hoàn, là nền tảng của công nghệ bán dẫn, tạo ra các thiết bị điện tử như vi xử lý, chip nhớ và cảm biến.
- Công nghiệp dược phẩm: Việc phát triển các loại thuốc mới thường dựa vào sự hiểu biết về hóa tính của các nguyên tố và hợp chất, điều mà bảng tuần hoàn cung cấp một cách hệ thống.
Định luật tuần hoàn không chỉ giúp chúng ta hiểu rõ hơn về thế giới vật chất, mà còn mở ra những hướng ứng dụng thực tiễn vô cùng quan trọng, từ đó thúc đẩy sự phát triển của các ngành công nghiệp và khoa học kỹ thuật.

7. Bài Tập Và Thực Hành
Dưới đây là một số bài tập và thực hành giúp bạn củng cố kiến thức về cấu tạo nguyên tử và định luật tuần hoàn các nguyên tố hóa học:
7.1. Bài tập về mối quan hệ giữa vị trí nguyên tố và cấu tạo nguyên tử
- Xác định vị trí của nguyên tố có số hiệu nguyên tử \(Z = 15\) trong bảng tuần hoàn. Hãy nêu cấu hình electron của nguyên tử đó.
- Cho các nguyên tố \(X\), \(Y\), \(Z\) có số hiệu nguyên tử lần lượt là \(11\), \(17\), \(20\). Sắp xếp các nguyên tố này theo chiều tăng dần tính kim loại.
7.2. Bài tập về sự biến đổi tuần hoàn của tính chất hóa học
- Sắp xếp các nguyên tố \(Na\), \(Mg\), \(Al\), \(Si\), \(P\) theo chiều giảm dần của độ âm điện.
- Cho các oxit: \(Na_2O\), \(MgO\), \(Al_2O_3\), \(SiO_2\), \(P_2O_5\). Hãy xếp các oxit này theo chiều tăng dần tính axit.
7.3. Bài tập xác định nguyên tố và vị trí của nó trong bảng tuần hoàn
- Nguyên tố \(X\) có cấu hình electron là \(1s^2 2s^2 2p^6 3s^2 3p^1\). Xác định số hiệu nguyên tử và vị trí của \(X\) trong bảng tuần hoàn.
- Một nguyên tố \(Y\) có bán kính nguyên tử lớn hơn so với các nguyên tố khác trong cùng một chu kỳ. Xác định \(Y\) và giải thích sự khác biệt về bán kính nguyên tử.
Việc thực hành và giải các bài tập này sẽ giúp bạn nắm vững hơn về mối quan hệ giữa cấu tạo nguyên tử và các tính chất hóa học của các nguyên tố trong bảng tuần hoàn. Hãy tập trung vào việc nắm bắt quy luật biến đổi của các tính chất này để áp dụng vào các bài toán phức tạp hơn.

8. Kết Luận
Việc nắm vững cấu tạo nguyên tử và định luật tuần hoàn không chỉ giúp hiểu rõ hơn về cấu trúc và tính chất của các nguyên tố, mà còn mở ra nhiều ứng dụng quan trọng trong các lĩnh vực khoa học và công nghệ.
Cấu tạo nguyên tử với các thành phần cơ bản như proton, neutron và electron đã tạo nên nền tảng cho việc giải thích các hiện tượng hóa học và vật lý. Những mô hình nguyên tử từ Rutherford đến mô hình hiện đại đã góp phần làm sáng tỏ cách thức mà các nguyên tử liên kết và tương tác với nhau.
Định luật tuần hoàn, do Mendeleev phát hiện và hoàn thiện, đã trở thành một công cụ mạnh mẽ trong việc phân loại và dự đoán tính chất của các nguyên tố. Nhờ vào định luật này, các nhà khoa học có thể dự đoán và khám phá ra những nguyên tố mới, đồng thời hiểu rõ hơn về tính chất của các nguyên tố đã biết.
Sự biến đổi tuần hoàn trong cấu hình electron không chỉ ảnh hưởng đến tính chất hóa học mà còn đóng vai trò quan trọng trong việc xác định độ bền, độ dẫn điện, và các đặc tính khác của vật liệu. Những kiến thức này không chỉ quan trọng trong nghiên cứu cơ bản mà còn có ứng dụng thực tiễn trong các ngành công nghiệp như hóa chất, vật liệu, và công nghệ tiên tiến.
Cuối cùng, việc hiểu biết sâu sắc về cấu tạo nguyên tử và định luật tuần hoàn sẽ tiếp tục đóng vai trò quan trọng trong sự phát triển của khoa học và công nghệ, giúp chúng ta tiếp cận gần hơn với những phát minh mới và ứng dụng chúng vào thực tiễn cuộc sống.
Việc tiếp tục nghiên cứu và học tập sâu hơn về các nguyên tử và định luật tuần hoàn sẽ không chỉ giúp ích trong học thuật mà còn trong việc phát triển các giải pháp công nghệ mới, đáp ứng nhu cầu của xã hội trong tương lai.



.png)