Chủ đề vẽ sơ đồ cấu tạo nguyên tử calcium: Vẽ sơ đồ cấu tạo nguyên tử calcium là một chủ đề quan trọng trong hóa học, giúp chúng ta hiểu rõ hơn về cấu trúc và tính chất của nguyên tố này. Bài viết này cung cấp hướng dẫn chi tiết về cách vẽ sơ đồ cấu tạo nguyên tử calcium, từ cấu hình electron đến mô hình Bohr, giúp bạn dễ dàng nắm bắt kiến thức và ứng dụng trong học tập và nghiên cứu.
Mục lục
- Sơ đồ cấu tạo nguyên tử Calcium
- 1. Giới thiệu về nguyên tử Calcium
- 2. Cấu tạo nguyên tử Calcium
- 3. Vẽ sơ đồ cấu tạo nguyên tử Calcium
- 4. Tính chất vật lý và hóa học của Calcium
- 5. Ứng dụng của Calcium trong đời sống và công nghiệp
- 6. Cách khai thác và tinh chế Calcium
- 7. Tầm quan trọng của Calcium trong nghiên cứu khoa học
- 8. Kết luận
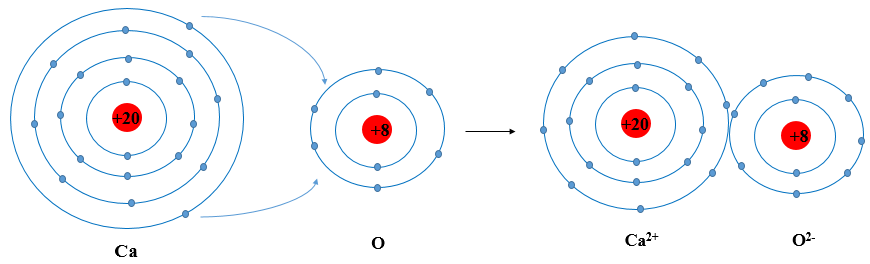
Sơ đồ cấu tạo nguyên tử Calcium
Nguyên tử Calcium (Ca) là một trong những nguyên tố thuộc nhóm kim loại kiềm thổ trong bảng tuần hoàn. Nó có số nguyên tử là 20, điều này có nghĩa là trong hạt nhân của một nguyên tử Calcium có 20 proton. Nguyên tử Calcium cũng có 20 electron, được phân bố trong các lớp vỏ electron theo cấu hình electron.
Cấu hình electron của nguyên tử Calcium
Cấu hình electron của nguyên tử Calcium được biểu diễn như sau:
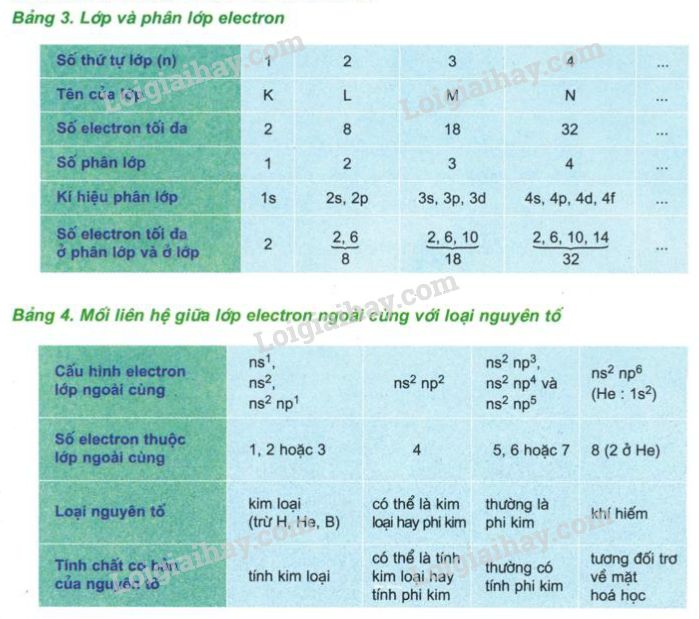
- Lớp 1 (K): 2 electron
- Lớp 2 (L): 8 electron
- Lớp 3 (M): 8 electron
- Lớp 4 (N): 2 electron
Do đó, cấu hình electron của Calcium có thể viết là \(1s^2 2s^2 2p^6 3s^2 3p^6 4s^2\).
Sơ đồ cấu tạo nguyên tử Calcium
Dưới đây là sơ đồ cấu tạo nguyên tử Calcium:
| Thành phần | Số lượng |
|---|---|
| Proton | 20 |
| Neutron | 20 |
| Electron | 20 |
Trong đó, 20 proton mang điện tích dương nằm trong hạt nhân, và 20 electron mang điện tích âm được phân bố trong các lớp vỏ electron bao quanh hạt nhân.
Sơ đồ Bohr của nguyên tử Calcium
Sơ đồ Bohr của nguyên tử Calcium mô tả cách các electron được sắp xếp trong các lớp vỏ năng lượng. Trong sơ đồ này, hạt nhân được biểu diễn ở trung tâm, chứa 20 proton và 20 neutron. Các electron được biểu diễn trong các quỹ đạo xung quanh hạt nhân, với mỗi quỹ đạo tương ứng với một mức năng lượng khác nhau.
- Lớp K: chứa 2 electron
- Lớp L: chứa 8 electron
- Lớp M: chứa 8 electron
- Lớp N: chứa 2 electron
Ứng dụng của Calcium
Calcium đóng vai trò quan trọng trong nhiều ứng dụng khác nhau. Trong cơ thể con người, Calcium là thành phần chính của xương và răng, đóng vai trò quan trọng trong sự co cơ, truyền tín hiệu thần kinh, và đông máu. Trong công nghiệp, Calcium được sử dụng để sản xuất xi măng, vôi, và làm chất phụ gia trong nhiều quy trình sản xuất khác.
Nhờ vào các tính chất vật lý và hóa học của nó, Calcium đóng vai trò quan trọng trong nhiều lĩnh vực khoa học và kỹ thuật. Hiểu rõ cấu tạo và tính chất của nguyên tử Calcium giúp chúng ta áp dụng nó một cách hiệu quả hơn trong cuộc sống và công việc.
.png)
1. Giới thiệu về nguyên tử Calcium
Nguyên tử Calcium (Ca) là một nguyên tố thuộc nhóm kim loại kiềm thổ, nằm ở vị trí thứ 20 trong bảng tuần hoàn. Nguyên tử Calcium gồm 20 proton, 20 neutron, và 20 electron. Các electron được phân bố trên ba lớp vỏ: lớp K chứa 2 electron, lớp L chứa 8 electron, và lớp M chứa 10 electron. Calcium là một nguyên tố có vai trò quan trọng trong các quá trình sinh học, bao gồm sự hình thành xương và răng, cũng như trong hoạt động của cơ và hệ thần kinh.
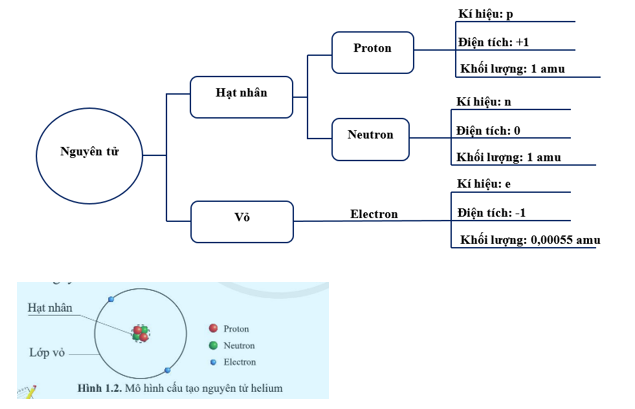
- Proton (p+): Hạt mang điện tích dương nằm trong hạt nhân.
- Neutron (n0): Hạt không mang điện tích, cũng nằm trong hạt nhân cùng với proton.
- Electron (e-): Hạt mang điện tích âm quay xung quanh hạt nhân trong các lớp vỏ.
Các lớp vỏ electron của nguyên tử Calcium được sắp xếp như sau:
- Lớp K: Chứa tối đa 2 electron. Trong nguyên tử Calcium, lớp này đã đầy với 2 electron.
- Lớp L: Chứa tối đa 8 electron. Lớp này cũng đầy đủ với 8 electron.
- Lớp M: Có thể chứa tối đa 18 electron, nhưng trong trường hợp của Calcium, lớp này chỉ chứa 10 electron.
Nguyên tử Calcium có cấu hình electron được viết dưới dạng: \(1s^2 2s^2 2p^6 3s^2 3p^6 4s^2\). Điều này phản ánh sự phân bố các electron trong các lớp vỏ xung quanh hạt nhân.
Sự cân bằng giữa số proton và electron giúp nguyên tử Calcium trung hòa về điện. Các đặc tính hóa học của Calcium chủ yếu được xác định bởi các electron ở lớp ngoài cùng, hay còn gọi là các electron hóa trị. Chúng tham gia vào các phản ứng hóa học, hình thành các hợp chất ion và tạo thành liên kết hóa học với các nguyên tố khác.
2. Cấu tạo nguyên tử Calcium
Nguyên tử Calcium (Ca) là một nguyên tố thuộc nhóm kim loại kiềm thổ, nằm ở nhóm 2 và chu kỳ 4 của bảng tuần hoàn hóa học. Số hiệu nguyên tử của Calcium là 20, điều này có nghĩa là trong hạt nhân của nguyên tử Calcium có 20 proton. Ở trạng thái trung hòa, Calcium cũng có 20 electron.
Nguyên tử Calcium bao gồm:
- Proton: 20 (mang điện tích dương)
- Neutron: Số neutron có thể khác nhau tùy thuộc vào đồng vị, nhưng đồng vị phổ biến nhất của Calcium (Calcium-40) có 20 neutron.
- Electron: 20 (mang điện tích âm)
Các electron của nguyên tử Calcium được sắp xếp vào các lớp vỏ electron theo quy tắc Aufbau, từ lớp có mức năng lượng thấp nhất đến cao nhất. Cấu hình electron của Calcium là:
Điều này có nghĩa là:
- Lớp K: 2 electron (1s2)
- Lớp L: 8 electron (2s2 2p6)
- Lớp M: 8 electron (3s2 3p6)
- Lớp N: 2 electron (4s2)
Nguyên tử Calcium có tổng cộng 4 lớp vỏ electron, trong đó lớp vỏ ngoài cùng (lớp N) chứa 2 electron. Các electron này dễ dàng bị loại bỏ khi Calcium tham gia phản ứng hóa học, đặc biệt là khi nó tạo thành ion Ca2+. Điều này giải thích tính chất hóa học của Calcium như là một kim loại dễ bị oxi hóa và có khả năng tạo liên kết ion mạnh mẽ với các phi kim.
Trong mô hình nguyên tử, hạt nhân của Calcium, chứa các proton và neutron, được đặt ở trung tâm. Các lớp vỏ electron bao quanh hạt nhân, được biểu diễn bằng các vòng tròn với số lượng electron tương ứng trên mỗi lớp.
| Lớp vỏ electron | Số electron |
|---|---|
| K | 2 |
| L | 8 |
| M | 8 |
| N | 2 |
Sự phân bố này giúp Calcium đạt được sự ổn định tương đối trong phản ứng hóa học thông qua việc tạo ion Ca2+, loại bỏ 2 electron từ lớp vỏ ngoài cùng. Nhờ cấu trúc này, Calcium đóng vai trò quan trọng trong nhiều phản ứng sinh hóa, như quá trình đông máu, chức năng cơ bắp và dẫn truyền thần kinh.

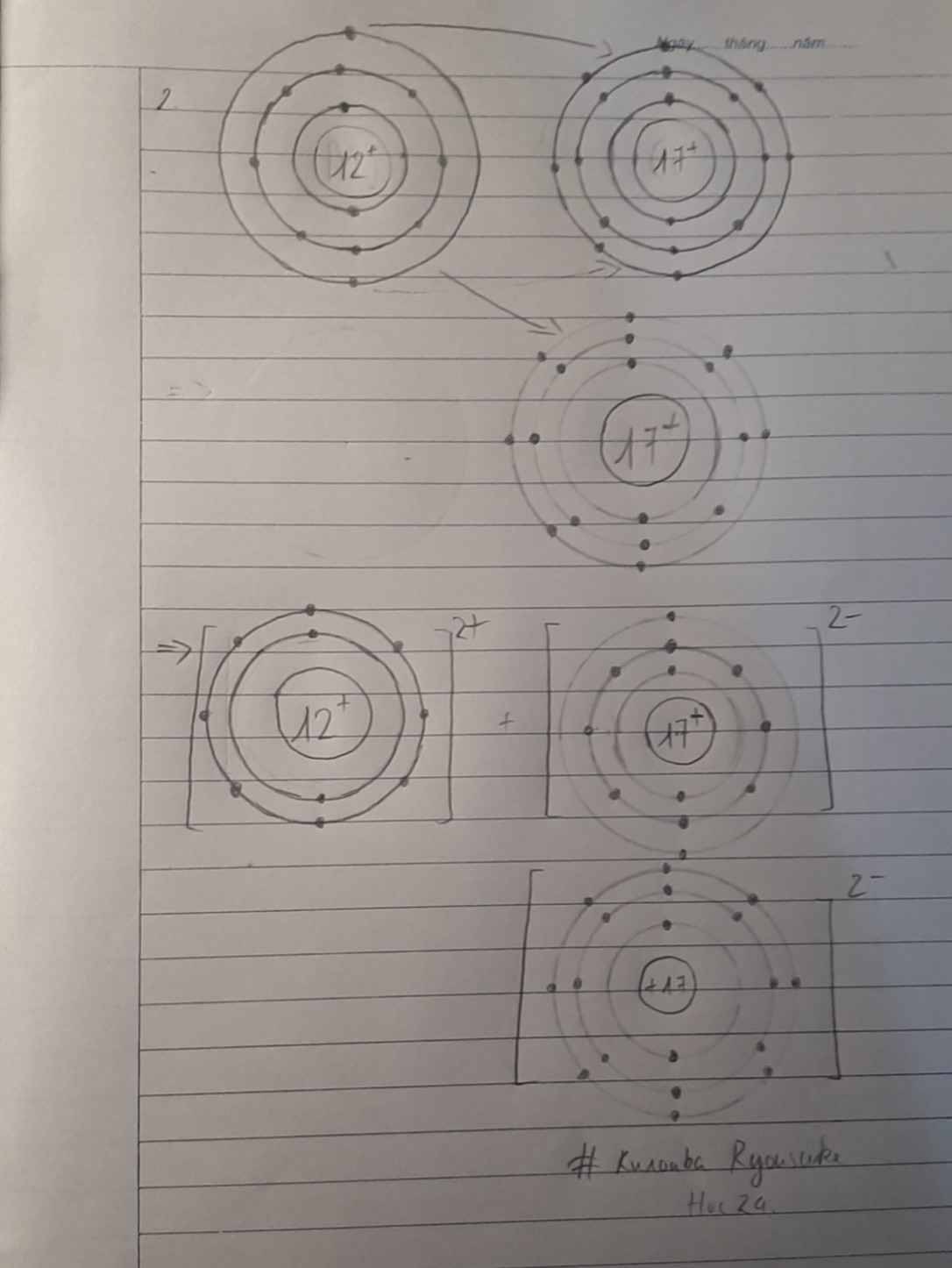
3. Vẽ sơ đồ cấu tạo nguyên tử Calcium
Nguyên tử Calcium là một nguyên tố thuộc nhóm kim loại kiềm thổ trong bảng tuần hoàn, có số nguyên tử là 20. Để vẽ sơ đồ cấu tạo nguyên tử Calcium, chúng ta sẽ tuân theo các bước sau:
3.1. Sơ đồ Bohr của nguyên tử Calcium
Mô hình Bohr là một cách biểu diễn cấu trúc của nguyên tử, cho thấy các electron chuyển động quanh hạt nhân theo các quỹ đạo cụ thể. Nguyên tử Calcium có 20 electron được phân bố trên 4 lớp vỏ:
- Lớp thứ nhất: chứa 2 electron
- Lớp thứ hai: chứa 8 electron
- Lớp thứ ba: chứa 8 electron
- Lớp thứ tư: chứa 2 electron
Sơ đồ Bohr sẽ cho thấy hạt nhân ở giữa, bao quanh bởi các lớp vỏ electron.
3.2. Sơ đồ phân bố electron trên các lớp vỏ
Phân bố electron trên các lớp vỏ của nguyên tử Calcium được xác định bởi cấu hình electron của nó:
- Ký hiệu cấu hình electron: \(1s^2 2s^2 2p^6 3s^2 3p^6 4s^2\)
- Số lớp vỏ electron: 4 lớp (K, L, M, N)
- Số electron ở mỗi lớp vỏ:
- Lớp K: 2 electron (\(1s^2\))
- Lớp L: 8 electron (\(2s^2 2p^6\))
- Lớp M: 8 electron (\(3s^2 3p^6\))
- Lớp N: 2 electron (\(4s^2\))
Sơ đồ phân bố electron giúp hiểu rõ hơn về vị trí và số lượng electron trong mỗi lớp vỏ của nguyên tử.
3.3. Sơ đồ cấu tạo hạt nhân nguyên tử
Hạt nhân của nguyên tử Calcium chứa các proton và neutron:
- Số lượng proton: 20
- Số lượng neutron: 20 (với đồng vị phổ biến nhất \(^{40}Ca\))
Sơ đồ cấu tạo hạt nhân sẽ thể hiện các proton và neutron trong hạt nhân, với số lượng tương ứng, tạo nên trọng lượng nguyên tử và ảnh hưởng đến tính chất của nguyên tử Calcium.
Bằng cách sử dụng các sơ đồ này, chúng ta có thể hình dung rõ ràng cấu trúc và cách các electron được sắp xếp xung quanh hạt nhân của nguyên tử Calcium, cũng như vai trò của các proton và neutron trong hạt nhân.
4. Tính chất vật lý và hóa học của Calcium
Calcium, còn được gọi là canxi, là một kim loại kiềm thổ có màu trắng bạc. Nó có một số tính chất vật lý và hóa học đặc biệt như sau:
Tính chất vật lý:
- Calcium là kim loại mềm, dễ cắt và uốn cong, có màu trắng bạc khi mới cắt.
- Kim loại này có nhiệt độ nóng chảy là \( 842^\circ C \) và nhiệt độ sôi là \( 1495^\circ C \).
- Khối lượng riêng của calcium là \( 1,54 \, \text{g/cm}^3 \), nhẹ hơn nhiều so với các kim loại khác.
- Calcium là một chất dẫn điện và dẫn nhiệt tốt.
Tính chất hóa học:
- Calcium phản ứng mạnh với nước, tạo ra canxi hidroxit \( \text{Ca(OH)}_2 \) và khí hidro \( \text{H}_2 \). Phản ứng này có thể được biểu diễn như sau:
- Calcium cũng dễ dàng phản ứng với oxy trong không khí, tạo thành canxi oxit \( \text{CaO} \):
- Calcium có khả năng tạo ra ion \( \text{Ca}^{2+} \) khi hòa tan trong nước, làm cho nó trở thành một chất điện li mạnh.
- Calcium cũng có khả năng tạo phức chất với nhiều hợp chất hữu cơ và vô cơ khác, chẳng hạn như với EDTA (acid ethylenediaminetetraacetic), một chất tạo phức thông dụng.
\[
\text{Ca} + 2\text{H}_2\text{O} \rightarrow \text{Ca(OH)}_2 + \text{H}_2 \uparrow
\]
\[
2\text{Ca} + \text{O}_2 \rightarrow 2\text{CaO}
\]
Những tính chất này làm cho calcium đóng vai trò quan trọng trong nhiều ứng dụng công nghiệp, từ sản xuất xi măng và vôi đến việc chế tạo hợp kim và các sản phẩm sinh học.

5. Ứng dụng của Calcium trong đời sống và công nghiệp
Calcium (Ca) là một nguyên tố hóa học quan trọng và có nhiều ứng dụng rộng rãi trong cả đời sống hàng ngày và các ngành công nghiệp khác nhau. Dưới đây là một số ứng dụng chính của calcium:
-
1. Sức khỏe và dinh dưỡng:
Calcium là thành phần chủ yếu của xương và răng, giúp duy trì sự chắc khỏe của chúng. Nó cũng đóng vai trò quan trọng trong việc co bóp cơ bắp, dẫn truyền thần kinh, và đông máu. Thiếu calcium có thể dẫn đến các bệnh như loãng xương và còi xương. Các sản phẩm như sữa, phô mai, và sữa chua là nguồn cung cấp calcium tự nhiên cho cơ thể.
-
2. Xây dựng:
Trong công nghiệp xây dựng, calcium carbonate (\(CaCO_3\)) được sử dụng rộng rãi làm chất độn trong bê tông và vữa để tăng cường độ bền và độ bám dính. Thạch cao (calcium sulfate dihydrate, \(CaSO_4 \cdot 2H_2O\)) cũng được sử dụng để làm vách ngăn và trang trí nội thất.
-
3. Sản xuất thép:
Calcium được thêm vào trong quá trình sản xuất thép để khử lưu huỳnh và oxy, giúp cải thiện chất lượng thép. Calcium silicate (\(CaSiO_3\)) được tạo ra trong quá trình này cũng có vai trò là chất loại bỏ tạp chất khỏi thép.
-
4. Công nghiệp hóa chất:
Calcium oxide (vôi sống, \(CaO\)) và calcium hydroxide (vôi tôi, \(Ca(OH)_2\)) được sử dụng trong xử lý nước để loại bỏ tạp chất và điều chỉnh pH. Vôi sống còn được sử dụng trong sản xuất xi măng và vữa xây dựng.
-
5. Sản xuất thủy tinh và gốm sứ:
Calcium carbonate là một thành phần quan trọng trong sản xuất thủy tinh, giúp tăng độ cứng và độ bền của sản phẩm. Nó cũng được sử dụng trong sản xuất gốm sứ để cải thiện đặc tính cơ học và chịu nhiệt.
-
6. Phân bón nông nghiệp:
Calcium là một chất dinh dưỡng cần thiết cho cây trồng, giúp cải thiện cấu trúc đất và pH, từ đó tăng cường khả năng sinh trưởng và năng suất của cây. Calcium nitrate (\(Ca(NO_3)_2\)) thường được sử dụng như một loại phân bón cung cấp calcium và nitơ cho cây trồng.
XEM THÊM:
6. Cách khai thác và tinh chế Calcium
Calcium là một kim loại quan trọng, được tìm thấy chủ yếu trong các khoáng chất như canxit (CaCO₃), dolomit (CaMg(CO₃)₂), và thạch cao (CaSO₄·2H₂O). Quá trình khai thác và tinh chế calcium bao gồm các bước cơ bản sau:
-
Khảo sát và khai thác:
Các mỏ chứa calcium carbonate (CaCO₃) được xác định qua khảo sát địa chất. Sau đó, các hoạt động khai thác bắt đầu, bao gồm việc đào bới và vận chuyển đá vôi đến nhà máy xử lý.
-
Nghiền và sàng lọc:
Đá vôi được nghiền thành các hạt nhỏ và được sàng lọc để loại bỏ các tạp chất và những phần không mong muốn. Kích thước hạt thường nhỏ hơn 5 cm để thuận tiện cho quá trình xử lý tiếp theo.
-
Quá trình nung:
Đá vôi nghiền nhỏ được nung ở nhiệt độ cao (khoảng 900 - 1000°C) trong các lò nung để tạo ra vôi sống (CaO) và khí carbon dioxide (CO₂). Phương trình phản ứng được mô tả như sau:
\[
\text{CaCO}_3 \rightarrow \text{CaO} + \text{CO}_2 \uparrow
\] -
Hydrat hóa:
Vôi sống (CaO) được thêm nước để tạo thành vôi tôi (Ca(OH)₂) qua phản ứng:
\[
\text{CaO} + \text{H}_2\text{O} \rightarrow \text{Ca(OH)}_2
\] -
Kết tủa và lọc:
Vôi tôi (Ca(OH)₂) sau đó được kết tủa với một số hóa chất để loại bỏ các tạp chất. Sản phẩm calcium tinh khiết có thể được thu hồi qua quá trình lọc và sấy khô.
-
Điện phân và sản xuất kim loại calcium:
Cuối cùng, calcium có thể được sản xuất dưới dạng kim loại qua quá trình điện phân calcium chloride (CaCl₂) nóng chảy. Calcium kim loại được thu hồi ở cực âm, trong khi khí chlorine được phát sinh ở cực dương.
Nhờ vào các bước trên, calcium được tinh chế và sản xuất với độ tinh khiết cao, sẵn sàng cho các ứng dụng trong công nghiệp và y tế.
7. Tầm quan trọng của Calcium trong nghiên cứu khoa học
Calcium là một trong những nguyên tố quan trọng nhất trong nghiên cứu khoa học, đặc biệt là trong lĩnh vực hóa học và sinh học. Dưới đây là một số lý do tại sao calcium có tầm quan trọng đáng kể trong nghiên cứu khoa học:
- Vai trò trong sinh học: Calcium là một thành phần thiết yếu trong cấu trúc xương và răng của động vật. Nó đóng vai trò quan trọng trong các quá trình sinh học như co cơ, dẫn truyền xung thần kinh, và đông máu. Sự cân bằng của ion calcium trong cơ thể được điều hòa cẩn thận để duy trì sức khỏe.
- Nghiên cứu về tế bào: Calcium tham gia vào quá trình truyền tín hiệu tế bào, ảnh hưởng đến các chức năng như tăng trưởng tế bào, phân chia tế bào, và chết tế bào theo chương trình (apoptosis). Các nghiên cứu này giúp hiểu rõ hơn về các cơ chế bệnh lý như ung thư và các bệnh thoái hóa thần kinh.
- Ứng dụng trong y học: Calcium được sử dụng trong nhiều loại thuốc và phương pháp điều trị y tế, chẳng hạn như thuốc bổ sung calcium, thuốc chống loãng xương và thuốc điều hòa nhịp tim. Hiểu rõ cách calcium hoạt động trong cơ thể giúp phát triển các liệu pháp điều trị hiệu quả hơn.
- Vai trò trong hóa học: Calcium là một kim loại kiềm thổ phổ biến, được sử dụng trong nhiều phản ứng hóa học và sản xuất các hợp chất hữu cơ và vô cơ. Sự nghiên cứu về tính chất hóa học của calcium giúp cải thiện các quy trình công nghiệp, như sản xuất xi măng, thạch cao, và các chất chống cháy.
- Nghiên cứu vật liệu: Calcium được sử dụng trong nghiên cứu và phát triển vật liệu mới, như hợp kim nhẹ và bền, cũng như các vật liệu sinh học có khả năng tương thích với cơ thể người.
Với những vai trò quan trọng như vậy, calcium không chỉ là một nguyên tố thiết yếu cho sự sống mà còn là một công cụ mạnh mẽ trong nghiên cứu khoa học, giúp con người hiểu rõ hơn về thế giới xung quanh và phát triển các giải pháp cho các thách thức về sức khỏe và công nghiệp.

8. Kết luận
Calcium đóng vai trò quan trọng không chỉ trong sinh học mà còn trong nhiều lĩnh vực khoa học khác. Từ việc cấu thành nên xương và răng trong cơ thể đến việc tham gia vào quá trình truyền tín hiệu tế bào, nguyên tử calcium đóng một vai trò thiết yếu trong nhiều chức năng sống.
Trong hóa học, mô hình nguyên tử calcium giúp chúng ta hiểu rõ hơn về cấu trúc và tương tác của các nguyên tố hóa học. Bằng cách nghiên cứu mô hình này, các nhà khoa học có thể phân tích và phát triển các vật liệu mới với tính năng ưu việt, chẳng hạn như vật liệu phát quang và siêu dẫn.
Đối với ngành dược phẩm, calcium và các hợp chất của nó là thành phần quan trọng trong nhiều loại thuốc, đặc biệt là các sản phẩm bổ sung canxi và thuốc điều trị các bệnh liên quan đến xương và tim mạch. Việc nghiên cứu cấu tạo nguyên tử calcium giúp cải tiến các phương pháp điều trị và tăng cường hiệu quả của thuốc.
Nhìn chung, nghiên cứu về nguyên tử calcium không chỉ giúp mở rộng kiến thức khoa học cơ bản mà còn tạo tiền đề cho những ứng dụng thực tế quan trọng trong cuộc sống hàng ngày.