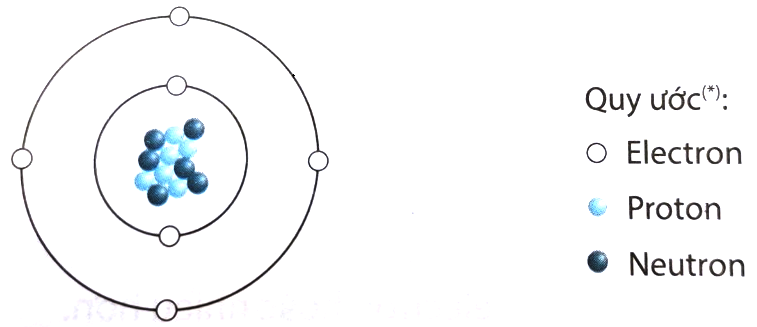
Chủ đề vẽ hình mô tả cấu tạo nguyên tử: Khám phá cách vẽ hình mô tả cấu tạo nguyên tử một cách chi tiết và dễ hiểu, giúp bạn nắm vững kiến thức cơ bản về cấu trúc của các nguyên tố hóa học. Bài viết này sẽ hướng dẫn bạn từng bước để tạo ra sơ đồ nguyên tử chính xác và đẹp mắt.
Mục lục
- Hướng dẫn chi tiết về vẽ hình mô tả cấu tạo nguyên tử
- I. Tổng quan về cấu tạo nguyên tử
- II. Hướng dẫn vẽ sơ đồ cấu tạo nguyên tử
- III. Ví dụ minh họa về các nguyên tố phổ biến
- IV. Phân tích cấu tạo nguyên tử trong các nguyên tố đặc biệt
- V. Sử dụng sơ đồ nguyên tử trong giảng dạy và học tập
- VI. Các câu hỏi thường gặp về cấu tạo và sơ đồ nguyên tử
- VII. Tài liệu tham khảo và nguồn học thêm về nguyên tử
Hướng dẫn chi tiết về vẽ hình mô tả cấu tạo nguyên tử
Nguyên tử là thành phần cơ bản của vật chất, và việc hiểu cấu tạo của nguyên tử là một phần quan trọng trong giáo dục khoa học. Dưới đây là hướng dẫn chi tiết để vẽ hình mô tả cấu tạo của một nguyên tử, đi kèm với một số ví dụ minh họa cụ thể.
1. Các thành phần cơ bản của nguyên tử
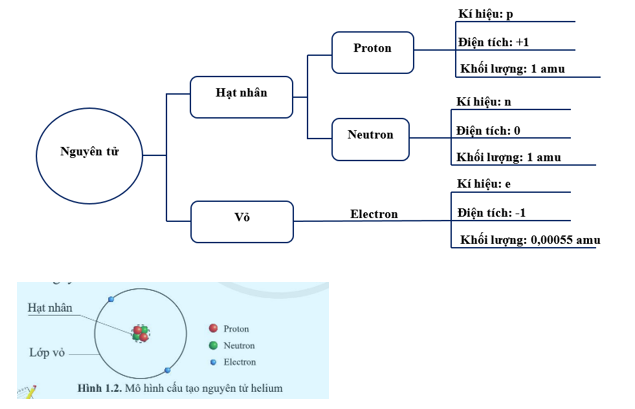
Một nguyên tử bao gồm ba thành phần chính:
- Proton: Hạt mang điện tích dương, nằm trong hạt nhân nguyên tử.
- Neutron: Hạt không mang điện, cũng nằm trong hạt nhân.
- Electron: Hạt mang điện tích âm, di chuyển xung quanh hạt nhân theo các lớp vỏ electron.
2. Quy tắc vẽ sơ đồ nguyên tử
Để vẽ sơ đồ cấu tạo của một nguyên tử, bạn có thể làm theo các bước sau:
- Vẽ hạt nhân nguyên tử: Bắt đầu bằng cách vẽ một vòng tròn ở trung tâm để biểu diễn hạt nhân. Bên trong vòng tròn này, viết số lượng proton và neutron.
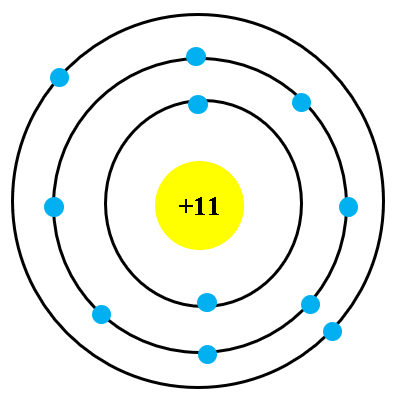
- Vẽ các lớp electron: Vẽ các vòng tròn đồng tâm xung quanh hạt nhân để biểu diễn các lớp electron. Các lớp này được đánh số từ 1, 2, 3,... từ trong ra ngoài.
- Điền electron vào các lớp: Số electron tối đa trên mỗi lớp được tính theo quy tắc 2n², với n là số thứ tự của lớp. Electron được điền từ lớp gần hạt nhân nhất ra ngoài.
- Kiểm tra và hoàn thiện sơ đồ: Đảm bảo số lượng electron trong mỗi lớp đúng với quy tắc và tổng số electron bằng số hiệu nguyên tử.
3. Ví dụ minh họa
Nguyên tử Hydro (H)
Hydro là nguyên tố đơn giản nhất với:
- Số neutron: 0
Sơ đồ cấu tạo nguyên tử Hydro:
| Hạt nhân | Electron |
| 1p+ | • |
Nguyên tử Oxy (O)
Oxy là một nguyên tố phổ biến với:
- Số proton: 8
- Số neutron: 8
- Số electron: 8
Sơ đồ cấu tạo nguyên tử Oxy:
| Hạt nhân | Lớp 1 | Lớp 2 |
| 8p+ 8n | 2e- | 6e- |
Nguyên tử Nhôm (Al)
Nhôm có cấu trúc nguyên tử phức tạp hơn với:
- Số proton: 13
- Số neutron: 14
- Số electron: 13
Sơ đồ cấu tạo nguyên tử Nhôm:
| Hạt nhân | Lớp 1 | Lớp 2 | Lớp 3 |
| 13p+ 14n | 2e- | 8e- | 3e- |
4. Công thức toán học liên quan
Để tính số electron tối đa trên mỗi lớp, sử dụng công thức:
\[
2n^2
\]
Trong đó, \( n \) là số thứ tự của lớp vỏ electron.
5. Ứng dụng trong giáo dục
Việc vẽ sơ đồ cấu tạo nguyên tử giúp học sinh hiểu rõ hơn về cấu trúc vi mô của vật chất. Đây là một phần không thể thiếu trong chương trình học môn Hóa học và Vật lý tại các trường học.
.png)
I. Tổng quan về cấu tạo nguyên tử
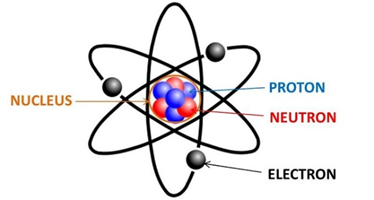
Nguyên tử là đơn vị cơ bản của vật chất, cấu thành nên mọi thứ xung quanh chúng ta. Mỗi nguyên tử được tạo thành từ ba loại hạt cơ bản: proton, neutron và electron. Trong đó, proton và neutron nằm trong hạt nhân, còn electron di chuyển xung quanh hạt nhân theo các lớp vỏ. Mặc dù nguyên tử có kích thước rất nhỏ, nhưng chúng đóng vai trò quan trọng trong việc xác định tính chất hóa học và vật lý của một nguyên tố.
Hạt nhân của nguyên tử là nơi tập trung khối lượng chính của nguyên tử, chứa các proton mang điện tích dương và neutron không mang điện. Số lượng proton trong hạt nhân quyết định số hiệu nguyên tử và thuộc tính hóa học của nguyên tố. Các electron mang điện tích âm, di chuyển xung quanh hạt nhân, tạo thành các lớp electron. Số lượng electron và cách sắp xếp của chúng trong các lớp này ảnh hưởng đến cách mà nguyên tử tương tác với các nguyên tử khác.
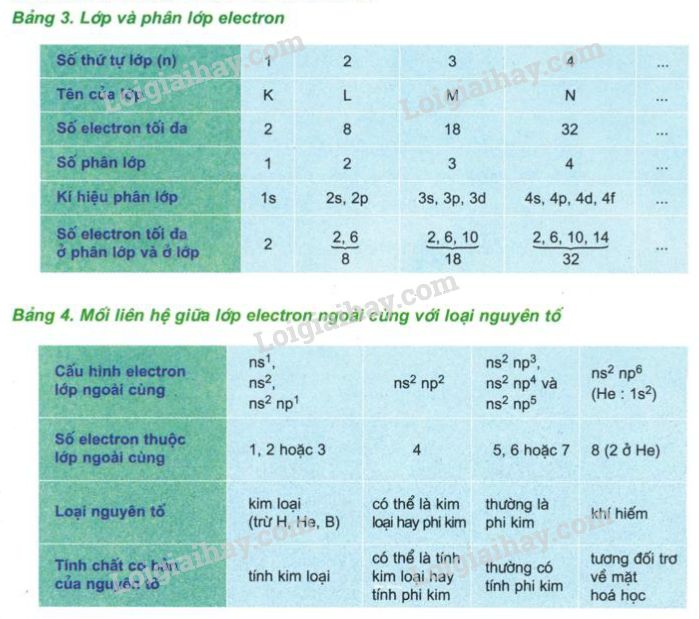
Cấu trúc của nguyên tử tuân theo các quy tắc và nguyên lý cơ bản trong vật lý và hóa học, như quy tắc 2n² để xác định số lượng electron tối đa trong một lớp vỏ electron, với \(n\) là số thứ tự của lớp. Ví dụ, lớp thứ nhất có thể chứa tối đa 2 electron, lớp thứ hai chứa tối đa 8 electron, và cứ tiếp tục như vậy.
Tóm lại, hiểu được cấu tạo của nguyên tử là chìa khóa để nắm vững các kiến thức sâu hơn về hóa học, vật lý và nhiều lĩnh vực khoa học khác. Việc vẽ và mô tả cấu tạo nguyên tử giúp minh họa rõ ràng cách mà các hạt bên trong nguyên tử sắp xếp và tương tác với nhau, từ đó cung cấp nền tảng cho việc nghiên cứu và ứng dụng trong khoa học và công nghệ.
II. Hướng dẫn vẽ sơ đồ cấu tạo nguyên tử
Vẽ sơ đồ cấu tạo nguyên tử là một bước quan trọng để hiểu rõ cách các hạt trong nguyên tử được sắp xếp. Dưới đây là hướng dẫn chi tiết từng bước để bạn có thể dễ dàng vẽ sơ đồ này.
- Xác định số lượng proton, neutron và electron:
- Proton: Số lượng proton trong hạt nhân bằng với số hiệu nguyên tử của nguyên tố. Ví dụ, nguyên tử Oxy có số hiệu nguyên tử là 8, tức là có 8 proton.
- Neutron: Số neutron có thể được tính bằng cách lấy số khối trừ đi số proton. Số khối thường là tổng của proton và neutron.
- Electron: Trong nguyên tử trung hòa, số lượng electron bằng với số proton. Các electron này sẽ được phân bổ vào các lớp vỏ xung quanh hạt nhân.
- Vẽ hạt nhân nguyên tử:
- Bắt đầu bằng cách vẽ một vòng tròn nhỏ ở trung tâm để biểu diễn hạt nhân nguyên tử.
- Ghi số proton và neutron vào trong vòng tròn này. Ví dụ, với nguyên tử Oxy, bạn có thể ghi "8p+ 8n".
- Vẽ các lớp vỏ electron:
- Vẽ các vòng tròn đồng tâm xung quanh hạt nhân để biểu diễn các lớp vỏ electron. Các lớp này được đánh số từ 1 đến n (từ trong ra ngoài).
- Theo quy tắc 2n², điền số electron vào các lớp từ trong ra ngoài, bắt đầu từ lớp gần hạt nhân nhất. Lớp thứ nhất (n = 1) chứa tối đa 2 electron, lớp thứ hai (n = 2) chứa tối đa 8 electron, v.v.
- Điền electron vào các lớp:
- Bắt đầu điền electron vào lớp vỏ đầu tiên (gần hạt nhân nhất). Nếu lớp này đầy, tiếp tục điền vào lớp tiếp theo.
- Ví dụ, nguyên tử Oxy có 8 electron: Lớp đầu tiên (n = 1) chứa 2 electron, lớp thứ hai (n = 2) chứa 6 electron.
- Hoàn thiện sơ đồ và kiểm tra:
- Đảm bảo rằng tổng số electron đã điền bằng số proton. Kiểm tra lại số lượng proton và neutron để chắc chắn sơ đồ chính xác.
- Sơ đồ của bạn nên hiển thị rõ ràng các lớp electron và hạt nhân, với các thông số chính xác cho nguyên tố đang vẽ.
Việc vẽ sơ đồ cấu tạo nguyên tử giúp minh họa cách các hạt cơ bản sắp xếp và tương tác trong nguyên tử. Đây là một công cụ hữu ích cho việc học và giảng dạy hóa học, cung cấp nền tảng để hiểu các khái niệm phức tạp hơn.

III. Ví dụ minh họa về các nguyên tố phổ biến
Dưới đây là một số ví dụ minh họa về cấu tạo nguyên tử của các nguyên tố phổ biến. Các ví dụ này sẽ giúp bạn hiểu rõ hơn về cách vẽ và phân tích cấu trúc của nguyên tử đối với các nguyên tố cụ thể.
- Nguyên tử Hydro (H):
- Số proton: 1
- Số neutron: 0 (vì số khối của Hydro thông thường là 1)
- Số electron: 1
- Sơ đồ cấu tạo: Nguyên tử Hydro rất đơn giản, với một proton trong hạt nhân và một electron duy nhất di chuyển quanh hạt nhân ở lớp vỏ đầu tiên (n = 1).
- Nguyên tử Helium (He):
- Số proton: 2
- Số neutron: 2
- Số electron: 2
- Sơ đồ cấu tạo: Nguyên tử Helium có hai proton và hai neutron trong hạt nhân, với hai electron di chuyển ở lớp vỏ đầu tiên (n = 1). Lớp vỏ này đầy đủ, tạo nên một nguyên tử bền vững và không hoạt động hóa học.
- Nguyên tử Oxy (O):
- Số proton: 8
- Số neutron: 8
- Số electron: 8
- Sơ đồ cấu tạo: Oxy có hạt nhân gồm 8 proton và 8 neutron. Các electron được phân bố như sau: 2 electron ở lớp vỏ thứ nhất (n = 1) và 6 electron ở lớp vỏ thứ hai (n = 2), lớp vỏ thứ hai chưa đầy, tạo nên đặc tính hoạt động mạnh của Oxy.
- Nguyên tử Carbon (C):
- Số proton: 6
- Số neutron: 6
- Số electron: 6
- Sơ đồ cấu tạo: Nguyên tử Carbon có 6 proton và 6 neutron trong hạt nhân. Các electron được phân bố với 2 electron ở lớp vỏ thứ nhất (n = 1) và 4 electron ở lớp vỏ thứ hai (n = 2). Với 4 electron ở lớp vỏ ngoài cùng, Carbon dễ dàng tạo liên kết với các nguyên tử khác, dẫn đến khả năng hình thành nhiều hợp chất khác nhau.
- Nguyên tử Neon (Ne):
- Số proton: 10
- Số neutron: 10
- Số electron: 10
- Sơ đồ cấu tạo: Neon có 10 proton và 10 neutron trong hạt nhân. Các electron được sắp xếp với 2 electron ở lớp thứ nhất (n = 1) và 8 electron ở lớp thứ hai (n = 2). Vì lớp vỏ ngoài cùng đã đầy đủ, Neon là một khí hiếm và rất ít phản ứng hóa học.
Những ví dụ trên giúp bạn hiểu cách xác định số lượng proton, neutron, và electron, cũng như cách sắp xếp các hạt này trong nguyên tử của các nguyên tố phổ biến. Việc nắm vững kiến thức này sẽ hỗ trợ bạn trong việc học tập và giảng dạy về hóa học.

IV. Phân tích cấu tạo nguyên tử trong các nguyên tố đặc biệt
Nguyên tố đặc biệt là những nguyên tố có cấu trúc nguyên tử phức tạp hoặc có tính chất hóa học và vật lý độc đáo. Dưới đây là phân tích chi tiết về cấu tạo nguyên tử của một số nguyên tố đặc biệt, giúp bạn hiểu rõ hơn về cách mà các hạt trong nguyên tử sắp xếp và tương tác.
- Nguyên tử Urani (U):
- Số proton: 92
- Số neutron: Thường là 146 (đối với Urani-238, đồng vị phổ biến nhất)
- Số electron: 92
- Phân tích cấu tạo: Urani là một nguyên tố nặng, phóng xạ với hạt nhân rất lớn. Các electron của Urani được sắp xếp trong nhiều lớp vỏ với lớp vỏ ngoài cùng có số electron chưa đầy, điều này giải thích tính phóng xạ và khả năng phân hạch của nguyên tố này. Đồng vị Urani-235 đặc biệt quan trọng trong các lò phản ứng hạt nhân và vũ khí hạt nhân.
- Nguyên tử Carbon-14 (C-14):
- Số proton: 6
- Số neutron: 8 (Carbon-14 là một đồng vị của Carbon)
- Số electron: 6
- Phân tích cấu tạo: Carbon-14 là một đồng vị phóng xạ của Carbon, được sử dụng rộng rãi trong phương pháp định tuổi bằng carbon phóng xạ (Carbon dating). Sự hiện diện của 2 neutron thừa so với Carbon-12 làm cho Carbon-14 không ổn định và phóng xạ.
- Nguyên tử Vàng (Au):
- Số proton: 79
- Số neutron: 118 (đối với đồng vị phổ biến nhất, Vàng-197)
- Số electron: 79
- Phân tích cấu tạo: Vàng là một kim loại quý với cấu trúc nguyên tử ổn định, không phản ứng với hầu hết các hóa chất. Cấu trúc điện tử của Vàng có một electron ở lớp vỏ ngoài cùng d, điều này góp phần tạo nên tính dẫn điện và độ bóng cao của nó. Ngoài ra, tính chất này cũng làm cho Vàng rất khó bị ăn mòn hay oxy hóa.
- Nguyên tử Xenon (Xe):
- Số proton: 54
- Số neutron: 77-82 (đối với các đồng vị phổ biến nhất của Xenon)
- Số electron: 54
- Phân tích cấu tạo: Xenon là một nguyên tố thuộc nhóm khí hiếm với lớp vỏ electron ngoài cùng đầy đủ, làm cho nó rất ít phản ứng hóa học. Tuy nhiên, trong một số điều kiện đặc biệt, Xenon có thể tạo ra hợp chất với các nguyên tố khác, điều này cho thấy sự linh hoạt và đa dạng trong tính chất hóa học của nguyên tố này.
Những phân tích trên giúp bạn có cái nhìn sâu sắc hơn về cấu tạo nguyên tử của các nguyên tố đặc biệt, từ đó hiểu được các tính chất độc đáo của chúng và cách chúng tương tác trong các phản ứng hóa học.

V. Sử dụng sơ đồ nguyên tử trong giảng dạy và học tập
Sơ đồ nguyên tử không chỉ giúp học sinh hiểu rõ cấu tạo của nguyên tử mà còn hỗ trợ giáo viên trong việc giảng dạy các khái niệm hóa học cơ bản. Dưới đây là một số cách sử dụng sơ đồ nguyên tử trong giảng dạy và học tập:
5.1 Ứng dụng của sơ đồ nguyên tử trong giảng dạy
- Giải thích cấu tạo nguyên tử: Sơ đồ nguyên tử giúp giáo viên minh họa trực quan cấu tạo của một nguyên tử, bao gồm số lượng proton, neutron, và electron. Điều này giúp học sinh dễ dàng hình dung và ghi nhớ kiến thức.
- So sánh các nguyên tố: Sử dụng sơ đồ nguyên tử để so sánh cấu tạo của các nguyên tố khác nhau, từ đó giúp học sinh hiểu rõ sự khác biệt giữa chúng, ví dụ như số lớp electron hay số lượng proton trong hạt nhân.
- Thực hành tính toán hóa học: Giáo viên có thể sử dụng sơ đồ nguyên tử để hướng dẫn học sinh tính toán các đại lượng như khối lượng nguyên tử, số mol, và số lượng hạt trong nguyên tử.
5.2 Cách học sinh có thể thực hành và hiểu sâu hơn
- Vẽ sơ đồ nguyên tử: Học sinh có thể thực hành vẽ sơ đồ nguyên tử của các nguyên tố khác nhau để củng cố kiến thức về cấu tạo nguyên tử và cách xác định số lượng proton, neutron, và electron.
- Sử dụng mô hình 3D: Sử dụng các công cụ mô phỏng 3D để tạo ra các mô hình nguyên tử giúp học sinh hình dung rõ hơn về cấu trúc không gian của nguyên tử.
- Thực hành với các câu hỏi và bài tập: Giáo viên có thể cung cấp các bài tập và câu hỏi liên quan đến sơ đồ nguyên tử để học sinh làm quen và vận dụng kiến thức vào thực tế.
5.3 Tài liệu và công cụ hỗ trợ vẽ sơ đồ nguyên tử
Có nhiều tài liệu và công cụ có sẵn để hỗ trợ học sinh và giáo viên trong việc vẽ và học về sơ đồ nguyên tử:
- Sách giáo khoa: Các sách giáo khoa hóa học cung cấp các sơ đồ minh họa và hướng dẫn chi tiết về cách vẽ sơ đồ nguyên tử của các nguyên tố khác nhau.
- Phần mềm mô phỏng: Các phần mềm như ChemDraw, Avogadro, hay các ứng dụng di động giúp tạo ra các sơ đồ nguyên tử và mô hình hóa học.
- Trang web học tập trực tuyến: Nhiều trang web giáo dục cung cấp bài giảng, video hướng dẫn, và các bài tập tương tác giúp học sinh thực hành vẽ sơ đồ nguyên tử và hiểu sâu hơn về cấu trúc của chúng.
Việc sử dụng sơ đồ nguyên tử trong giảng dạy và học tập không chỉ giúp học sinh hiểu sâu về cấu tạo nguyên tử mà còn phát triển khả năng tư duy logic và kỹ năng giải quyết vấn đề trong hóa học.
XEM THÊM:
VI. Các câu hỏi thường gặp về cấu tạo và sơ đồ nguyên tử
Dưới đây là một số câu hỏi phổ biến liên quan đến cấu tạo và sơ đồ nguyên tử cùng với lời giải đáp để giúp các bạn hiểu rõ hơn về chủ đề này:
6.1 Cấu tạo nguyên tử có thay đổi theo thời gian không?
Nguyên tử là đơn vị nhỏ nhất của vật chất giữ nguyên tính chất hóa học của nguyên tố đó. Cấu tạo cơ bản của nguyên tử bao gồm hạt nhân (proton và neutron) và các electron quay quanh hạt nhân. Mặc dù các thành phần của nguyên tử và số lượng hạt trong nguyên tử có thể thay đổi khi tham gia phản ứng hạt nhân, nhưng cấu tạo cơ bản của một nguyên tử vẫn giữ nguyên trong điều kiện bình thường.
6.2 Làm thế nào để xác định số lớp electron của một nguyên tố?
Số lớp electron của một nguyên tố được xác định dựa trên số electron tối đa mà mỗi lớp có thể chứa, theo quy tắc 2n² (với \(n\) là số thứ tự lớp). Ví dụ, lớp thứ nhất (\(n = 1\)) có thể chứa tối đa \(2 \times 1^2 = 2\) electron, lớp thứ hai (\(n = 2\)) có thể chứa tối đa \(2 \times 2^2 = 8\) electron, và cứ tiếp tục như vậy. Số lớp electron cũng tương ứng với số thứ tự của nguyên tố trong bảng tuần hoàn.
6.3 Tại sao số proton và electron lại bằng nhau trong một nguyên tử trung hòa?
Trong một nguyên tử trung hòa, số proton (hạt mang điện tích dương) và số electron (hạt mang điện tích âm) bằng nhau để cân bằng điện tích. Điều này giúp nguyên tử có điện tích tổng bằng 0. Nếu số lượng proton và electron không bằng nhau, nguyên tử sẽ trở thành ion và mang điện tích dương hoặc âm tùy theo sự chênh lệch này.
6.4 Có phải tất cả các nguyên tố đều tuân theo quy tắc 2n² khi điền electron không?
Quy tắc 2n² được áp dụng cho các lớp electron của nguyên tố trong điều kiện cơ bản. Tuy nhiên, các nguyên tố ở những vị trí cao hơn trong bảng tuần hoàn có các electron tham gia vào các lớp con khác nhau (s, p, d, f), và số electron trong các lớp này có thể vượt quá giới hạn của quy tắc 2n² khi xét đến các trạng thái năng lượng cao hơn.
6.5 Tại sao neutron lại không ảnh hưởng đến tính chất hóa học của nguyên tố?
Neutron là hạt không mang điện trong hạt nhân của nguyên tử và không ảnh hưởng đến điện tích tổng của nguyên tử. Tính chất hóa học của một nguyên tố chủ yếu được quyết định bởi số lượng proton (số hiệu nguyên tử) và số lượng electron, vì chúng ảnh hưởng trực tiếp đến cách nguyên tử tương tác với các nguyên tử khác. Neutron chỉ ảnh hưởng đến khối lượng nguyên tử và tính ổn định của hạt nhân.
Những câu hỏi này giúp chúng ta hiểu sâu hơn về cấu tạo và tính chất của nguyên tử, từ đó có thể ứng dụng kiến thức này vào học tập và nghiên cứu khoa học.
VII. Tài liệu tham khảo và nguồn học thêm về nguyên tử
Để hiểu rõ hơn về cấu tạo nguyên tử và các khái niệm liên quan, dưới đây là một số tài liệu tham khảo và nguồn học thêm hữu ích mà bạn có thể sử dụng:
7.1 Sách giáo khoa và tài liệu tham khảo
- Sách giáo khoa Hóa học lớp 10: Cuốn sách này cung cấp kiến thức cơ bản về cấu tạo nguyên tử, các loại hạt cơ bản (proton, neutron, electron) và cách sắp xếp các hạt này trong nguyên tử.
- Các sách tham khảo nâng cao: Các sách như "Hóa học Vô cơ" hoặc "Nguyên lý Hóa học" cung cấp kiến thức chi tiết hơn về cấu tạo nguyên tử, các mức năng lượng của electron, và các hiện tượng liên quan như liên kết hóa học và phản ứng hóa học.
7.2 Các trang web học tập trực tuyến
- Trang web của Khan Academy: Cung cấp các bài giảng chi tiết về cấu tạo nguyên tử, các khái niệm liên quan đến năng lượng và mức năng lượng của electron.
- Hocmai.vn: Một nguồn tài liệu phong phú cho học sinh trung học với các bài giảng trực tuyến, video minh họa về cấu tạo nguyên tử và cách vẽ sơ đồ cấu trúc nguyên tử.
- Wikipedia: Cung cấp một cái nhìn tổng quan về nguyên tử và các thành phần của nó. Đây là một nguồn tài liệu tham khảo mở và có thể cập nhật thông tin mới thường xuyên.
7.3 Video và khóa học trực tuyến về cấu tạo nguyên tử
- Video trên YouTube: Có nhiều kênh giáo dục như "CrashCourse Chemistry", "Ted-Ed", và "Khoa Học Vui" cung cấp các video hấp dẫn giải thích về cấu tạo nguyên tử và các hiện tượng liên quan.
- Khóa học trực tuyến trên Coursera và edX: Các khóa học về Hóa học cơ bản và nâng cao từ các trường đại học hàng đầu, cung cấp kiến thức sâu rộng về cấu tạo nguyên tử và ứng dụng của nó trong khoa học và công nghệ.
Những tài liệu và nguồn học tập trên sẽ giúp bạn có cái nhìn sâu sắc hơn về cấu tạo nguyên tử và cung cấp các phương pháp học tập hiệu quả. Bạn có thể kết hợp nhiều tài liệu và phương pháp học khác nhau để hiểu rõ hơn về chủ đề này.