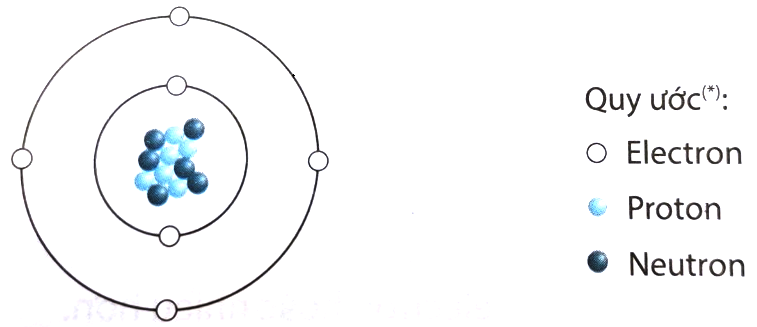
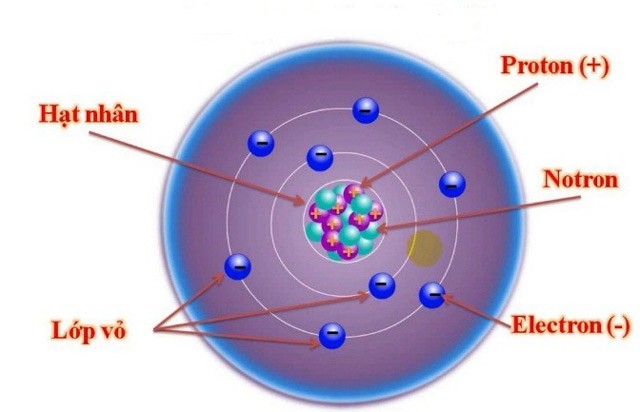
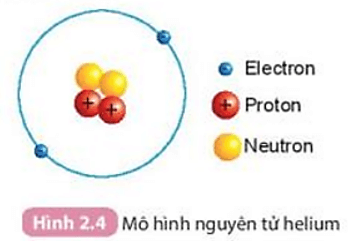
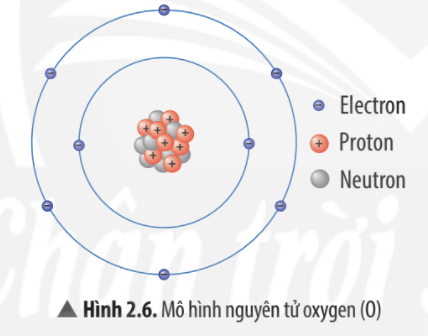
Chủ đề bài tập cấu tạo nguyên tử nâng cao: Bài viết này cung cấp một hướng dẫn chi tiết về bài tập cấu tạo nguyên tử nâng cao, từ cơ bản đến phức tạp, cùng với các bài tập thực hành giúp học sinh nắm vững kiến thức và phát triển kỹ năng tư duy logic trong môn Hóa học.
Mục lục
- Bài Tập Cấu Tạo Nguyên Tử Nâng Cao
- Mục Lục Tổng Hợp
- 2.1 Bài tập về Số Proton, Số Electron và Số Neutron
- 2.2 Bài tập về Tính toán Khối lượng Nguyên tử
- 2.3 Bài tập về Đồng vị và Tính Khối lượng Nguyên tử Trung bình
- 4.1 Bài tập về Cấu hình Electron và Vị trí Nguyên tố trong Bảng Tuần Hoàn
- 4.2 Bài tập về Cấu trúc Hạt nhân Nguyên tử
- 4.3 Bài tập về Liên kết Hóa học và Lực Hút giữa các Hạt trong Nguyên tử
Bài Tập Cấu Tạo Nguyên Tử Nâng Cao
Bài viết này tổng hợp các bài tập cấu tạo nguyên tử nâng cao dành cho học sinh trung học phổ thông. Các bài tập được phân loại theo mức độ từ cơ bản đến nâng cao, kèm theo lời giải chi tiết và phương pháp giải.
Dạng 1: Bài Tập Về Thành Phần Của Nguyên Tử
- Câu 1: Hạt nhân của hầu hết các nguyên tử do các loại hạt sau cấu tạo nên:
- Electron, proton và nơtron.
- Electron và nơtron.
- Proton và nơtron.
- Electron và proton.
- Câu 2: Một nguyên tử được đặc trưng cơ bản bằng:
- Số proton và điện tích hạt nhân.
- Số proton và số electron.
- Số khối \(A\) và số nơtron.
- Số khối \(A\) và điện tích hạt nhân.
Dạng 2: Tính Toán Liên Quan Đến Nguyên Tử
- Câu 3: Trong tinh thể, nguyên tử crom chiếm 68% về thể tích. Khối lượng riêng của kim loại crom là 7,19 g/cm3. Bán kính nguyên tử tương đối của nguyên tử Cr là:
- \(1,17 \times 10^{-8}\) cm.
- \(1,25 \times 10^{-8}\) cm.
- \(1,12 \times 10^{-8}\) cm.
- \(1,54 \times 10^{-8}\) cm.
Dạng 3: Bài Tập Liên Quan Đến Đồng Vị Và Khối Lượng Nguyên Tử
- Câu 4: Một nguyên tố hóa học có hai đồng vị với thành phần phần trăm như sau: đồng vị thứ nhất chiếm 75%, đồng vị thứ hai chiếm 25%. Biết khối lượng nguyên tử của hai đồng vị lần lượt là 35 và 37. Tính khối lượng trung bình của nguyên tử nguyên tố này:
Khối lượng trung bình của nguyên tử: \[
M = \frac{35 \times 75 + 37 \times 25}{100}
\]
Dạng 4: Bài Tập Liên Quan Đến Bảng Tuần Hoàn Và Cấu Hình Electron
- Câu 5: Xác định vị trí của nguyên tố \(X\) trong bảng tuần hoàn biết rằng cấu hình electron của nguyên tử \(X\) là \(1s^2 2s^2 2p^6 3s^2 3p^4\):
- Nhóm VI A, chu kỳ 3.
- Nhóm IV A, chu kỳ 2.
- Nhóm III B, chu kỳ 4.
- Nhóm II A, chu kỳ 3.
Kết Luận
Những bài tập trên không chỉ giúp học sinh nắm vững kiến thức về cấu tạo nguyên tử mà còn rèn luyện kỹ năng giải toán hóa học một cách logic và chính xác.

.png)
Mục Lục Tổng Hợp
Dưới đây là mục lục tổng hợp chi tiết về các dạng bài tập và nội dung liên quan đến cấu tạo nguyên tử nâng cao. Mục lục được xây dựng nhằm giúp học sinh và giáo viên dễ dàng tìm kiếm và ôn tập kiến thức hiệu quả.
- 1. Khái niệm cơ bản về Cấu Tạo Nguyên Tử
- 1.1. Khái niệm về Hạt Nhân, Proton, Neutron và Electron
- 1.2. Định nghĩa về Đồng Vị và Tính Khối Lượng Nguyên Tử
- 1.3. Sơ đồ Cấu tạo và Mô hình Nguyên tử Bohr
- 2. Phân loại Bài Tập Cấu Tạo Nguyên Tử
- 2.1. Bài Tập Tính Số Proton, Neutron, Electron
- 2.2. Bài Tập Tính Khối Lượng Nguyên Tử và Đồng Vị
- 2.3. Bài Tập Tính Toán Liên Quan Đến Cấu Hình Electron
- 2.4. Bài Tập Ứng Dụng Trong Bảng Tuần Hoàn
- 3. Phương pháp Giải Các Dạng Bài Tập Cấu Tạo Nguyên Tử
- 3.1. Phương pháp Sử Dụng Công Thức Tính Khối Lượng Nguyên Tử
- 3.2. Phương pháp Giải Bài Tập Liên Quan Đến Đồng Vị
- 3.3. Phương pháp Xác Định Vị Trí Nguyên Tố Trong Bảng Tuần Hoàn
- 3.4. Phương pháp Giải Bài Tập Cấu Hình Electron
- 4. Thực hành Bài tập và Trắc nghiệm
- 4.1. Bài Tập Tự Luận
- 4.2. Bài Tập Trắc Nghiệm Có Đáp Án
- 4.3. Bài Tập Thực Hành Nâng Cao
- 5. Tài liệu Tham khảo và Bài tập Nâng cao
- 5.1. Tài Liệu Tham Khảo Chuyên Sâu
- 5.2. Bài Tập Cấu Tạo Nguyên Tử Đặc Sắc
2.1 Bài tập về Số Proton, Số Electron và Số Neutron
Đây là phần quan trọng trong chương trình Hóa học, giúp học sinh nắm vững các khái niệm cơ bản về số proton, electron, và neutron trong nguyên tử. Dưới đây là các dạng bài tập và hướng dẫn giải chi tiết từng bước:
- 1. Xác định số Proton, Electron và Neutron trong một nguyên tử:
Đối với một nguyên tử có số hiệu nguyên tử là \(Z\) và số khối là \(A\), số proton và số electron được xác định như sau:
- Số Proton \(p\): Bằng số hiệu nguyên tử \(Z\).
- Số Electron \(e\): Bằng số hiệu nguyên tử \(Z\) (đối với nguyên tử trung hòa).
- Số Neutron \(n\): Được tính theo công thức: \[ n = A - Z \]
- 2. Bài tập ví dụ:
- Bài tập 1: Xác định số proton, electron và neutron trong nguyên tử của nguyên tố X có số khối \(A = 23\) và số hiệu nguyên tử \(Z = 11\).
- Bài tập 2: Tính số neutron trong nguyên tử có số khối \(A = 56\) và số hiệu nguyên tử \(Z = 26\).
- 3. Bài tập mở rộng:
- Bài tập 3: Nguyên tử Y có số proton nhiều hơn số neutron là 1, tổng số hạt cơ bản (proton, neutron, electron) là 79. Tìm số hiệu nguyên tử và số khối của Y.
- Bài tập 4: Xác định số proton, electron và neutron trong một ion \(X^{2-}\) có số khối là 32 và số hiệu nguyên tử là 16.
- 4. Kỹ năng cần thiết:
- Hiểu rõ khái niệm: Học sinh cần hiểu rõ các khái niệm cơ bản về proton, electron, neutron, cũng như cách tính toán các đại lượng này.
- Vận dụng linh hoạt: Khả năng áp dụng công thức và phương pháp giải vào các bài tập khác nhau, kể cả những bài tập mở rộng.

2.2 Bài tập về Tính toán Khối lượng Nguyên tử
Khối lượng nguyên tử là một trong những khái niệm cơ bản và quan trọng trong Hóa học. Để hiểu rõ hơn về khối lượng nguyên tử và cách tính toán, dưới đây là một số dạng bài tập cụ thể:
- 1. Tính toán khối lượng trung bình của một nguyên tố:
Nguyên tố hóa học thường tồn tại dưới dạng nhiều đồng vị với khối lượng khác nhau. Khối lượng nguyên tử trung bình của nguyên tố đó được tính bằng công thức:
\[ \text{Khối lượng nguyên tử trung bình} = \sum \left( \text{phần trăm đồng vị} \times \text{khối lượng của đồng vị} \right) \]
- 2. Bài tập ví dụ:
- Bài tập 1: Một nguyên tố X có hai đồng vị với phần trăm khối lượng lần lượt là 75% và 25%. Khối lượng của hai đồng vị là 35u và 37u. Hãy tính khối lượng nguyên tử trung bình của nguyên tố X.
- Bài tập 2: Nguyên tố Y có ba đồng vị với khối lượng lần lượt là 10u, 11u và 12u, với tỷ lệ xuất hiện tương ứng là 20%, 30%, và 50%. Tính khối lượng nguyên tử trung bình của nguyên tố Y.
- 3. Bài tập mở rộng:
- Bài tập 3: Một nguyên tố Z có khối lượng nguyên tử trung bình là 24.305u. Z có hai đồng vị là \[ ^{24}\text{Z} \] và \[ ^{25}\text{Z} \]. Nếu khối lượng của \[ ^{24}\text{Z} \] là 24u và của \[ ^{25}\text{Z} \] là 25u, hãy tính tỷ lệ phần trăm của mỗi đồng vị.
- Bài tập 4: Đồng vị A của nguyên tố B chiếm 60% và có khối lượng là 10u, đồng vị C chiếm 40% và có khối lượng là 11u. Tính khối lượng nguyên tử trung bình của nguyên tố B và xác định tính chính xác của kết quả này trong việc dự đoán các tính chất hóa học của nguyên tố.
- 4. Kỹ năng cần thiết:
- Hiểu rõ khái niệm: Học sinh cần hiểu rõ sự khác biệt giữa các đồng vị và cách tính toán khối lượng nguyên tử trung bình dựa trên tỷ lệ phần trăm của từng đồng vị.
- Áp dụng linh hoạt: Có khả năng áp dụng các phương pháp tính toán khối lượng nguyên tử trung bình trong nhiều tình huống khác nhau, bao gồm các bài toán phức tạp với nhiều đồng vị.
2.3 Bài tập về Đồng vị và Tính Khối lượng Nguyên tử Trung bình
Đồng vị của một nguyên tố là những biến thể của nguyên tố đó với số neutron khác nhau nhưng cùng số proton. Bài tập về đồng vị thường liên quan đến việc tính toán khối lượng nguyên tử trung bình dựa trên tỷ lệ phần trăm của từng đồng vị. Dưới đây là hướng dẫn chi tiết:
- 1. Tính toán khối lượng nguyên tử trung bình:
Để tính khối lượng nguyên tử trung bình, chúng ta sử dụng công thức:
\[
\text{Khối lượng nguyên tử trung bình} = \frac{\sum (\text{Tỷ lệ phần trăm đồng vị} \times \text{Khối lượng đồng vị})}{100}
\] - 2. Bài tập ví dụ:
- Bài tập 1: Nguyên tố Carbon có hai đồng vị phổ biến là \[ ^{12}\text{C} \] với khối lượng 12u và \[ ^{13}\text{C} \] với khối lượng 13u. Tỷ lệ phần trăm của chúng lần lượt là 98.9% và 1.1%. Tính khối lượng nguyên tử trung bình của Carbon.
- Bài tập 2: Nguyên tố Chlorine có hai đồng vị \[ ^{35}\text{Cl} \] và \[ ^{37}\text{Cl} \] với khối lượng lần lượt là 35u và 37u. Nếu khối lượng nguyên tử trung bình của Chlorine là 35.5u, hãy tính tỷ lệ phần trăm của từng đồng vị.
- 3. Bài tập mở rộng:
- Bài tập 3: Một nguyên tố X có ba đồng vị với khối lượng và tỷ lệ phần trăm lần lượt là \[ ^{20}\text{X} \] (75%), \[ ^{21}\text{X} \] (10%) và \[ ^{22}\text{X} \] (15%). Hãy tính khối lượng nguyên tử trung bình của nguyên tố X.
- Bài tập 4: Nguyên tố Z có khối lượng nguyên tử trung bình là 50.5u. Nếu \[ ^{50}\text{Z} \] chiếm 75% và \[ ^{52}\text{Z} \] chiếm 25%, hãy tính khối lượng của từng đồng vị.
- 4. Kỹ năng cần thiết:
- Hiểu rõ khái niệm: Học sinh cần nắm vững cách xác định đồng vị và áp dụng công thức tính toán khối lượng nguyên tử trung bình một cách chính xác.
- Thực hành nhiều bài tập: Làm quen với nhiều dạng bài tập khác nhau về đồng vị để củng cố kỹ năng tính toán và nhận biết các yếu tố ảnh hưởng đến khối lượng nguyên tử trung bình.

4.1 Bài tập về Cấu hình Electron và Vị trí Nguyên tố trong Bảng Tuần Hoàn
Bài tập về cấu hình electron và vị trí nguyên tố trong bảng tuần hoàn là một phần quan trọng giúp học sinh hiểu rõ hơn về sự phân bố electron và quy luật tuần hoàn của các nguyên tố. Dưới đây là hướng dẫn chi tiết:
- 1. Cấu hình electron cơ bản:
- Viết cấu hình electron cho các nguyên tố từ số hiệu nguyên tử 1 đến 20. Lưu ý về cách điền các electron vào các orbital theo thứ tự năng lượng.
- Cách xác định lớp và phân lớp electron trong một nguyên tố cụ thể.
- 2. Xác định vị trí nguyên tố trong bảng tuần hoàn:
- Dựa trên cấu hình electron, học sinh sẽ xác định vị trí của nguyên tố trong bảng tuần hoàn, bao gồm chu kỳ, nhóm, và phân loại nguyên tố (kim loại, phi kim, khí hiếm, v.v.).
- Ví dụ: Nguyên tố có cấu hình electron \([1s^2 2s^2 2p^6 3s^2 3p^5]\) thuộc chu kỳ 3, nhóm VIIA (nhóm Halogen).
- 3. Bài tập vận dụng:
- Bài tập 1: Viết cấu hình electron và xác định vị trí trong bảng tuần hoàn của nguyên tố X có số hiệu nguyên tử 17.
- Bài tập 2: Xác định cấu hình electron của ion \(\text{Mg}^{2+}\) và xác định vị trí của nguyên tố Mg trong bảng tuần hoàn.
- 4. Kỹ năng cần thiết:
- Hiểu rõ quy luật điền electron: Nắm vững quy tắc Hund, nguyên lý Pauli và quy luật Aufbau để viết cấu hình electron chính xác.
- Phân tích cấu hình electron: Học sinh cần phân tích cấu hình electron để dự đoán tính chất hóa học cơ bản của nguyên tố.
XEM THÊM:
4.2 Bài tập về Cấu trúc Hạt nhân Nguyên tử
Bài tập về cấu trúc hạt nhân nguyên tử giúp học sinh nắm vững các khái niệm về proton, neutron, số khối, và đồng vị. Dưới đây là các bước giải quyết các bài tập liên quan:
- 1. Xác định số proton, neutron:
- Cho số hiệu nguyên tử \( Z \) và số khối \( A \), xác định số proton và số neutron:
- Công thức: Số proton = \( Z \), Số neutron = \( A - Z \).
- 2. Bài tập về đồng vị:
- Xác định khối lượng trung bình của nguyên tử dựa trên khối lượng và phần trăm các đồng vị:
- Công thức: \(\text{Khối lượng trung bình} = \frac{\text{Khối lượng đồng vị 1} \times \text{Phần trăm đồng vị 1} + \text{Khối lượng đồng vị 2} \times \text{Phần trăm đồng vị 2}}{100}\)
- 3. Bài tập thực hành:
- Bài tập 1: Tính số neutron của nguyên tử X có số khối là 35 và số proton là 17.
- Bài tập 2: Xác định khối lượng trung bình của nguyên tố Cl, biết rằng nó có hai đồng vị là Cl-35 (75,77%) và Cl-37 (24,23%).
- 4. Kỹ năng phân tích:
- Học sinh cần hiểu rõ cách xác định các hạt trong hạt nhân và tính toán liên quan đến các đồng vị khác nhau.
- Học sinh cần nắm vững các công thức và quy luật liên quan đến số khối và khối lượng nguyên tử trung bình.

4.3 Bài tập về Liên kết Hóa học và Lực Hút giữa các Hạt trong Nguyên tử
Liên kết hóa học và lực hút giữa các hạt trong nguyên tử là những yếu tố cơ bản để hiểu về cấu tạo của các phân tử và chất. Dưới đây là một số bài tập nâng cao giúp bạn làm quen với các khái niệm này.
Bài tập 1: Xác định loại liên kết hóa học
Cho các hợp chất sau: H2O, NaCl, CH4. Hãy xác định loại liên kết hóa học chính trong mỗi hợp chất và giải thích cơ chế của chúng.
- H2O: Liên kết cộng hóa trị
- NaCl: Liên kết ion
- CH4: Liên kết cộng hóa trị
Bài tập 2: Tính toán năng lượng liên kết
Hãy tính toán năng lượng liên kết của phân tử H2O. Biết rằng năng lượng liên kết giữa hai nguyên tử H và O là 463 kJ/mol.
Sử dụng công thức:
\[
E = n \cdot d
\]
Trong đó, E là tổng năng lượng liên kết, n là số liên kết và d là năng lượng của một liên kết.
Giải:
| Số liên kết | Năng lượng mỗi liên kết (kJ/mol) | Tổng năng lượng (kJ/mol) |
| 2 | 463 | 926 |
Bài tập 3: So sánh lực hút giữa các hạt
So sánh lực hút giữa các hạt của nguyên tử trong một phân tử của Cl2 và HF. Hãy giải thích sự khác biệt về lực hút giữa các hạt trong hai phân tử này.
- Cl2: Liên kết cộng hóa trị phân cực yếu hơn
- HF: Liên kết cộng hóa trị phân cực mạnh hơn
Những bài tập này không chỉ giúp củng cố kiến thức về liên kết hóa học mà còn giúp bạn làm quen với các tính toán và so sánh cần thiết trong hóa học nâng cao.