Chủ đề cách vẽ sơ đồ cấu tạo nguyên tử lớp 7: Hướng dẫn chi tiết cách vẽ sơ đồ cấu tạo nguyên tử lớp 7 giúp học sinh nắm vững kiến thức cơ bản về cấu trúc nguyên tử. Bài viết này cung cấp các bước vẽ sơ đồ đơn giản, kèm theo ví dụ minh họa rõ ràng, dễ hiểu, giúp bạn tự tin hơn trong việc học Hóa học. Cùng khám phá cách làm đúng và hiệu quả nhất ngay tại đây!
Mục lục
Hướng dẫn vẽ sơ đồ cấu tạo nguyên tử lớp 7
Việc vẽ sơ đồ cấu tạo nguyên tử là một phần quan trọng trong chương trình học môn Hóa học lớp 7. Dưới đây là các bước chi tiết để vẽ sơ đồ cấu tạo nguyên tử của một nguyên tố bất kỳ.
Các bước vẽ sơ đồ cấu tạo nguyên tử
- Xác định số proton, neutron và electron:
Số proton (\(p\)) được xác định dựa vào số hiệu nguyên tử của nguyên tố. Ví dụ, nguyên tử Cacbon có 6 proton.
Số neutron (\(n\)) được tính bằng công thức:
\[ n = A - Z \]
trong đó \(A\) là số khối (tổng số proton và neutron), \(Z\) là số hiệu nguyên tử.
Số electron (\(e\)) của nguyên tử trung hòa sẽ bằng số proton (\(e = p\)).
- Vẽ hạt nhân nguyên tử:
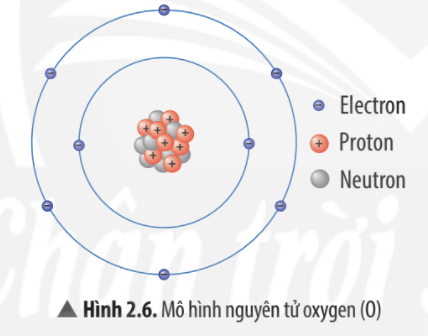
Vẽ một vòng tròn nhỏ ở trung tâm để biểu thị hạt nhân nguyên tử và ghi số proton và neutron bên trong vòng tròn này. Ví dụ, với nguyên tử oxy (O) có 8 proton và 8 neutron:
- Hạt nhân: 8\(p\), 8\(n\)
- Vẽ các lớp electron:
Vẽ các vòng tròn đồng tâm xung quanh hạt nhân để biểu thị các lớp electron. Các lớp này được đánh số từ 1 trở đi, từ trong ra ngoài.
- Điền electron vào các lớp theo quy tắc \(2n^2\):
Số electron tối đa trong mỗi lớp được xác định theo quy tắc:
\[ Số\ electron\ tối\ đa = 2n^2 \]
trong đó \(n\) là số thứ tự của lớp. Ví dụ:
- Lớp 1: \(2 \times 1^2 = 2\) electron
- Lớp 2: \(2 \times 2^2 = 8\) electron
- Lớp 3: \(2 \times 3^2 = 18\) electron
Điền electron vào từng lớp từ trong ra ngoài, theo số lượng electron đã xác định.
- Kiểm tra và hoàn thiện sơ đồ:
Kiểm tra lại số lượng electron trong mỗi lớp để đảm bảo tuân theo quy tắc \(2n^2\). Hoàn thiện sơ đồ bằng cách đảm bảo rằng tổng số electron đã được phân bố đầy đủ và chính xác.
Ví dụ minh họa
Dưới đây là một số ví dụ minh họa cách vẽ sơ đồ cấu tạo nguyên tử cho một số nguyên tố phổ biến:
| Nguyên tố | Số proton | Số neutron | Số electron | Cấu tạo sơ đồ |
|---|---|---|---|---|
| Hydro (H) | 1 | 0 | 1 |
|
| Oxy (O) | 8 | 8 | 8 |
|
| Nhôm (Al) | 13 | 14 | 13 |
|
Công thức và quy tắc quan trọng
Để vẽ sơ đồ cấu tạo nguyên tử chính xác, cần nắm vững các quy tắc và công thức sau:
- Quy tắc Aufbau: Electron sẽ điền vào các lớp orbital có mức năng lượng thấp trước. Thứ tự điền được xác định theo sơ đồ mức năng lượng.
- Nguyên lý loại trừ Pauli: Không có hai electron trong một nguyên tử có thể tồn tại cùng một trạng thái lượng tử trong cùng một orbital. Mỗi orbital chứa tối đa 2 electron với spin ngược chiều nhau.
.png)
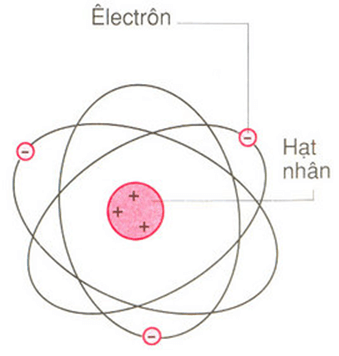
Giới thiệu về sơ đồ cấu tạo nguyên tử
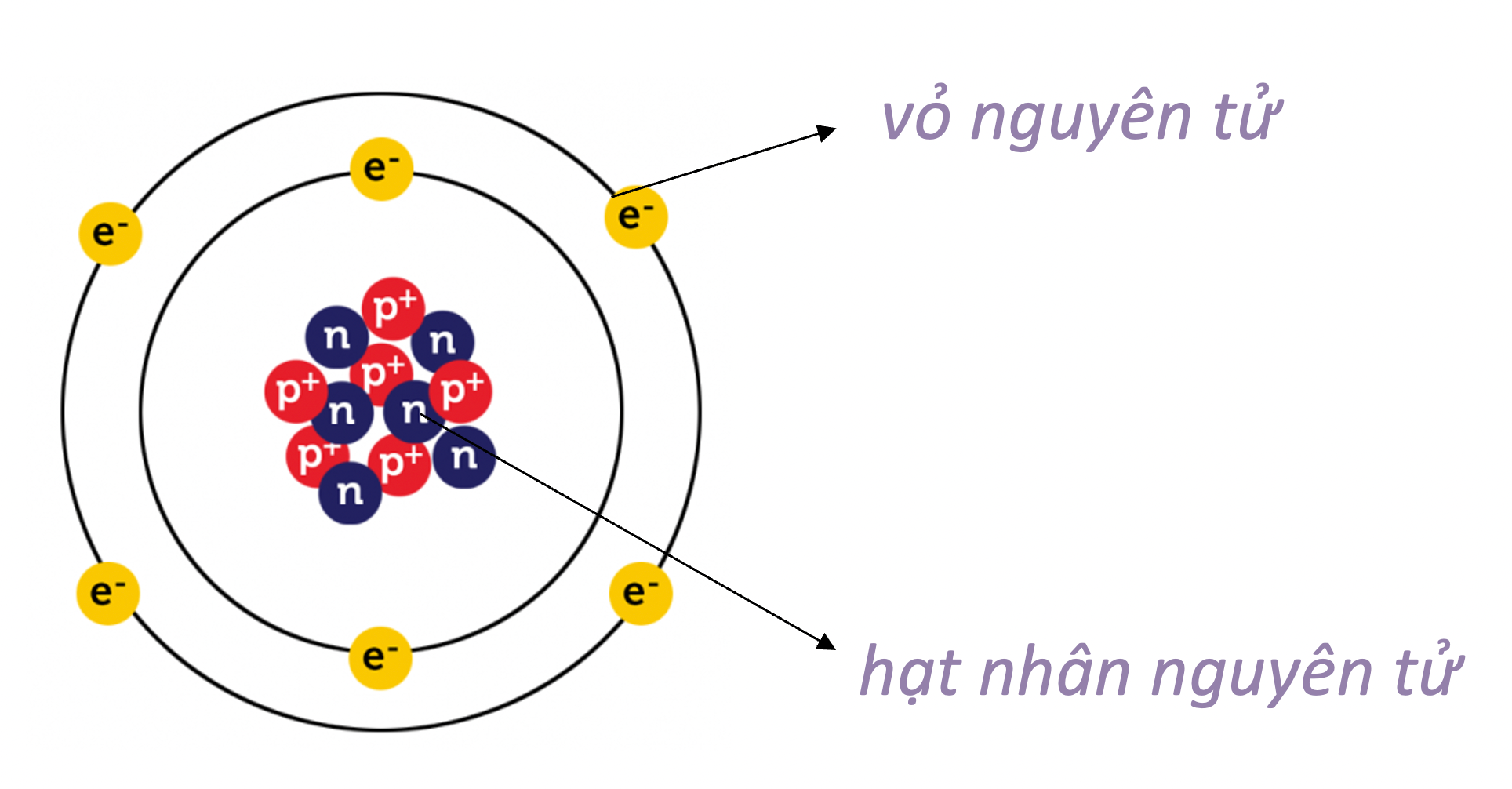
Sơ đồ cấu tạo nguyên tử là một biểu đồ thể hiện cấu trúc bên trong của một nguyên tử, giúp minh họa rõ ràng các thành phần cơ bản như proton, neutron, và electron. Các hạt này được sắp xếp trong hạt nhân và các lớp vỏ xung quanh hạt nhân nguyên tử. Việc hiểu rõ cấu trúc nguyên tử đóng vai trò quan trọng trong việc nắm bắt các khái niệm hóa học cơ bản, từ đó giúp học sinh dễ dàng hơn trong việc tiếp cận các bài học phức tạp hơn.
Trong sơ đồ cấu tạo nguyên tử, hạt nhân nằm ở trung tâm, chứa các proton và neutron. Các electron di chuyển xung quanh hạt nhân theo các lớp vỏ. Mỗi lớp vỏ có thể chứa một số lượng electron nhất định, tuân theo quy tắc:
- Lớp thứ nhất chứa tối đa \(2\) electron.
- Lớp thứ hai chứa tối đa \(8\) electron.
- Lớp thứ ba chứa tối đa \(18\) electron, và tiếp tục theo quy tắc \(2n^2\), với \(n\) là số thứ tự lớp vỏ.
Việc vẽ sơ đồ cấu tạo nguyên tử giúp học sinh hình dung rõ hơn về sự phân bố của các hạt trong một nguyên tử, từ đó hiểu được tại sao các nguyên tử có tính chất hóa học đặc trưng. Đây là nền tảng quan trọng để học sinh học tốt hơn môn Hóa học và chuẩn bị cho các bài học về liên kết hóa học, phản ứng hóa học và cấu trúc phân tử.
Quy tắc và công thức cần nhớ
Để vẽ đúng sơ đồ cấu tạo nguyên tử, học sinh cần nắm vững một số quy tắc và công thức cơ bản liên quan đến số lượng các hạt cơ bản trong nguyên tử, cách phân bố các electron trong các lớp vỏ, và cách tính toán các giá trị quan trọng.
1. Quy tắc về số lượng các hạt trong nguyên tử
- Số proton (p): Là số hiệu nguyên tử của nguyên tố, xác định tính chất hóa học của nguyên tố đó. Ví dụ, nguyên tố Hydro (H) có số proton là \(1\), nguyên tố Oxy (O) có số proton là \(8\).
- Số neutron (n): Được tính bằng công thức: \[ n = A - Z \] trong đó \(A\) là số khối (tổng số proton và neutron) và \(Z\) là số hiệu nguyên tử.
- Số electron (e): Trong một nguyên tử trung hòa, số electron luôn bằng số proton: \[ e = p \].
2. Quy tắc phân bố electron vào các lớp vỏ
- Các electron di chuyển xung quanh hạt nhân theo các lớp vỏ. Mỗi lớp vỏ chỉ chứa được một số lượng electron tối đa theo quy tắc \(2n^2\), với \(n\) là số thứ tự của lớp vỏ.
- Cụ thể:
- Lớp thứ nhất: Tối đa \(2 \times 1^2 = 2\) electron.
- Lớp thứ hai: Tối đa \(2 \times 2^2 = 8\) electron.
- Lớp thứ ba: Tối đa \(2 \times 3^2 = 18\) electron.
- Lớp thứ tư: Tối đa \(2 \times 4^2 = 32\) electron, và cứ tiếp tục theo quy tắc này.
- Các electron được điền vào các lớp vỏ từ trong ra ngoài, bắt đầu từ lớp gần hạt nhân nhất đến lớp xa hơn, cho đến khi tất cả electron được phân bố hết.
3. Công thức xác định cấu hình electron
Để xác định cấu hình electron của một nguyên tử, ta cần biết tổng số electron và phân bố chúng vào các lớp vỏ theo thứ tự năng lượng tăng dần. Công thức tổng quát để xác định cấu hình electron là:
\[ 1s^2 \ 2s^2 \ 2p^6 \ 3s^2 \ 3p^6 \ 4s^2 \ 3d^{10} \ 4p^6 \ldots \]
Trong đó:
- Ký hiệu \(s\), \(p\), \(d\), \(f\) là các kiểu quỹ đạo khác nhau mà electron có thể di chuyển.
- Chỉ số trên các chữ cái (như \(s^2\), \(p^6\)) biểu thị số lượng electron trong kiểu quỹ đạo đó.
4. Quy tắc Bát tử (Octet Rule)
Quy tắc bát tử cho biết rằng các nguyên tử có xu hướng đạt được một cấu hình electron bền vững với 8 electron trong lớp vỏ ngoài cùng. Quy tắc này giúp giải thích các hiện tượng hóa học như liên kết ion và liên kết cộng hóa trị.
Nắm vững các quy tắc và công thức trên sẽ giúp học sinh tự tin hơn trong việc vẽ sơ đồ cấu tạo nguyên tử và hiểu rõ hơn về cấu trúc và tính chất của các nguyên tố trong bảng tuần hoàn hóa học.

Những lỗi thường gặp khi vẽ sơ đồ cấu tạo nguyên tử
Trong quá trình học vẽ sơ đồ cấu tạo nguyên tử, học sinh thường gặp phải một số lỗi phổ biến do chưa nắm vững kiến thức cơ bản hoặc thiếu chú ý đến các chi tiết quan trọng. Dưới đây là các lỗi thường gặp và cách khắc phục chúng:
1. Xác định sai số lượng proton, neutron, và electron
- Lỗi: Nhiều học sinh thường nhầm lẫn giữa số lượng proton, neutron và electron, dẫn đến việc vẽ sai cấu trúc của nguyên tử.
- Cách khắc phục: Luôn nhớ rằng số proton bằng số hiệu nguyên tử (Z), số neutron được tính bằng công thức: \[ n = A - Z \], và số electron bằng số proton đối với nguyên tử trung hòa. Kiểm tra lại các số liệu trước khi vẽ sơ đồ.
2. Phân bố sai electron vào các lớp vỏ
- Lỗi: Sai sót phổ biến là điền sai số lượng electron vào các lớp vỏ, đặc biệt là lớp vỏ thứ hai và thứ ba, dẫn đến cấu trúc không chính xác.
- Cách khắc phục: Áp dụng đúng quy tắc phân bố electron theo từng lớp vỏ: lớp thứ nhất tối đa 2 electron, lớp thứ hai tối đa 8 electron, lớp thứ ba tối đa 18 electron, v.v. Hãy điền electron từ lớp trong ra ngoài và kiểm tra kỹ.
3. Vẽ sai cấu trúc hình học của sơ đồ
- Lỗi: Học sinh thường vẽ sơ đồ với hình học không chính xác, chẳng hạn như vẽ các lớp vỏ electron quá gần hoặc quá xa hạt nhân, không tuân theo nguyên tắc đối xứng.
- Cách khắc phục: Đảm bảo các lớp vỏ được vẽ đối xứng quanh hạt nhân và tuân thủ đúng khoảng cách tỷ lệ giữa các lớp để tạo nên sơ đồ trực quan và dễ hiểu.
4. Bỏ qua ký hiệu hoặc thông tin quan trọng
- Lỗi: Một số học sinh quên ghi chú các thông tin quan trọng như số proton, số neutron trong hạt nhân, hoặc số electron trên mỗi lớp vỏ.
- Cách khắc phục: Hãy luôn kiểm tra sơ đồ trước khi hoàn thành để chắc chắn rằng tất cả các thông tin cần thiết đã được ghi chú đầy đủ và chính xác.
5. Hiểu sai quy tắc Bát tử (Octet Rule)
- Lỗi: Một số học sinh hiểu nhầm quy tắc Bát tử, dẫn đến việc vẽ sai liên kết hóa học giữa các nguyên tử.
- Cách khắc phục: Nhớ rằng quy tắc Bát tử chỉ áp dụng cho các nguyên tử muốn đạt được 8 electron ở lớp vỏ ngoài cùng. Nghiên cứu kỹ các ví dụ về liên kết ion và cộng hóa trị để hiểu rõ hơn.
Việc hiểu rõ các lỗi phổ biến và cách khắc phục sẽ giúp học sinh vẽ sơ đồ cấu tạo nguyên tử chính xác hơn và nâng cao kiến thức hóa học cơ bản.

Các tài liệu và công cụ hỗ trợ học tập
Để học tốt hơn về cấu tạo nguyên tử và cách vẽ sơ đồ cấu tạo nguyên tử, học sinh có thể sử dụng các tài liệu và công cụ hỗ trợ học tập dưới đây. Những tài liệu này cung cấp kiến thức từ cơ bản đến nâng cao và giúp học sinh thực hành một cách hiệu quả.
1. Sách giáo khoa và tài liệu học tập
- Sách giáo khoa Hóa học lớp 7: Đây là tài liệu chính thức, cung cấp đầy đủ kiến thức về cấu tạo nguyên tử, các quy tắc và công thức liên quan. Sách có các bài tập và ví dụ minh họa giúp học sinh luyện tập.
- Sách tham khảo bổ trợ: Các sách tham khảo như "Cẩm nang Hóa học cơ bản" hay "Học nhanh Hóa học lớp 7" giúp củng cố kiến thức, cung cấp thêm nhiều bài tập và câu hỏi trắc nghiệm để học sinh tự đánh giá trình độ của mình.
- Tài liệu PDF miễn phí: Có thể tìm kiếm và tải xuống các tài liệu PDF miễn phí từ các trang web giáo dục, diễn đàn học tập, giúp nắm bắt nhanh chóng các khái niệm cơ bản và thực hành bài tập.
2. Công cụ trực tuyến
- Phần mềm mô phỏng cấu trúc nguyên tử: Các phần mềm như PhET Interactive Simulations, Atom Builder giúp học sinh trực quan hóa cấu tạo nguyên tử, hiểu rõ hơn về các thành phần của nguyên tử và cách chúng liên kết với nhau.
- Trang web học tập trực tuyến: Các trang web như Hocmai.vn, Olm.vn, hay Khan Academy có các bài giảng, video hướng dẫn và bài tập giúp học sinh nắm vững kiến thức một cách sinh động và hiệu quả.
- Ứng dụng học tập: Sử dụng các ứng dụng như Quizlet, Duolingo, hoặc ChemCollective để tạo ra các bộ flashcard học từ vựng, công thức, và các khái niệm hóa học một cách dễ nhớ và thú vị.
3. Công cụ hỗ trợ vẽ sơ đồ
- Giấy vẽ và bút màu: Sử dụng giấy vẽ lớn và bút màu để vẽ sơ đồ cấu tạo nguyên tử, giúp trực quan hóa các lớp vỏ và electron một cách rõ ràng.
- Bảng trắng và bút lông: Giúp thực hành vẽ sơ đồ nhanh chóng, dễ dàng sửa chữa và chia sẻ kiến thức với bạn bè, thầy cô.
- Phần mềm đồ họa: Sử dụng các phần mềm như Microsoft PowerPoint, Paint, hoặc các công cụ vẽ trực tuyến như Canva để tạo sơ đồ cấu tạo nguyên tử chuyên nghiệp và sáng tạo hơn.
4. Nhóm học tập và thảo luận
- Tham gia nhóm học tập: Học sinh có thể tham gia các nhóm học tập trong lớp hoặc trên các nền tảng trực tuyến như Facebook, Zalo để thảo luận và giải đáp thắc mắc với bạn bè và thầy cô.
- Tham gia các diễn đàn học tập: Các diễn đàn như HOCMAI, diendantoanhoc.net, hoặc Reddit cung cấp cơ hội cho học sinh giao lưu, học hỏi và chia sẻ kiến thức với cộng đồng học sinh và giáo viên trên toàn thế giới.
Việc sử dụng đa dạng các tài liệu và công cụ hỗ trợ sẽ giúp học sinh nắm vững kiến thức, cải thiện kỹ năng và đạt kết quả học tập tốt hơn trong môn Hóa học.

Lợi ích của việc hiểu rõ cấu trúc nguyên tử
Hiểu rõ cấu trúc nguyên tử là một trong những yếu tố then chốt giúp học sinh nắm vững nền tảng kiến thức Hóa học. Việc này không chỉ mang lại lợi ích trong học tập mà còn có những ứng dụng thiết thực trong đời sống hàng ngày.
- Nắm vững kiến thức nền tảng trong Hóa học: Cấu trúc nguyên tử là nền tảng của nhiều khái niệm trong Hóa học. Hiểu được cấu trúc của nguyên tử giúp học sinh dễ dàng tiếp thu các bài học về phản ứng hóa học, liên kết hóa học, và tính chất của các nguyên tố.
- Cải thiện khả năng giải quyết các bài toán Hóa học: Khi học sinh nắm rõ cấu trúc nguyên tử, việc giải các bài toán liên quan đến phân tử, phản ứng hóa học sẽ trở nên dễ dàng hơn. Ví dụ, việc hiểu rõ sự phân bố electron trong các lớp vỏ nguyên tử sẽ giúp học sinh dự đoán được tính chất hóa học của các nguyên tố.
- Ứng dụng kiến thức vào thực tế: Cấu trúc nguyên tử không chỉ có giá trị trong sách vở mà còn có nhiều ứng dụng trong đời sống thực tế. Chẳng hạn, việc hiểu về nguyên tử giúp giải thích được tại sao các vật liệu có tính chất khác nhau như dẫn điện, cách nhiệt, hoặc phản ứng hóa học khi tiếp xúc với các chất khác.
Nhờ vào việc hiểu rõ cấu trúc nguyên tử, học sinh không chỉ đạt kết quả tốt hơn trong các kỳ thi mà còn phát triển tư duy logic, khả năng giải quyết vấn đề và sự sáng tạo trong các môn học khoa học khác.
XEM THÊM:
Kết luận
Sơ đồ cấu tạo nguyên tử là một công cụ quan trọng giúp học sinh hiểu rõ hơn về cấu trúc cơ bản của các nguyên tử. Qua quá trình học tập và thực hành, học sinh không chỉ nắm vững các khái niệm như số proton, neutron, electron mà còn hiểu được cách các hạt này phân bố trong các lớp khác nhau của nguyên tử.
Việc vẽ sơ đồ cấu tạo nguyên tử lớp 7 đòi hỏi sự chính xác và tỉ mỉ, từ việc xác định số lượng các hạt trong hạt nhân đến việc phân bố electron theo các lớp theo quy tắc \(2n^2\). Qua từng bước thực hiện, học sinh có thể tự mình kiểm tra và hoàn thiện sơ đồ để đảm bảo tính chính xác và đầy đủ.
Cuối cùng, việc nắm vững cách vẽ sơ đồ cấu tạo nguyên tử không chỉ giúp học sinh đạt kết quả tốt trong học tập mà còn là nền tảng cho những hiểu biết sâu hơn về hóa học trong tương lai. Bằng cách thực hành thường xuyên và làm quen với các dạng nguyên tử khác nhau, học sinh sẽ có được sự tự tin và kỹ năng cần thiết để tiếp cận các khái niệm phức tạp hơn trong môn học này.