Chủ đề biết x có cấu tạo nguyên tử như sau: Bài viết này sẽ giúp bạn hiểu rõ hơn về cấu tạo nguyên tử của nguyên tố X, vị trí của nó trong bảng tuần hoàn, cùng những tính chất hóa học đặc trưng và ứng dụng thực tiễn của nguyên tố này trong cuộc sống hàng ngày.
Mục lục
Cấu Tạo Nguyên Tử Và Vị Trí Của Nguyên Tố X Trong Bảng Tuần Hoàn
Nguyên tố X có cấu tạo nguyên tử với các đặc điểm nổi bật sau:
- Điện tích hạt nhân: \(12+\)
- Số lớp electron: 3 lớp
- Số electron ở lớp ngoài cùng: 2 electron
Vị Trí Của Nguyên Tố X Trong Bảng Tuần Hoàn
Dựa trên cấu tạo nguyên tử, nguyên tố X được xác định nằm trong:
- Chu kỳ: 3
- Nhóm: IIA (Nhóm 2)
Nguyên tố X thuộc nhóm IIA, chu kỳ 3 trong bảng tuần hoàn, và có tính chất hóa học đặc trưng của kim loại kiềm thổ.
Cấu Hình Electron Của Nguyên Tố X
Cấu hình electron của X có thể được biểu diễn như sau:
\[ 1s^2 2s^2 2p^6 3s^2 \]
Tính Chất Hóa Học Cơ Bản
Với cấu hình electron và vị trí trong bảng tuần hoàn, nguyên tố X có các tính chất hóa học sau:
- X có tính khử mạnh, dễ dàng nhường 2 electron ở lớp ngoài cùng để đạt cấu hình bền vững của khí hiếm.
- X tác dụng với oxy tạo thành oxit bazơ.
- X cũng phản ứng với nước, mặc dù chậm hơn các kim loại kiềm, tạo ra dung dịch kiềm và giải phóng khí hydro.

.png)
1. Giới Thiệu Về Cấu Tạo Nguyên Tử Của Nguyên Tố X
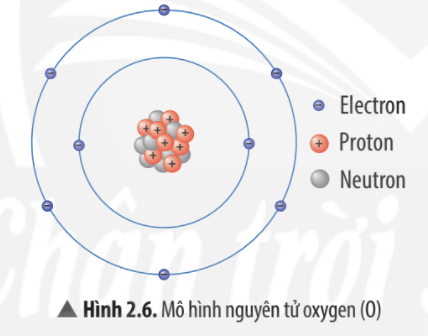
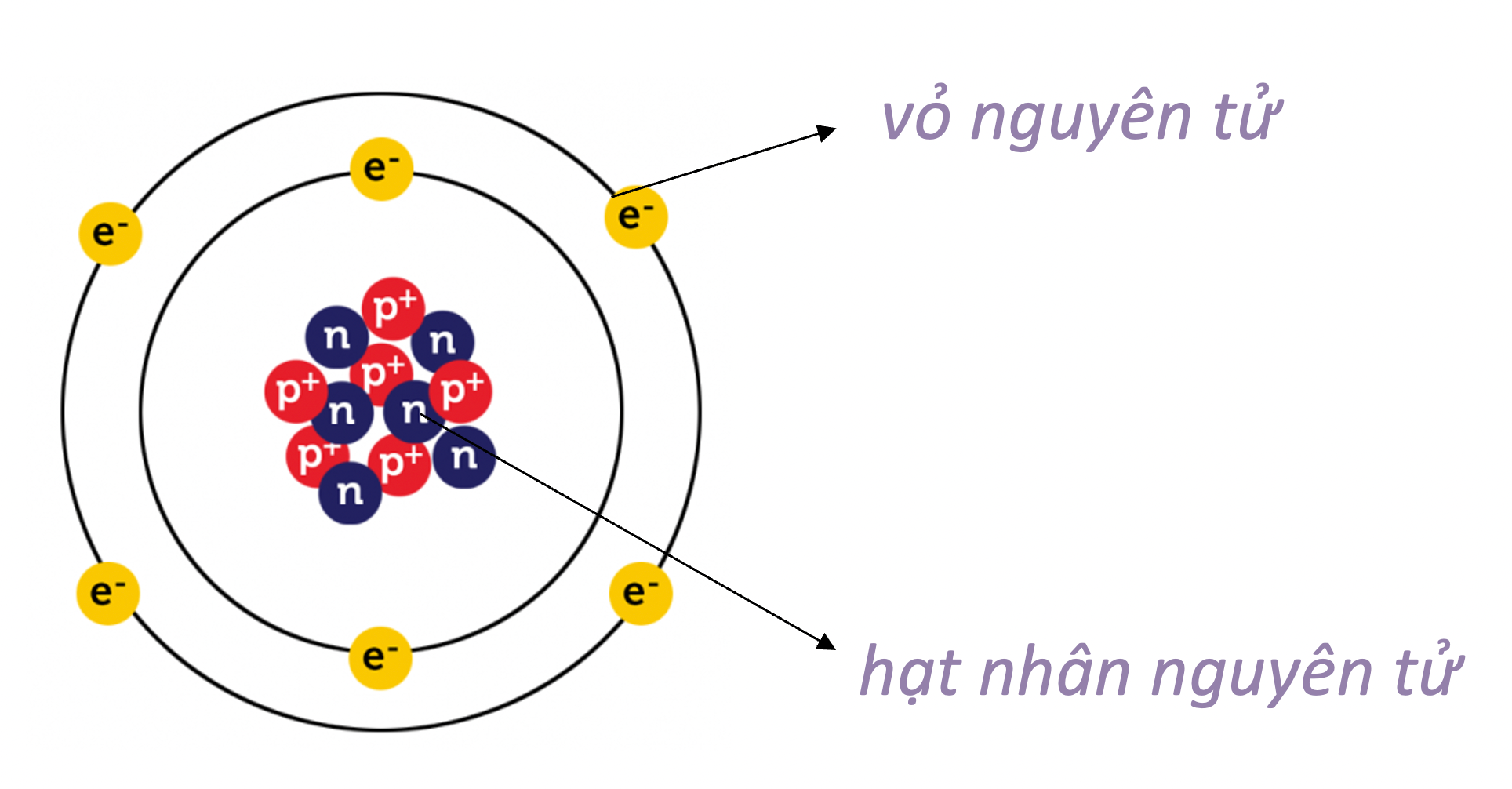
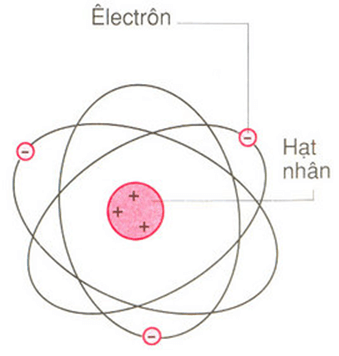
Nguyên tử của nguyên tố X được cấu tạo bởi ba loại hạt cơ bản: electron, proton và neutron. Trong đó:
- Electron (\(e^-\)): Có điện tích âm và di chuyển quanh hạt nhân nguyên tử trong các lớp vỏ electron.
- Proton (\(p^+\)): Có điện tích dương và nằm trong hạt nhân nguyên tử cùng với neutron.
- Neutron (\(n\)): Không mang điện tích và cũng nằm trong hạt nhân nguyên tử.
Cấu tạo chi tiết của nguyên tử X có thể được biểu diễn như sau:
- Số proton (\(Z\)): Số lượng proton trong hạt nhân quyết định nguyên tố X là gì. Proton mang điện tích dương và số proton bằng với số electron trong nguyên tử trung hòa.
- Số neutron (\(N\)): Neutron không mang điện và cùng với proton tạo thành khối lượng của nguyên tử. Số neutron có thể khác nhau, tạo ra các đồng vị khác nhau của nguyên tố X.
- Số electron (\(e^-\)): Electron di chuyển trong các lớp vỏ xung quanh hạt nhân và quyết định tính chất hóa học của nguyên tố X. Trong trạng thái trung hòa, số electron bằng với số proton.
Với nguyên tố X cụ thể, ta có các thông tin cơ bản sau:
| Ký hiệu hóa học: | X |
| Số proton (\(Z\)): | \(Z\) |
| Số neutron (\(N\)): | \(N\) |
| Số electron (\(e^-\)): | \(Z\) |
| Cấu hình electron: | \(...\) |
Cấu trúc nguyên tử của nguyên tố X sẽ xác định tính chất vật lý và hóa học của nó, bao gồm cả khả năng phản ứng và liên kết với các nguyên tố khác. Việc hiểu rõ cấu tạo nguyên tử giúp chúng ta giải thích các hiện tượng và quy luật trong hóa học một cách cụ thể và chính xác.
2. Vị Trí Của Nguyên Tố X Trong Bảng Tuần Hoàn
Để xác định vị trí của nguyên tố X trong bảng tuần hoàn, chúng ta cần xét các yếu tố sau:
- Số thứ tự của ô nguyên tố: Số thứ tự của ô nguyên tố trong bảng tuần hoàn chính là số hiệu nguyên tử của nguyên tố đó. Số hiệu nguyên tử này tương ứng với tổng số proton có trong hạt nhân của nguyên tử X.
- Chu kỳ của nguyên tố: Chu kỳ của nguyên tố được xác định dựa trên số lớp electron mà nguyên tử X có. Số lớp electron càng lớn, nguyên tố sẽ nằm ở chu kỳ càng cao. Ví dụ, nếu nguyên tố X có 2 lớp electron, thì nó thuộc chu kỳ 2.
- Nhóm của nguyên tố: Để xác định nhóm của nguyên tố, ta cần xét xem nguyên tố X thuộc nhóm A hay nhóm B. Nhóm A bao gồm các nguyên tố mà electron cuối cùng được điền vào phân lớp s hoặc p. Nhóm B bao gồm các nguyên tố mà electron cuối cùng được điền vào phân lớp d hoặc f. Số thứ tự nhóm của nguyên tố sẽ bằng số electron hóa trị, đó là tổng số electron ở lớp ngoài cùng cộng với phân lớp kế bên nếu phân lớp đó chưa bão hòa.
Ví dụ, nếu nguyên tố X có cấu hình electron là \(1s^2 2s^2 2p^6 3s^1\), ta có thể xác định rằng:
- Số thứ tự của nguyên tố X là 11 (số hiệu nguyên tử).
- X thuộc chu kỳ 3 vì có 3 lớp electron.
- X thuộc nhóm IA vì electron cuối cùng điền vào phân lớp s và chỉ có 1 electron hóa trị.
Như vậy, nguyên tố X sẽ nằm ở vị trí ô số 11, chu kỳ 3, nhóm IA trong bảng tuần hoàn, tương ứng với nguyên tố Natri (Na).

3. Cấu Hình Electron Của Nguyên Tố X
Cấu hình electron của một nguyên tố là cách sắp xếp các electron trong các lớp vỏ xung quanh hạt nhân nguyên tử. Để viết cấu hình electron của nguyên tố X, ta cần tuân theo các nguyên tắc cơ bản sau:
- Nguyên tắc ngoại trừ Pauli: Mỗi orbital chỉ chứa tối đa hai electron và các electron trong cùng một orbital phải có spin ngược nhau.
- Nguyên tắc Hund: Trong một phân lớp, các orbital được điền electron sao cho số electron có cùng spin là tối đa trước khi electron với spin ngược được điền vào.
- Nguyên tắc Aufbau: Electron sẽ được điền vào các orbital có năng lượng thấp trước, sau đó mới đến các orbital có năng lượng cao hơn.
Ví dụ, nếu nguyên tố X có số hiệu nguyên tử là \(Z = 11\), cấu hình electron của X sẽ được viết như sau:
Trong cấu hình trên:
- \(1s^2\) chỉ ra rằng có 2 electron trong phân lớp 1s.
- \(2s^2\) chỉ ra rằng có 2 electron trong phân lớp 2s.
- \(2p^6\) chỉ ra rằng có 6 electron trong phân lớp 2p.
- \(3s^1\) chỉ ra rằng có 1 electron trong phân lớp 3s.
Cấu hình electron của nguyên tố X giúp xác định các tính chất hóa học của nó, bao gồm khả năng tham gia phản ứng hóa học và liên kết với các nguyên tố khác. Chẳng hạn, với cấu hình electron trên, nguyên tố X có xu hướng mất 1 electron để đạt được cấu hình bền vững của khí hiếm, do đó nó thường có tính khử mạnh.

4. Tính Chất Hóa Học Của Nguyên Tố X
Tính chất hóa học của nguyên tố X phản ánh cách thức mà nó tương tác với các nguyên tố khác và tham gia vào các phản ứng hóa học. Để hiểu rõ hơn về tính chất hóa học của nguyên tố X, chúng ta sẽ xem xét các yếu tố sau:
- 1. Khả năng phản ứng: Nguyên tố X có thể phản ứng với các phi kim mạnh như Oxi (\(O_2\)) để tạo thành oxit. Ví dụ:
- \[X + O_2 \rightarrow XO\]
- 2. Tính chất axit-bazơ: Oxit của nguyên tố X có thể thể hiện tính bazơ hoặc tính axit tùy thuộc vào tính chất của nguyên tố đó. Nếu X là kim loại, oxit của nó thường là bazơ:
- \[XO + H_2O \rightarrow X(OH)_2\]
- 3. Khả năng khử: Nguyên tố X có thể dễ dàng mất electron để trở thành ion dương (\(X^+\)), cho thấy tính khử mạnh. Điều này đặc biệt đúng nếu X là một kim loại kiềm.
- 4. Phản ứng với nước: Nếu nguyên tố X là kim loại kiềm hoặc kiềm thổ, nó có thể phản ứng mạnh với nước, tạo ra khí hidro và dung dịch bazơ:
- \[X + H_2O \rightarrow XOH + H_2\]
- 5. Phản ứng với axit: Nguyên tố X có thể phản ứng với axit mạnh như HCl, H_2SO_4 để tạo ra muối và giải phóng khí hidro:
- \[X + HCl \rightarrow XCl + H_2\]
Những tính chất hóa học này đóng vai trò quan trọng trong việc ứng dụng nguyên tố X trong các ngành công nghiệp và nghiên cứu khoa học, như trong việc chế tạo hợp kim, sản xuất hóa chất, và các phản ứng tổng hợp hóa học.

5. Ứng Dụng Của Nguyên Tố X Trong Thực Tiễn
Nguyên tố X có nhiều ứng dụng quan trọng trong thực tiễn, đặc biệt trong các lĩnh vực công nghiệp, y tế, và công nghệ. Những ứng dụng nổi bật của nguyên tố X bao gồm:
- 1. Công nghiệp: Nguyên tố X được sử dụng rộng rãi trong chế tạo hợp kim, sản xuất vật liệu xây dựng và các linh kiện điện tử nhờ tính chất cơ học và hóa học đặc trưng của nó.
- 2. Y tế: Trong y học, nguyên tố X được ứng dụng trong các thiết bị chẩn đoán hình ảnh như máy X-quang hoặc làm chất cản quang trong một số phương pháp chụp hình y học.
- 3. Công nghệ: Nguyên tố X đóng vai trò quan trọng trong sản xuất các sản phẩm công nghệ cao, bao gồm pin lithium-ion, bán dẫn và các thiết bị lưu trữ năng lượng.
- 4. Nông nghiệp: Một số hợp chất của nguyên tố X được sử dụng làm phân bón, thuốc bảo vệ thực vật và các sản phẩm hóa học khác, giúp cải thiện năng suất cây trồng.
- 5. Môi trường: Nguyên tố X còn có ứng dụng trong xử lý nước thải, xử lý khí thải công nghiệp và các quy trình bảo vệ môi trường khác.
Những ứng dụng này cho thấy nguyên tố X không chỉ quan trọng trong nghiên cứu khoa học mà còn đóng góp to lớn vào sự phát triển kinh tế và bảo vệ môi trường.