Chủ đề trình bày cấu tạo của nguyên tử: Trình bày cấu tạo của nguyên tử là một chủ đề quan trọng trong hóa học, giúp bạn hiểu rõ về thành phần và cấu trúc cơ bản của vật chất. Bài viết này sẽ cung cấp cái nhìn toàn diện và chi tiết về nguyên tử, từ các hạt cơ bản đến mô hình hiện đại, giúp bạn nắm vững kiến thức cơ bản và chuyên sâu.
Mục lục
Cấu Tạo Của Nguyên Tử
Nguyên tử là đơn vị cơ bản của vật chất, cấu thành nên mọi vật thể trong vũ trụ. Cấu tạo của nguyên tử gồm ba thành phần chính: proton, neutron và electron.
1. Cấu Tạo Hạt Nhân Nguyên Tử
Hạt nhân nguyên tử được tạo thành từ các hạt proton và neutron:
- Proton: Proton là hạt mang điện tích dương, nằm trong hạt nhân nguyên tử. Số lượng proton trong hạt nhân quyết định tính chất hóa học của nguyên tố và gọi là số nguyên tử \(Z\).
- Neutron: Neutron là hạt không mang điện, cùng với proton tạo nên hạt nhân nguyên tử. Số lượng neutron có thể thay đổi trong các đồng vị khác nhau của một nguyên tố.
2. Lớp Vỏ Electron
Electron là hạt mang điện tích âm, chuyển động xung quanh hạt nhân trong các lớp vỏ electron. Các electron được sắp xếp theo các mức năng lượng khác nhau:
- Lớp K: Lớp vỏ thứ nhất gần hạt nhân nhất, chỉ chứa tối đa 2 electron.
- Lớp L: Lớp vỏ thứ hai có thể chứa tối đa 8 electron.
- Lớp M: Lớp vỏ thứ ba chứa tối đa 18 electron.
- Lớp N: Lớp vỏ thứ tư có thể chứa tối đa 32 electron.
3. Số Khối \(A\)
Số khối của nguyên tử \(A\) là tổng số proton \(Z\) và neutron \(N\) trong hạt nhân:
Số khối quyết định khối lượng của nguyên tử.
4. Đồng Vị
Đồng vị là các biến thể của một nguyên tố hóa học, trong đó số lượng proton là như nhau nhưng số lượng neutron khác nhau, dẫn đến số khối khác nhau:
- Ví dụ: \(^{12}_6C\), \(^{13}_6C\), và \(^{14}_6C\) là các đồng vị của nguyên tố carbon.
5. Số Hiệu Nguyên Tử \(Z\)
Số hiệu nguyên tử \(Z\) biểu thị số lượng proton trong hạt nhân của một nguyên tử. Đây là yếu tố quyết định tính chất hóa học của nguyên tố:
- Ví dụ: \(Z = 1\) là nguyên tố Hydrogen, \(Z = 6\) là nguyên tố Carbon.
6. Mô Hình Nguyên Tử
Các mô hình nguyên tử phổ biến bao gồm:
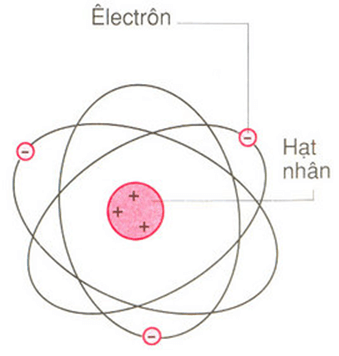
- Mô hình Rutherford: Mô hình đầu tiên xác định rằng hạt nhân nằm ở trung tâm và electron chuyển động xung quanh.
- Mô hình Bohr: Phát triển từ mô hình Rutherford, Bohr mô tả electron di chuyển trên các quỹ đạo cố định quanh hạt nhân.
.png)
1. Khái Niệm Về Nguyên Tử
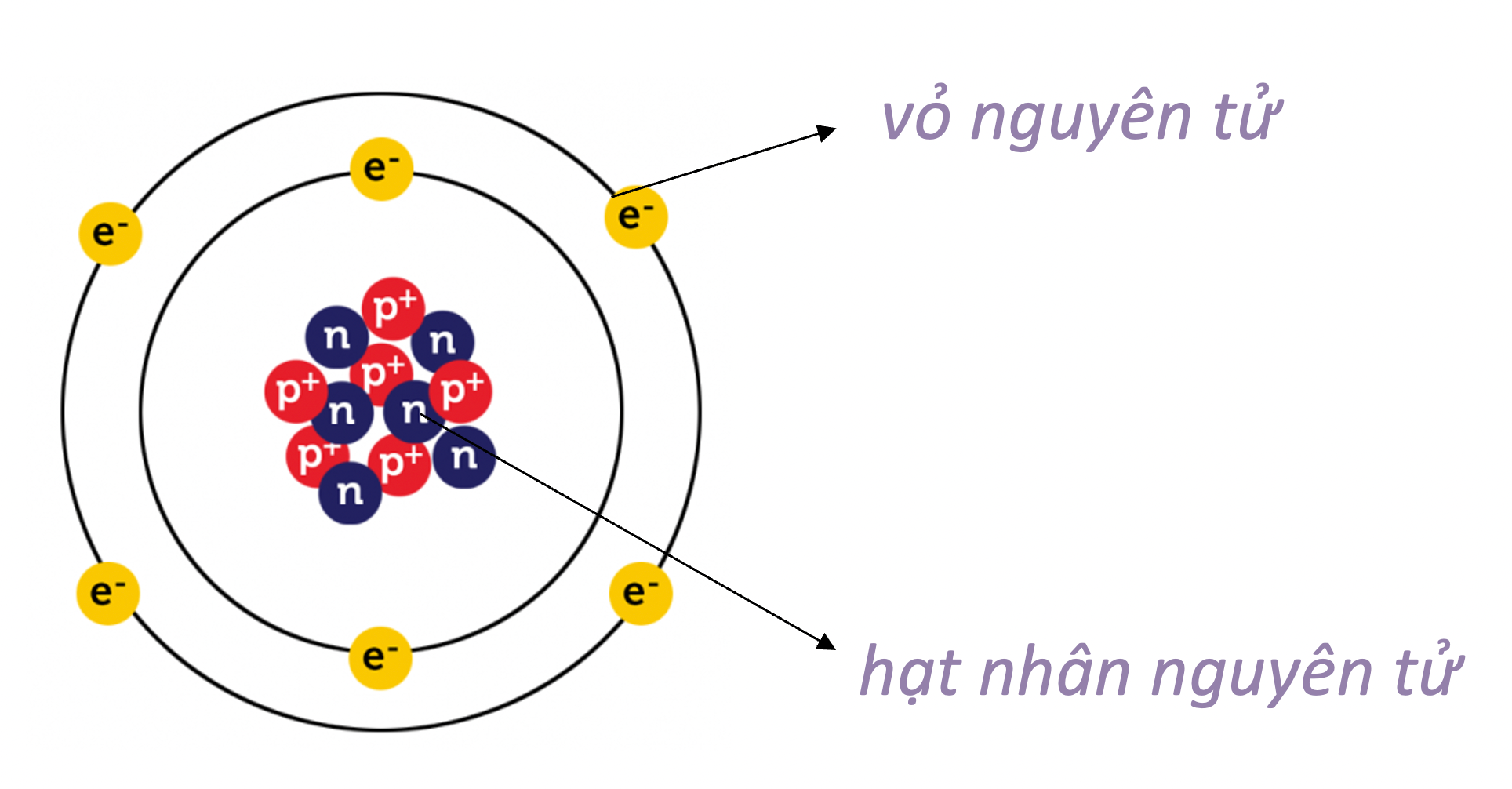
Nguyên tử là đơn vị nhỏ nhất của vật chất, có khả năng tham gia vào các phản ứng hóa học mà không bị phá vỡ. Mỗi nguyên tử bao gồm một hạt nhân trung tâm và các hạt electron quay xung quanh. Hạt nhân được cấu tạo từ proton (mang điện tích dương) và neutron (không mang điện tích).
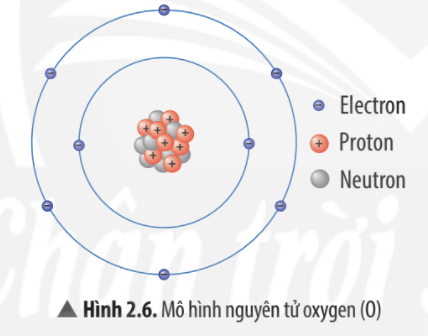
Nguyên tử là cơ sở của tất cả các nguyên tố hóa học, với số lượng proton xác định trong hạt nhân quyết định loại nguyên tố. Ví dụ, nguyên tử cacbon có 6 proton, trong khi nguyên tử oxy có 8 proton.
1.1. Định Nghĩa Nguyên Tử
Nguyên tử là hạt vô cùng nhỏ và là thành phần cấu tạo cơ bản của tất cả các chất. Mỗi nguyên tử bao gồm một hạt nhân nằm ở trung tâm, xung quanh là các electron di chuyển trong không gian theo các quỹ đạo nhất định.
1.2. Lịch Sử Phát Triển Của Thuyết Nguyên Tử
Khái niệm về nguyên tử đã được các nhà triết học Hy Lạp cổ đại đề xuất từ thế kỷ thứ 5 TCN. Tuy nhiên, chỉ đến thế kỷ 19, các nghiên cứu khoa học hiện đại của John Dalton mới đưa ra khái niệm nguyên tử trong hóa học.
Vào đầu thế kỷ 20, các nhà khoa học như Ernest Rutherford và Niels Bohr đã phát triển các mô hình nguyên tử nhằm giải thích cấu trúc và hành vi của nguyên tử. Những mô hình này đã dẫn đến sự phát triển của cơ học lượng tử và sự hiểu biết hiện đại về nguyên tử.
2. Cấu Trúc Hạt Nhân Nguyên Tử
Hạt nhân nguyên tử là trung tâm của nguyên tử, nơi chứa phần lớn khối lượng của nguyên tử và bao gồm hai loại hạt cơ bản: proton và neutron. Các hạt này được gọi chung là nucleon.
2.1 Proton và Neutron
- Proton: Hạt proton mang điện tích dương (+1) và có khối lượng khoảng \(1.6726 \times 10^{-27}\) kg. Số lượng proton trong hạt nhân quyết định số hiệu nguyên tử (\(Z\)) và xác định nguyên tố hóa học.
- Neutron: Neutron không mang điện tích, có khối lượng xấp xỉ proton, khoảng \(1.6750 \times 10^{-27}\) kg. Neutron góp phần làm tăng khối lượng nguyên tử và giúp ổn định hạt nhân.
2.2 Số Khối và Đồng Vị
Số khối (\(A\)) của một nguyên tử được tính bằng tổng số proton và neutron trong hạt nhân:
Trong đó:
- \(Z\) là số proton.
- \(N\) là số neutron.
Các nguyên tử của cùng một nguyên tố nhưng có số neutron khác nhau được gọi là đồng vị. Ví dụ:
- Carbon-12: Có 6 proton và 6 neutron.
- Carbon-14: Có 6 proton và 8 neutron, là đồng vị phóng xạ.
2.3 Độ Hụt Khối và Năng Lượng Liên Kết
Trong hạt nhân, tổng khối lượng của các proton và neutron riêng lẻ luôn lớn hơn khối lượng của hạt nhân sau khi chúng liên kết. Sự chênh lệch này được gọi là độ hụt khối (\(\Delta m\)), và được tính bằng công thức:
Trong đó:
- \(m_p\) là khối lượng của proton.
- \(m_n\) là khối lượng của neutron.
- \(m_X\) là khối lượng của hạt nhân.
Độ hụt khối này liên quan đến năng lượng liên kết (\(W_{lk}\)) của hạt nhân, tức là năng lượng cần thiết để tách toàn bộ các nucleon ra xa nhau:
Trong đó \(c\) là tốc độ ánh sáng trong chân không.
2.4 Tính Ổn Định Của Hạt Nhân
Sự ổn định của hạt nhân phụ thuộc vào tỷ lệ giữa số neutron và số proton. Nếu số neutron quá nhiều hoặc quá ít so với số proton, hạt nhân sẽ không ổn định và có thể phân rã phóng xạ. Ví dụ, đồng vị Carbon-14 phân rã để trở thành Nitơ-14 thông qua quá trình phân rã beta.

3. Lớp Vỏ Electron
Lớp vỏ electron của nguyên tử bao gồm các electron chuyển động nhanh xung quanh hạt nhân, tạo nên một không gian rộng lớn so với kích thước hạt nhân. Các electron không di chuyển theo quỹ đạo cố định mà xuất hiện tại những vùng không gian khác nhau gọi là "orbital."
3.1. Cấu Tạo và Số Lớp Electron
Electron được sắp xếp thành các lớp dựa trên mức năng lượng. Các lớp này được ký hiệu bằng các chữ cái như K, L, M, N,... tương ứng với các mức n = 1, 2, 3, 4,... Trong đó, các electron gần hạt nhân hơn sẽ có mức năng lượng thấp hơn và liên kết mạnh mẽ với hạt nhân. Ngược lại, các electron ở lớp ngoài cùng có năng lượng cao hơn và dễ bị tách ra khỏi nguyên tử.
- Lớp K (n = 1) chỉ có một phân lớp \(s\), chứa tối đa 2 electron.
- Lớp L (n = 2) có hai phân lớp \(s\) và \(p\), chứa tối đa 8 electron.
- Lớp M (n = 3) có ba phân lớp \(s\), \(p\), và \(d\), chứa tối đa 18 electron.
- Lớp N (n = 4) có bốn phân lớp \(s\), \(p\), \(d\), và \(f\), chứa tối đa 32 electron.
3.2. Các Mức Năng Lượng của Electron
Các electron trong nguyên tử tuân theo nguyên lý xây dựng, lần lượt lấp đầy các mức năng lượng từ thấp đến cao. Mỗi lớp electron tương ứng với một mức năng lượng nhất định, và mỗi electron sẽ chọn vị trí ở lớp có năng lượng thấp nhất mà còn trống. Điều này giúp giữ cho nguyên tử ổn định hơn.
Các phân lớp electron trong cùng một lớp có mức năng lượng tương đối gần nhau, nhưng chúng vẫn có sự khác biệt nhỏ về năng lượng. Ví dụ, phân lớp \(s\) có mức năng lượng thấp hơn so với phân lớp \(p\), và \(p\) thấp hơn \(d\),...
3.3. Phân Bố Electron trong Nguyên Tử
Số electron tối đa trong một lớp được xác định theo công thức:
Trong đó, \(n\) là số lớp electron. Ví dụ, lớp \(K\) (n = 1) có thể chứa tối đa 2 electron, lớp \(L\) (n = 2) chứa tối đa 8 electron, và lớp \(M\) (n = 3) chứa tối đa 18 electron.
Các electron sẽ được sắp xếp vào các lớp từ mức năng lượng thấp đến cao, với các electron ở lớp ngoài cùng quyết định tính chất hóa học của nguyên tử.

XEM THÊM:
4. Mô Hình Nguyên Tử
Mô hình nguyên tử là một khái niệm quan trọng để giải thích cấu trúc và hành vi của nguyên tử. Theo thời gian, có nhiều mô hình khác nhau được đề xuất để diễn tả cách thức các hạt bên trong nguyên tử sắp xếp và tương tác với nhau.
4.1 Mô Hình Nguyên Tử Rutherford
Vào năm 1911, Ernest Rutherford đề xuất mô hình nguyên tử đầu tiên, cho rằng nguyên tử bao gồm một hạt nhân nhỏ gọn ở giữa và các electron chuyển động xung quanh hạt nhân theo quỹ đạo giống như hành tinh quay quanh mặt trời. Tuy nhiên, mô hình này không giải thích được tại sao các electron không bị hút vào hạt nhân.
4.2 Mô Hình Nguyên Tử Bohr
Niels Bohr đã cải tiến mô hình của Rutherford vào năm 1913. Ông cho rằng các electron di chuyển xung quanh hạt nhân theo các quỹ đạo có mức năng lượng nhất định và chỉ có thể tồn tại ở những mức năng lượng này. Khi electron chuyển từ một quỹ đạo có mức năng lượng cao hơn sang quỹ đạo có mức năng lượng thấp hơn, nó phát ra một photon với năng lượng tương ứng.
- Quỹ đạo năng lượng: Mỗi quỹ đạo được xác định bởi số lượng tử chính \(n\), với quỹ đạo càng xa hạt nhân thì mức năng lượng càng cao.
- Phát xạ và hấp thụ năng lượng: Electron chỉ phát ra hoặc hấp thụ năng lượng khi chúng nhảy từ quỹ đạo này sang quỹ đạo khác. Công thức tính năng lượng phát ra là: \[ \Delta E = -13.6 \, \text{eV} \left( \frac{1}{n_2^2} - \frac{1}{n_1^2} \right) \] trong đó \(n_1\) và \(n_2\) là các số lượng tử của hai quỹ đạo.
- Định lượng hóa năng lượng: Bohr đã đưa ra khái niệm định lượng hóa năng lượng, chỉ ra rằng năng lượng của các electron trong nguyên tử chỉ có thể nhận các giá trị rời rạc.
4.3 Mô Hình Nguyên Tử Hiện Đại
Mô hình hiện đại của nguyên tử dựa trên cơ học lượng tử, trong đó các electron không di chuyển theo các quỹ đạo cố định, mà thay vào đó chúng tồn tại trong các "đám mây xác suất" xung quanh hạt nhân. Điều này mang lại sự mô tả chính xác hơn về vị trí và hành vi của electron.
| Mô hình | Đặc điểm chính |
|---|---|
| Rutherford | Hạt nhân trung tâm và các electron quay xung quanh theo quỹ đạo. |
| Bohr | Electron chuyển động trong các quỹ đạo năng lượng xác định, phát xạ hoặc hấp thụ năng lượng khi chuyển quỹ đạo. |
| Cơ học lượng tử | Electron tồn tại trong các đám mây xác suất, không có quỹ đạo cố định. |

5. Đồng Vị và Ứng Dụng
Đồng vị là các nguyên tử của cùng một nguyên tố có cùng số proton nhưng khác nhau về số neutron. Điều này dẫn đến sự khác biệt trong số khối của các đồng vị. Mặc dù các đồng vị có tính chất hóa học giống nhau, nhưng sự khác biệt về khối lượng nguyên tử khiến chúng có các ứng dụng rất đặc biệt trong khoa học và đời sống.
5.1. Phân loại đồng vị
Các đồng vị có thể được phân thành hai loại chính:
- Đồng vị bền: Không tự phát ra bức xạ và tồn tại ổn định trong tự nhiên.
- Đồng vị phóng xạ: Không ổn định và tự phân rã để phát ra bức xạ, thường được sử dụng trong nhiều ứng dụng khoa học.
5.2. Ứng dụng của đồng vị
5.2.1. Trong Y học
- Chẩn đoán và điều trị bệnh ung thư bằng phương pháp xạ trị.
- Sử dụng Technetium-99m để chụp ảnh y khoa, đặc biệt trong việc xác định sự phát triển của khối u và các bệnh lý liên quan đến mạch máu.
- Phân tích miễn dịch phóng xạ để phát hiện các bệnh lý liên quan đến tuyến giáp.
5.2.2. Trong Công nghiệp
- Đồng vị Coban-60 được sử dụng để khử trùng thiết bị y tế và bảo quản thực phẩm bằng cách diệt khuẩn.
- Sử dụng Caesium-137 trong việc đo độ dày của các vật liệu công nghiệp.
5.2.3. Trong Nông nghiệp
- Sử dụng đồng vị phóng xạ để theo dõi sự hấp thụ phân bón của cây trồng và tối ưu hóa quá trình bón phân.
- Xử lý bức xạ để cải thiện chất lượng và năng suất cây trồng.
5.3. Tính toán nguyên tử khối trung bình
Nguyên tử khối trung bình của một nguyên tố được tính dựa trên tỉ lệ phần trăm của các đồng vị và khối lượng của từng đồng vị. Công thức tính nguyên tử khối trung bình:
Trong đó:
- \(M_1, M_2,..., M_n\): Nguyên tử khối của các đồng vị.
- \(x_1, x_2,..., x_n\): Tỉ lệ phần trăm của từng đồng vị.
5.4. Ví dụ tính toán
Giả sử nguyên tố X có hai đồng vị với khối lượng lần lượt là \(M_1 = 35\) và \(M_2 = 37\), với tỉ lệ phần trăm là 75,77% và 24,23%. Nguyên tử khối trung bình của X được tính như sau:
Vậy, nguyên tử khối trung bình của nguyên tố X là 35,48.
6. Vai Trò Của Nguyên Tử Trong Hóa Học
Nguyên tử đóng vai trò trung tâm trong hóa học, vì mọi quá trình hóa học đều xảy ra thông qua sự tương tác giữa các nguyên tử. Vai trò của nguyên tử được thể hiện qua những khía cạnh sau:
- Cấu trúc của nguyên tử quyết định tính chất của nguyên tố
- Nguyên tử là đơn vị cơ bản của phản ứng hóa học
- Đồng vị của nguyên tử ảnh hưởng đến ứng dụng trong các lĩnh vực
- Liên kết hóa học và phân tử
Nguyên tử bao gồm hạt nhân chứa proton và neutron, cùng với các electron di chuyển xung quanh hạt nhân theo các lớp vỏ. Số lượng proton xác định nguyên tố, trong khi số lượng electron và cách chúng sắp xếp quyết định tính chất hóa học của nguyên tố đó. Ví dụ, hai nguyên tố khác nhau sẽ có số proton khác nhau, do đó có những tính chất hóa học khác nhau.
Trong các phản ứng hóa học, các nguyên tử tham gia vào sự tái sắp xếp liên kết giữa các electron để tạo ra những phân tử hoặc hợp chất mới. Ví dụ, trong phản ứng giữa hydro và oxy, các nguyên tử hydro kết hợp với nguyên tử oxy để tạo thành nước.
Các đồng vị của một nguyên tố là những nguyên tử có cùng số proton nhưng khác nhau về số neutron. Sự khác biệt này có thể làm thay đổi các tính chất vật lý của nguyên tử, đặc biệt là trong các ứng dụng thực tiễn như y học, nghiên cứu hạt nhân và định tuổi bằng phương pháp carbon. Đồng vị carbon-14 được sử dụng để xác định tuổi của các mẫu vật cổ xưa, trong khi đồng vị uranium được dùng trong các lò phản ứng hạt nhân.
Nguyên tử kết hợp với nhau thông qua các liên kết hóa học, tạo thành các phân tử và hợp chất. Các loại liên kết bao gồm liên kết cộng hóa trị, liên kết ion và liên kết kim loại. Mỗi loại liên kết có tính chất và vai trò khác nhau trong các phản ứng và tính chất vật lý của chất. Ví dụ, liên kết ion giữa natri (Na) và clo (Cl) tạo thành hợp chất NaCl (muối ăn), một chất rắn ion đặc trưng.
Như vậy, nguyên tử là đơn vị cơ bản trong hóa học, quyết định tính chất của các chất và giữ vai trò quan trọng trong mọi phản ứng hóa học. Việc hiểu rõ cấu trúc và chức năng của nguyên tử giúp chúng ta ứng dụng trong nhiều lĩnh vực khác nhau của cuộc sống và khoa học.