Chủ đề cấu tạo nguyên tử carbon: Nguyên tử carbon đóng vai trò quan trọng trong hóa học và sinh học. Bài viết này sẽ đưa bạn khám phá chi tiết cấu tạo nguyên tử carbon, từ hạt nhân, lớp vỏ electron cho đến các đồng vị và liên kết hóa học của nó, giúp bạn hiểu rõ hơn về nguyên tố không thể thiếu này trong cuộc sống.
Mục lục
Cấu tạo nguyên tử Carbon
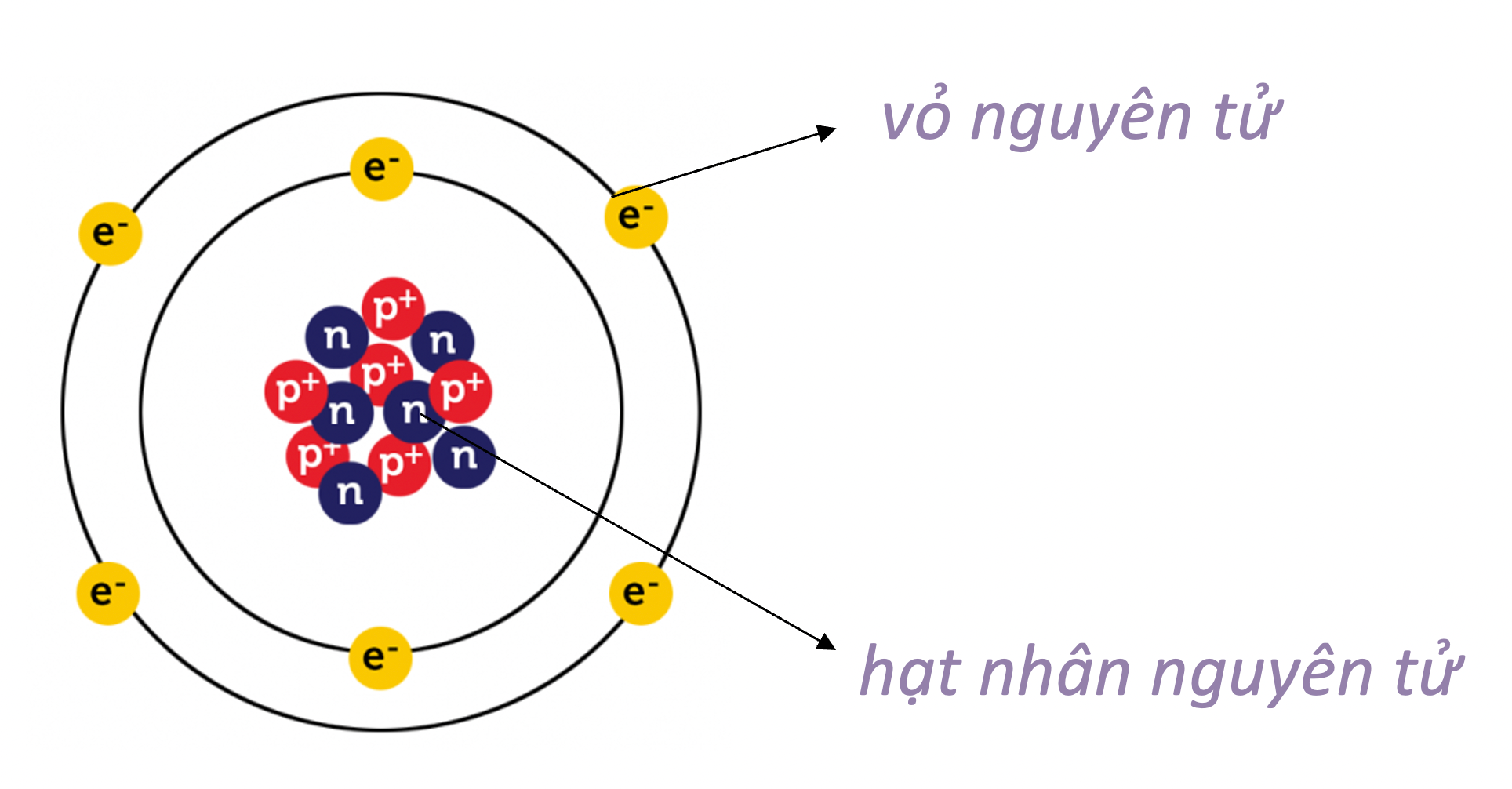
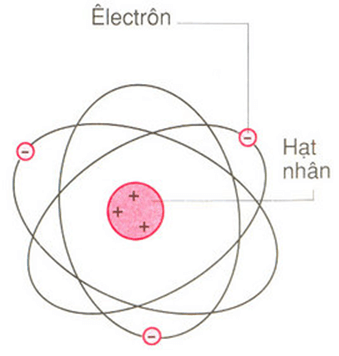
Nguyên tử carbon là một trong những nguyên tử cơ bản và quan trọng nhất trong hóa học, đóng vai trò then chốt trong các phân tử hữu cơ và cấu trúc của sự sống. Nguyên tử carbon có số hiệu nguyên tử là 6, nghĩa là trong hạt nhân của nó có 6 proton. Cấu trúc của nguyên tử carbon có thể được mô tả chi tiết như sau:
Cấu trúc của nguyên tử carbon
- Hạt nhân: Hạt nhân của nguyên tử carbon bao gồm 6 proton mang điện tích dương và thường có 6 neutron không mang điện tích, tuy nhiên số neutron có thể thay đổi trong các đồng vị khác nhau của carbon.
- Lớp vỏ electron: Các electron mang điện tích âm chuyển động xung quanh hạt nhân theo các lớp vỏ. Nguyên tử carbon có 6 electron, được phân bố vào hai lớp vỏ:
- Lớp thứ nhất (gần hạt nhân nhất): Chứa 2 electron.
- Lớp thứ hai: Chứa 4 electron.
Các đồng vị của carbon
Carbon có một số đồng vị, nhưng phổ biến nhất là:
- Carbon-12 (C-12): Đồng vị ổn định, chiếm 98.89% carbon tự nhiên. Hạt nhân chứa 6 proton và 6 neutron.
- Carbon-13 (C-13): Đồng vị ổn định, chiếm khoảng 1.11% carbon tự nhiên. Hạt nhân chứa 6 proton và 7 neutron.
- Carbon-14 (C-14): Đồng vị phóng xạ, được sử dụng trong phương pháp xác định niên đại bằng cacbon, hạt nhân chứa 6 proton và 8 neutron.
Liên kết hóa học của carbon
Carbon có khả năng tạo ra nhiều loại liên kết hóa học do có 4 electron ở lớp ngoài cùng, cho phép nó tạo ra 4 liên kết cộng hóa trị với các nguyên tử khác. Một số liên kết quan trọng của carbon bao gồm:
- Liên kết đơn (\(\sigma\)): Carbon có thể tạo liên kết đơn với các nguyên tử khác, như trong các hợp chất ankan.
- Liên kết đôi (\(\pi\)): Carbon có thể tạo liên kết đôi, như trong các hợp chất anken.
- Liên kết ba (\(\pi + \pi\)): Carbon có thể tạo liên kết ba, như trong các hợp chất ankin.
Tầm quan trọng của carbon trong đời sống
Carbon là nền tảng của hóa học hữu cơ và sinh học, là nguyên tố chính tạo nên các hợp chất hữu cơ và là thành phần cấu tạo của các tế bào sống. Khả năng tạo ra các chuỗi carbon dài và phức tạp làm cho carbon trở thành nguyên tố không thể thiếu trong việc hình thành sự sống trên Trái Đất.
.png)
1. Giới thiệu về nguyên tử Carbon
Carbon là nguyên tố hóa học có số hiệu nguyên tử là 6, ký hiệu là C, nằm trong nhóm IV của bảng tuần hoàn. Carbon là nguyên tố phi kim, có khả năng tạo ra nhiều hợp chất khác nhau, đặc biệt là các hợp chất hữu cơ, nhờ vào cấu trúc đặc biệt của nguyên tử.
Nguyên tử carbon bao gồm 6 proton và 6 neutron trong hạt nhân, và 6 electron được phân bố trên hai lớp vỏ electron:
- Lớp vỏ thứ nhất: Chứa 2 electron.
- Lớp vỏ thứ hai: Chứa 4 electron, cho phép carbon tạo ra tối đa 4 liên kết cộng hóa trị với các nguyên tử khác.
Nhờ khả năng này, carbon đóng vai trò nền tảng trong hóa học hữu cơ, là nguyên tố cấu tạo chính của mọi sự sống trên Trái Đất. Carbon cũng tồn tại dưới nhiều dạng thù hình khác nhau như kim cương, than chì, và graphene, mỗi dạng có cấu trúc và tính chất vật lý độc đáo.
Không chỉ quan trọng trong tự nhiên, carbon còn là yếu tố cốt lõi trong công nghệ và công nghiệp, đặc biệt là trong việc phát triển các vật liệu mới và năng lượng sạch.
2. Cấu trúc nguyên tử Carbon
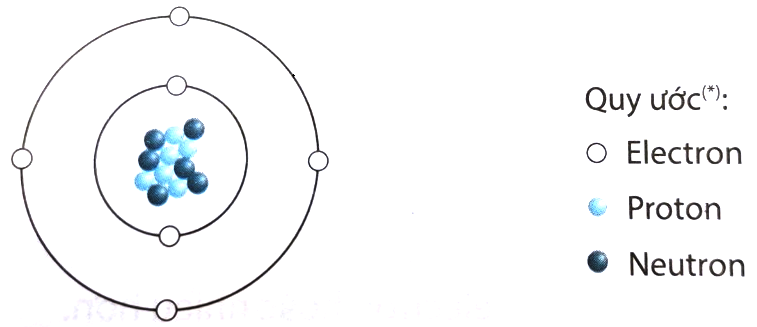
Nguyên tử carbon có số hiệu nguyên tử là 6, với cấu trúc bao gồm hạt nhân nằm ở trung tâm và các electron chuyển động xung quanh hạt nhân. Cấu trúc nguyên tử carbon được mô tả chi tiết qua các thành phần sau:
- Hạt nhân: Hạt nhân của nguyên tử carbon chứa 6 proton mang điện tích dương và thường có 6 neutron không mang điện tích. Tổng số proton và neutron trong hạt nhân quyết định khối lượng của nguyên tử carbon.
- Electron: Nguyên tử carbon có 6 electron mang điện tích âm, được phân bố trên hai lớp vỏ electron:
- Lớp thứ nhất: Gần hạt nhân nhất, chứa 2 electron. Đây là lớp vỏ thấp nhất về năng lượng.
- Lớp thứ hai: Chứa 4 electron. Các electron trong lớp này có thể tham gia vào việc tạo liên kết với các nguyên tử khác.
Các electron ở lớp vỏ thứ hai giúp carbon tạo ra 4 liên kết cộng hóa trị, điều này giải thích khả năng liên kết phong phú của carbon với các nguyên tố khác, tạo ra một loạt các hợp chất hữu cơ và vô cơ.
Carbon có khả năng tồn tại dưới nhiều dạng thù hình khác nhau, bao gồm:
- Kim cương: Mỗi nguyên tử carbon liên kết với 4 nguyên tử carbon khác bằng các liên kết đơn, tạo thành một cấu trúc tinh thể rất cứng.
- Than chì: Các nguyên tử carbon sắp xếp thành các lớp phẳng, với mỗi nguyên tử liên kết với 3 nguyên tử khác, cho phép các lớp trượt qua nhau dễ dàng.
- Graphene: Một lớp đơn của các nguyên tử carbon liên kết trong một mạng lưới hình lục giác, có tính dẫn điện và độ bền vượt trội.
Cấu trúc đặc biệt này của carbon làm cho nó trở thành một trong những nguyên tố cơ bản và đa dạng nhất trong tự nhiên và công nghệ.

3. Các đồng vị của Carbon
Carbon là một nguyên tố có nhiều đồng vị, tức là các biến thể của nguyên tử carbon với cùng số proton nhưng khác nhau về số neutron trong hạt nhân. Điều này dẫn đến sự khác biệt về khối lượng nguyên tử giữa các đồng vị. Trong tự nhiên, carbon có ba đồng vị chính:
- Carbon-12 (\(^12C\)): Đây là đồng vị phổ biến nhất, chiếm khoảng 98.89% tổng lượng carbon trong tự nhiên. Hạt nhân của \(^12C\) gồm 6 proton và 6 neutron. Đồng vị này ổn định và không phóng xạ, được sử dụng làm tiêu chuẩn cho thang đo khối lượng nguyên tử.
- Carbon-13 (\(^13C\)): Đồng vị này chiếm khoảng 1.11% tổng lượng carbon tự nhiên. Hạt nhân của \(^13C\) có 6 proton và 7 neutron. \(^13C\) cũng là đồng vị ổn định và thường được sử dụng trong nghiên cứu hóa học và sinh học để theo dõi và phân tích các quá trình trao đổi chất, nhờ vào khả năng tạo ra tín hiệu trong phổ cộng hưởng từ hạt nhân (NMR).
- Carbon-14 (\(^14C\)): \(^14C\) là một đồng vị phóng xạ, chiếm một lượng rất nhỏ trong tự nhiên. Hạt nhân của nó chứa 6 proton và 8 neutron. \(^14C\) phân rã theo thời gian với chu kỳ bán rã khoảng 5730 năm, phát ra bức xạ beta. Đồng vị này được sử dụng rộng rãi trong phương pháp xác định niên đại bằng cacbon (carbon dating), giúp xác định tuổi của các mẫu vật cổ như xương, gỗ và than đá.
Đặc điểm của các đồng vị carbon, đặc biệt là \(^14C\), đã mở ra nhiều ứng dụng quan trọng trong khoa học, từ nghiên cứu sinh học đến khảo cổ học, giúp chúng ta hiểu rõ hơn về quá khứ và các quá trình sinh học.
4. Liên kết hóa học của Carbon
Carbon là một nguyên tố nổi bật với khả năng tạo ra nhiều loại liên kết hóa học khác nhau, giúp hình thành nên hàng ngàn hợp chất hữu cơ và vô cơ. Khả năng này xuất phát từ cấu trúc điện tử đặc biệt của carbon, với 4 electron ở lớp vỏ ngoài cùng. Dưới đây là các dạng liên kết chính mà nguyên tử carbon có thể hình thành:
- Liên kết đơn (\(\sigma\)): Liên kết đơn được hình thành khi carbon chia sẻ một cặp electron với một nguyên tử khác. Liên kết \(\sigma\) bền vững và linh hoạt, cho phép các phân tử có khả năng xoay quanh trục liên kết. Ví dụ điển hình của liên kết này là trong các phân tử ankan như \(\text{CH}_4\) (methane).
- Liên kết đôi (\(\pi\) + \(\sigma\)): Liên kết đôi được hình thành khi carbon chia sẻ hai cặp electron với một nguyên tử khác. Một liên kết là \(\sigma\) và liên kết còn lại là \(\pi\). Liên kết đôi cứng hơn và ít linh hoạt hơn so với liên kết đơn. Các phân tử như \(\text{C}_2\text{H}_4\) (ethene) là ví dụ của liên kết đôi.
- Liên kết ba (\(\pi\) + \(\pi\) + \(\sigma\)): Liên kết ba xảy ra khi carbon chia sẻ ba cặp electron với một nguyên tử khác. Trong đó, một liên kết là \(\sigma\) và hai liên kết còn lại là \(\pi\). Liên kết ba rất cứng và ngắn, hạn chế sự xoay của phân tử. Ví dụ phổ biến của liên kết ba là trong phân tử \(\text{C}_2\text{H}_2\) (acetylene).
Các liên kết hóa học này không chỉ quyết định cấu trúc của phân tử mà còn ảnh hưởng trực tiếp đến tính chất vật lý và hóa học của hợp chất. Nhờ khả năng tạo liên kết đa dạng, carbon có thể hình thành từ các phân tử nhỏ đơn giản như methane đến các cấu trúc phức tạp như chuỗi protein và DNA, điều này làm cho carbon trở thành nền tảng của sự sống.

5. Tầm quan trọng của Carbon trong đời sống
Carbon là một nguyên tố vô cùng quan trọng, không chỉ trong tự nhiên mà còn trong cuộc sống hàng ngày của con người. Sự hiện diện của carbon trong nhiều hợp chất khác nhau tạo nên nền tảng của sự sống và nhiều ứng dụng công nghệ. Dưới đây là các khía cạnh quan trọng của carbon trong đời sống:
- Cấu trúc sinh học: Carbon là thành phần chính của các hợp chất hữu cơ, bao gồm carbohydrate, lipid, protein và axit nucleic. Những hợp chất này là nền tảng cho các cấu trúc sinh học, từ tế bào đến cơ thể sống. Các phân tử DNA, mang thông tin di truyền của mọi sinh vật, đều được cấu tạo từ carbon.
- Chu trình carbon: Chu trình carbon là quá trình tuần hoàn của carbon trong tự nhiên, thông qua các hệ sinh thái và môi trường. Carbon dioxide (\(\text{CO}_2\)) được thực vật hấp thụ trong quá trình quang hợp, tạo ra thức ăn và oxy cho các sinh vật khác. Đồng thời, carbon cũng được giải phóng trở lại không khí qua hô hấp, cháy rừng, và quá trình phân hủy.
- Năng lượng hóa thạch: Carbon là thành phần chính của các nguồn năng lượng hóa thạch như than đá, dầu mỏ, và khí thiên nhiên. Khi đốt cháy, các nguồn năng lượng này cung cấp năng lượng cho hàng loạt hoạt động công nghiệp, giao thông và sinh hoạt hàng ngày, dù việc sử dụng cũng gây ra thách thức về môi trường.
- Công nghệ và vật liệu: Carbon còn là nền tảng cho nhiều vật liệu công nghệ cao như graphene, sợi carbon, và than chì. Các vật liệu này có tính chất đặc biệt như độ bền cao, khả năng dẫn điện và nhiệt tốt, được ứng dụng trong nhiều lĩnh vực từ điện tử, hàng không đến y tế.
- Bảo vệ môi trường: Việc quản lý lượng carbon trong khí quyển, thông qua việc giảm phát thải \(\text{CO}_2\) và các hợp chất chứa carbon, là một phần quan trọng trong các nỗ lực bảo vệ môi trường và chống biến đổi khí hậu.
Như vậy, carbon không chỉ là một thành phần hóa học đơn giản mà còn là yếu tố quan trọng đối với sự sống, phát triển kinh tế và bảo vệ môi trường. Việc hiểu rõ vai trò của carbon giúp chúng ta áp dụng nó một cách hiệu quả trong khoa học và đời sống.