Chủ đề cấu tạo nguyên tử - lớp 7: Cấu tạo nguyên tử - lớp 7 là một trong những chủ đề quan trọng giúp học sinh nắm vững kiến thức về cấu trúc cơ bản của vật chất. Tìm hiểu về thành phần của nguyên tử, từ proton, neutron đến electron, sẽ giúp học sinh hiểu rõ hơn về các khái niệm khoa học tự nhiên, đồng thời rèn luyện tư duy logic và kỹ năng giải quyết vấn đề. Bài viết này sẽ cung cấp một cái nhìn toàn diện và chi tiết về cấu tạo nguyên tử cho các em học sinh lớp 7.
Mục lục
Cấu Tạo Nguyên Tử - Lớp 7
Nguyên tử là đơn vị cơ bản cấu tạo nên mọi vật chất. Trong chương trình học lớp 7, học sinh được tìm hiểu về cấu trúc, thành phần, và các khái niệm cơ bản liên quan đến nguyên tử.
1. Khái Niệm Về Nguyên Tử
Nguyên tử là hạt vô cùng nhỏ, không thể nhìn thấy bằng mắt thường. Mỗi nguyên tử bao gồm một hạt nhân nằm ở trung tâm và các electron chuyển động xung quanh hạt nhân theo các quỹ đạo xác định.
2. Thành Phần Cấu Tạo Nguyên Tử
- Hạt nhân: Là phần trung tâm của nguyên tử, chứa các hạt proton mang điện tích dương và neutron không mang điện.
- Electron: Các hạt mang điện tích âm chuyển động xung quanh hạt nhân theo các lớp vỏ.
3. Số Proton, Neutron và Electron
Số proton trong hạt nhân nguyên tử quyết định số nguyên tử và cũng là số hiệu nguyên tử của nguyên tố đó. Số neutron có thể thay đổi trong cùng một nguyên tố, tạo thành các đồng vị khác nhau. Số electron trong nguyên tử trung hòa về điện bằng số proton.
4. Mô Hình Nguyên Tử
Mô hình nguyên tử hiện đại dựa trên nguyên tắc cơ học lượng tử. Theo đó, các electron không chuyển động theo quỹ đạo tròn quanh hạt nhân mà tồn tại trong các đám mây điện tử có hình dạng và mức năng lượng khác nhau.
5. Bài Tập Về Nguyên Tử
- Tính số proton, neutron, và electron trong các nguyên tử của một số nguyên tố cụ thể.
- Vẽ sơ đồ cấu tạo của các nguyên tử với số lớp electron khác nhau.
- Giải thích sự khác biệt giữa các đồng vị của cùng một nguyên tố.
6. Tầm Quan Trọng Của Việc Hiểu Biết Về Nguyên Tử
Hiểu biết về nguyên tử giúp chúng ta giải thích được nhiều hiện tượng trong cuộc sống hàng ngày, từ cấu tạo vật chất, phản ứng hóa học cho đến các ứng dụng trong khoa học và công nghệ như điện tử, vật liệu mới, và y học.
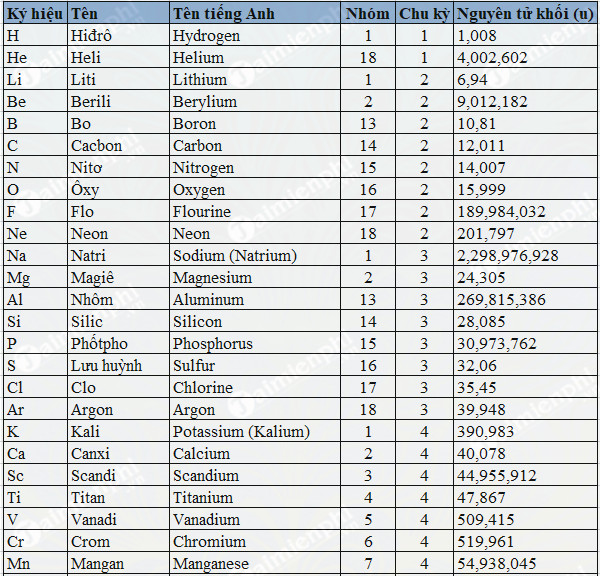
| Thành Phần | Số lượng | Khối lượng (amu) | Tổng khối lượng (amu) |
|---|---|---|---|
| Proton | 2 | 1 | 2 |
| Neutron | 2 | 1 | 2 |
| Electron | 2 | 0.00055 | 0.0011 |
Ví dụ về nguyên tử helium với 2 proton, 2 neutron, và 2 electron cho thấy tổng khối lượng nguyên tử gần bằng 4 amu.

.png)
1. Giới Thiệu Về Nguyên Tử
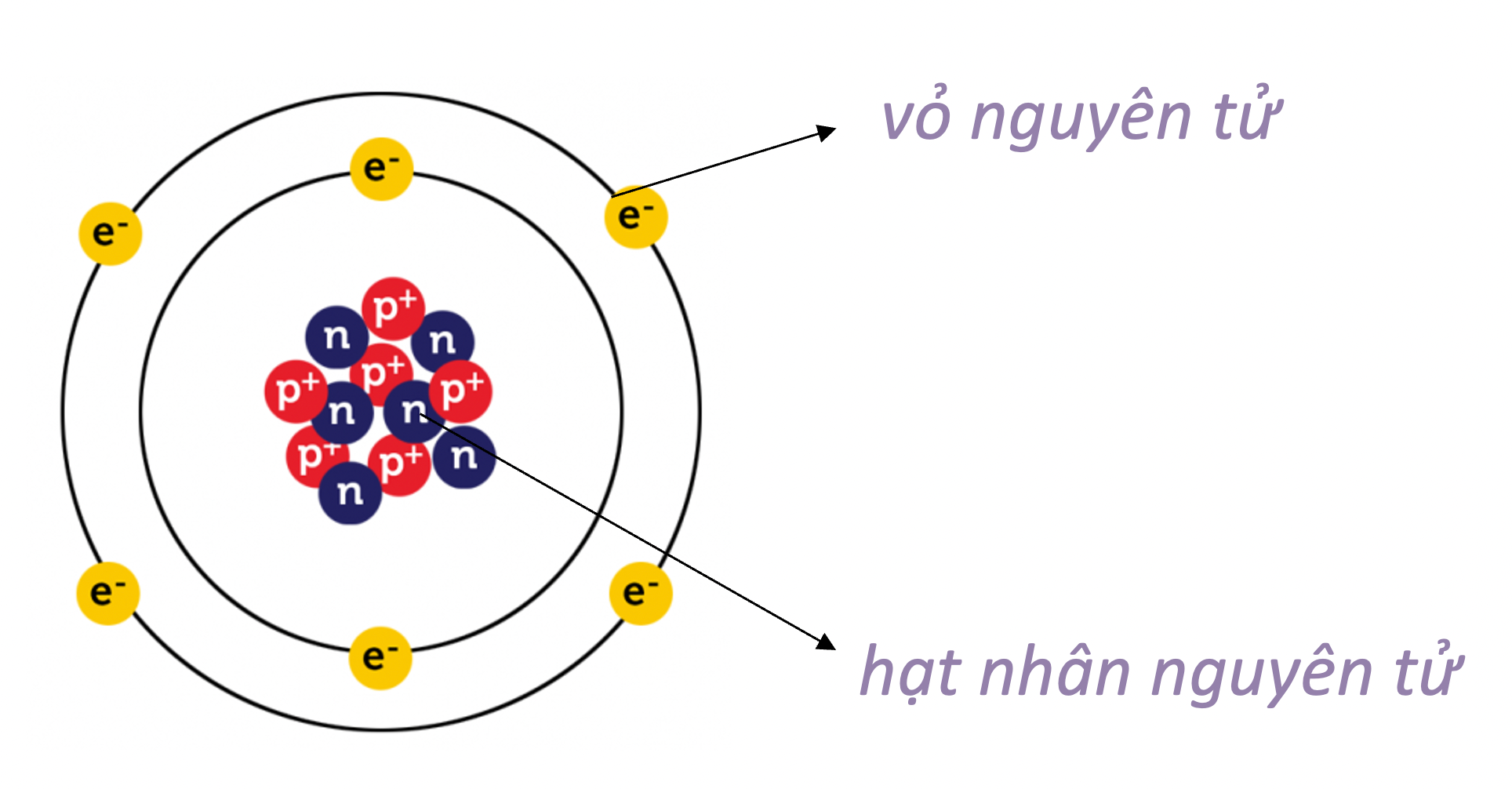
Nguyên tử là đơn vị cơ bản của vật chất và là thành phần nhỏ nhất của một nguyên tố mà vẫn giữ nguyên tính chất hóa học của nguyên tố đó. Mỗi nguyên tử bao gồm một hạt nhân ở trung tâm, xung quanh là các electron chuyển động.
-
Hạt nhân:
Hạt nhân của nguyên tử chứa các proton và neutron. Proton là hạt mang điện tích dương \((+)\), còn neutron không mang điện tích. Số lượng proton trong hạt nhân quyết định nguyên tố hóa học của nguyên tử đó.
-
Electron:
Electron là hạt mang điện tích âm \((-)\) và chuyển động xung quanh hạt nhân. Các electron bị hút bởi lực điện tích của proton trong hạt nhân, tạo nên cấu trúc ổn định của nguyên tử.
Nguyên tử có kích thước rất nhỏ, khoảng từ \(10^{-10}\) mét. Để dễ hình dung, nếu chúng ta phóng to một nguyên tử lên kích thước của một quả táo, thì hạt nhân của nó chỉ nhỏ bằng một hạt muối.
Các electron di chuyển trong các quỹ đạo xung quanh hạt nhân, tạo thành các lớp electron. Mỗi lớp electron có mức năng lượng khác nhau. Electron trong lớp càng gần hạt nhân thì có năng lượng càng thấp.
Cấu trúc nguyên tử của một nguyên tố được ký hiệu bằng ký hiệu hóa học, trong đó số proton được ghi ở chỉ số dưới và tổng số proton và neutron (khối lượng nguyên tử) được ghi ở chỉ số trên. Ví dụ, nguyên tử Carbon được ký hiệu là \(^{12}_6C\), với 6 proton và 6 neutron trong hạt nhân.
Hiểu rõ về nguyên tử giúp chúng ta nắm bắt được bản chất của vật chất và các phản ứng hóa học diễn ra xung quanh chúng ta, từ đó có thể ứng dụng vào nhiều lĩnh vực khoa học và đời sống.
2. Cấu Trúc Của Nguyên Tử
Nguyên tử là đơn vị cơ bản của vật chất, gồm ba thành phần chính: proton, neutron và electron. Mỗi thành phần này đóng vai trò quan trọng trong việc xác định tính chất vật lý và hóa học của nguyên tử.
- Proton: Proton là hạt mang điện tích dương (+1) và nằm trong hạt nhân của nguyên tử. Khối lượng của proton xấp xỉ 1 đơn vị khối lượng nguyên tử (u).
- Neutron: Neutron là hạt không mang điện tích (0) và có khối lượng tương đương với proton. Neutron cũng nằm trong hạt nhân và giúp ổn định hạt nhân nguyên tử bằng cách giảm lực đẩy giữa các proton cùng dấu.
- Electron: Electron là hạt mang điện tích âm (-1) và chuyển động xung quanh hạt nhân trong các quỹ đạo xác định, tạo thành lớp vỏ electron. Khối lượng của electron rất nhỏ so với proton và neutron, chỉ khoảng 0.0005 đơn vị khối lượng nguyên tử (u).
Mô hình nguyên tử hiện đại dựa trên cơ học lượng tử, trong đó các electron không di chuyển theo quỹ đạo cố định mà tồn tại trong các đám mây xác suất, gọi là orbital. Orbital là các vùng không gian xung quanh hạt nhân nơi khả năng tìm thấy electron là cao nhất.
| Thành phần | Điện tích | Khối lượng (u) |
|---|---|---|
| Proton | +1 | 1 |
| Neutron | 0 | 1 |
| Electron | -1 | 0.0005 |
Khối lượng của nguyên tử chủ yếu tập trung ở hạt nhân, bao gồm các proton và neutron. Electron chuyển động xung quanh hạt nhân và tạo thành các lớp vỏ, đóng vai trò quan trọng trong các phản ứng hóa học và tạo liên kết giữa các nguyên tử.
Ví dụ, nguyên tử carbon (C) có 6 proton và 6 neutron trong hạt nhân, nên khối lượng nguyên tử chủ yếu được quyết định bởi tổng số proton và neutron. Kích thước của nguyên tử được xác định bởi lớp vỏ electron, với các electron di chuyển nhanh xung quanh hạt nhân, tạo thành đám mây electron, xác định kích thước của nguyên tử.
Đường kính của một nguyên tử thường nằm trong khoảng từ 62 pm (picomet) đến 520 pm, tùy thuộc vào số lượng proton, neutron và electron cũng như cấu trúc của lớp vỏ electron.

3. Các Đặc Điểm Của Nguyên Tử
Nguyên tử là đơn vị cơ bản của vật chất và có cấu tạo gồm hai phần chính: hạt nhân và lớp vỏ electron. Đây là những đặc điểm quan trọng của nguyên tử:
- Hạt nhân nguyên tử:
- Hạt nhân nằm ở trung tâm của nguyên tử, chứa các hạt proton và neutron.
- Proton mang điện tích dương (+), trong khi neutron không mang điện tích.
- Khối lượng của hạt nhân gần như là toàn bộ khối lượng của nguyên tử vì khối lượng của electron rất nhỏ.
- Số lượng proton trong hạt nhân xác định số điện tích hạt nhân và đặc trưng của nguyên tố. Ví dụ, nguyên tử nitrogen có 7 proton, trong khi potassium có 19 proton.
- Lớp vỏ electron:
- Electron mang điện tích âm (-) và chuyển động xung quanh hạt nhân.
- Các electron được sắp xếp thành từng lớp, với số lượng electron và cách sắp xếp tùy thuộc vào nguyên tử cụ thể.
- Ví dụ, nguyên tử nitrogen có 2 lớp electron với 2 electron ở lớp thứ nhất và 5 electron ở lớp thứ hai. Nguyên tử potassium có 4 lớp electron với cấu hình 2, 8, 8, 1.
- Tính trung hòa điện của nguyên tử:
- Nguyên tử trung hòa về điện vì số lượng proton (mang điện tích dương) bằng số lượng electron (mang điện tích âm), do đó tổng điện tích của nguyên tử bằng 0.
- Khối lượng nguyên tử:
- Được đo bằng đơn vị khối lượng nguyên tử (amu), trong đó 1 amu xấp xỉ bằng khối lượng của một proton hoặc một neutron.
- Khối lượng của các electron nhỏ hơn rất nhiều so với khối lượng proton và neutron, do đó thường bỏ qua khối lượng của electron khi tính tổng khối lượng nguyên tử.
- Ví dụ, khối lượng nguyên tử helium xấp xỉ bằng 4 amu, chủ yếu là do 2 proton và 2 neutron trong hạt nhân.
4. Cách Tính Toán Khối Lượng Nguyên Tử
Khối lượng nguyên tử được tính toán dựa trên tổng số hạt proton và neutron có trong hạt nhân của nguyên tử. Mỗi proton và neutron có khối lượng xấp xỉ 1 đơn vị khối lượng nguyên tử (amu). Để tính khối lượng nguyên tử, chúng ta cần làm theo các bước sau:
- Xác định số lượng proton và neutron:
- Số lượng proton (số hiệu nguyên tử) thường được cung cấp trong bảng tuần hoàn hoặc các thông tin về nguyên tố.
- Số lượng neutron có thể tính toán bằng cách lấy số khối (số nguyên tử trung bình) trừ đi số proton.
- Tính tổng số hạt nhân:
Tổng số hạt nhân của nguyên tử là tổng số proton và neutron. Công thức tổng quát:
\[ \text{Tổng số hạt nhân} = \text{Số proton} + \text{Số neutron} \] - Tính khối lượng nguyên tử:
Khối lượng nguyên tử được tính bằng cách nhân tổng số hạt nhân với khối lượng của mỗi hạt, khoảng 1 amu. Công thức tính khối lượng nguyên tử là:
\[ \text{Khối lượng nguyên tử} = (\text{Số proton} + \text{Số neutron}) \times 1 \, \text{amu} \] - Ví dụ về tính toán khối lượng nguyên tử:
- Nguyên tử Carbon:
- Carbon có 6 proton và thường có 6 neutron.
- Tổng số hạt nhân = 6 proton + 6 neutron = 12.
- Khối lượng nguyên tử Carbon ≈ \(12 \, \text{amu}\).
- Nguyên tử Oxygen:
- Oxygen có 8 proton và thường có 8 neutron.
- Tổng số hạt nhân = 8 proton + 8 neutron = 16.
- Khối lượng nguyên tử Oxygen ≈ \(16 \, \text{amu}\).
- Nguyên tử Carbon:
Qua các bước tính toán trên, chúng ta có thể dễ dàng xác định khối lượng nguyên tử của bất kỳ nguyên tố nào bằng cách biết số lượng proton và neutron của chúng. Điều này giúp chúng ta hiểu rõ hơn về đặc điểm và tính chất của các nguyên tố trong bảng tuần hoàn.

5. Bài Tập Và Ứng Dụng Thực Tiễn
Để củng cố kiến thức về cấu tạo nguyên tử, các bài tập và ứng dụng thực tiễn sẽ giúp học sinh hiểu rõ hơn về cách các nguyên tử và phân tử hoạt động trong thực tế. Dưới đây là một số bài tập và ví dụ về ứng dụng của kiến thức nguyên tử trong đời sống hàng ngày.
- Bài tập 1: Xác định thành phần hạt nhân
Cho biết số proton và neutron của một nguyên tử, hãy xác định tổng số hạt nhân và tính khối lượng nguyên tử.
- Bài giải:
- Giả sử nguyên tử có 8 proton và 8 neutron.
- Tổng số hạt nhân = \(8 + 8 = 16\).
- Khối lượng nguyên tử = \(16 \, \text{amu}\).
- Bài tập 2: So sánh khối lượng nguyên tử
So sánh khối lượng của hai nguyên tử có số proton và neutron khác nhau.
- Bài giải:
- Nguyên tử A có 6 proton và 6 neutron.
- Nguyên tử B có 8 proton và 8 neutron.
- Khối lượng nguyên tử A = \(12 \, \text{amu}\), khối lượng nguyên tử B = \(16 \, \text{amu}\).
- Khối lượng nguyên tử B lớn hơn khối lượng nguyên tử A.
- Bài tập 3: Xác định nguyên tố từ số proton
Dựa vào số proton của một nguyên tử, xác định tên nguyên tố đó.
- Bài giải:
- Nếu một nguyên tử có 1 proton, đó là nguyên tố Hydro.
- Nếu một nguyên tử có 6 proton, đó là nguyên tố Carbon.
- Nếu một nguyên tử có 8 proton, đó là nguyên tố Oxygen.
- Ứng dụng thực tiễn:
- Trong hóa học: Hiểu cấu tạo nguyên tử giúp giải thích các phản ứng hóa học và sự hình thành của các hợp chất.
- Trong công nghệ: Nguyên tử là cơ sở của công nghệ nano, nơi các nhà khoa học làm việc với các nguyên tử và phân tử để phát triển vật liệu và thiết bị mới.
- Trong y học: Hiểu biết về nguyên tử và phân tử giúp phát triển thuốc mới và phương pháp điều trị bệnh hiệu quả hơn.
Qua các bài tập và ứng dụng trên, học sinh có thể thấy rõ tầm quan trọng của việc hiểu rõ cấu tạo nguyên tử, không chỉ trong việc học mà còn trong cuộc sống hàng ngày và các lĩnh vực khoa học công nghệ khác.
XEM THÊM:
6. Phương Pháp Học Tập Hiệu Quả Về Nguyên Tử
Để học tập hiệu quả về cấu tạo và tính chất của nguyên tử, học sinh cần áp dụng một số phương pháp học tập có hệ thống và khoa học. Dưới đây là các bước cụ thể để nâng cao hiệu quả học tập môn Khoa học tự nhiên lớp 7 về nguyên tử:
- Sử dụng hình ảnh và mô hình minh họa
- Học sinh nên sử dụng các hình ảnh, sơ đồ và biểu đồ để minh họa cấu trúc nguyên tử. Ví dụ, biểu đồ cấu trúc các lớp electron sẽ giúp dễ hình dung hơn.
- Sử dụng mô hình 3D hoặc phần mềm mô phỏng để tự tay lắp ráp và quan sát cấu trúc nguyên tử, giúp hiểu rõ hơn về cách các hạt proton, neutron và electron phân bố.
- Ôn tập thường xuyên
- Sau mỗi buổi học, học sinh nên dành thời gian để ôn lại bài. Ghi chú lại các điểm chính và sử dụng từ ngữ của riêng mình để tóm tắt kiến thức.
- Thực hiện các bài tập trắc nghiệm và tính toán liên quan đến khối lượng và điện tích của các nguyên tử để củng cố hiểu biết.
- Trao đổi kiến thức
- Tham gia vào các nhóm học tập hoặc thảo luận với bạn bè và giáo viên để chia sẻ và học hỏi lẫn nhau.
- Giảng lại bài cho người khác là một cách tuyệt vời để kiểm tra mức độ hiểu biết của bản thân và nhận phản hồi.
- Chuẩn bị trước khi đến lớp
- Đọc trước tài liệu và chuẩn bị câu hỏi về những điểm chưa rõ để hỏi giáo viên trong lớp học. Điều này giúp bạn dễ dàng tiếp thu kiến thức mới.
- Luyện tập tư duy độc lập bằng cách suy nghĩ về các câu hỏi liên quan đến bài học và tìm câu trả lời trước khi được giải đáp trên lớp.
- Tập trung trong giờ học
- Giữ sự tập trung cao độ trong giờ học để không bỏ sót bất kỳ kiến thức quan trọng nào. Hạn chế các yếu tố gây xao lãng như điện thoại hay trò chuyện không cần thiết.
Áp dụng những phương pháp trên sẽ giúp học sinh nâng cao hiệu quả học tập môn Khoa học tự nhiên lớp 7 về nguyên tử, đạt kết quả tốt trong các bài kiểm tra và phát triển tư duy khoa học.

7. Tài Liệu Tham Khảo Và Nguồn Học Liệu
-
Sách giáo khoa và tài liệu tham khảo
Sách Giáo Khoa Hóa Học Lớp 7: Đây là tài liệu chính cung cấp kiến thức cơ bản về cấu tạo nguyên tử và các thành phần của nguyên tử như proton, neutron, electron. Nội dung sách được biên soạn bởi Bộ Giáo dục và Đào tạo Việt Nam, nhằm đảm bảo tính chính xác và phù hợp với chương trình học. Sách cung cấp ví dụ minh họa, bài tập và hướng dẫn cách tính toán các đại lượng như khối lượng nguyên tử, số hiệu nguyên tử.
Sách tham khảo "Hóa học đại cương": Cuốn sách này giúp mở rộng kiến thức về cấu tạo nguyên tử, các khái niệm liên quan đến cấu trúc nguyên tử, phân bố electron trong các lớp vỏ, và vai trò của các hạt nhân nguyên tử. Sách này phù hợp cho các bạn học sinh muốn đào sâu và nâng cao hiểu biết của mình về lĩnh vực này.
-
Các nguồn tài liệu trực tuyến uy tín
Website Rdsic.edu.vn: Trang web cung cấp các bài viết và hướng dẫn chi tiết về cấu tạo nguyên tử cho học sinh lớp 7, bao gồm các sơ đồ, hình ảnh minh họa về cấu trúc hạt nhân, sự sắp xếp các electron trong các lớp vỏ, và bài tập thực hành về tính toán khối lượng nguyên tử. Tài liệu này được biên soạn nhằm mục đích hỗ trợ việc học tập của học sinh một cách trực quan và dễ hiểu.
Kênh YouTube Học Hóa Online: Kênh này cung cấp các video giảng dạy trực tuyến về cấu tạo nguyên tử với hình ảnh động, mô phỏng 3D, và hướng dẫn giải bài tập theo từng bước. Các video được biên soạn bởi các giáo viên chuyên nghiệp, giúp học sinh dễ dàng hiểu rõ các khái niệm khó và ứng dụng trong các bài tập thực tế.
Diễn đàn giáo dục hocmai.vn: Đây là diễn đàn trực tuyến nơi học sinh và giáo viên có thể trao đổi, thảo luận và giải đáp thắc mắc về cấu tạo nguyên tử, các bài tập và các phương pháp học tập hiệu quả. Diễn đàn này cũng cung cấp nhiều bài giảng và tài liệu bổ trợ từ các giáo viên có kinh nghiệm.