Chủ đề bảng nguyên tử khối và hóa trị lớp 8: Bảng nguyên tử khối và hóa trị lớp 8 là kiến thức quan trọng giúp học sinh nắm vững nền tảng môn Hóa học. Bài viết này cung cấp thông tin chi tiết, dễ hiểu về nguyên tử khối và hóa trị các nguyên tố, kèm theo mẹo ghi nhớ nhanh chóng, giúp học sinh áp dụng vào bài tập và kỳ thi một cách hiệu quả.
Mục lục
- Bảng Nguyên Tử Khối và Hóa Trị Lớp 8
- 1. Giới Thiệu Về Bảng Nguyên Tử Khối và Hóa Trị Lớp 8
- 2. Bảng Nguyên Tử Khối Chi Tiết
- 3. Bảng Hóa Trị Các Nguyên Tố Hóa Học Lớp 8
- 4. Ứng Dụng của Bảng Nguyên Tử Khối và Hóa Trị Trong Học Tập
- 5. Mẹo Ghi Nhớ Nhanh Nguyên Tử Khối và Hóa Trị
- 6. Tầm Quan Trọng của Việc Nắm Vững Nguyên Tử Khối và Hóa Trị
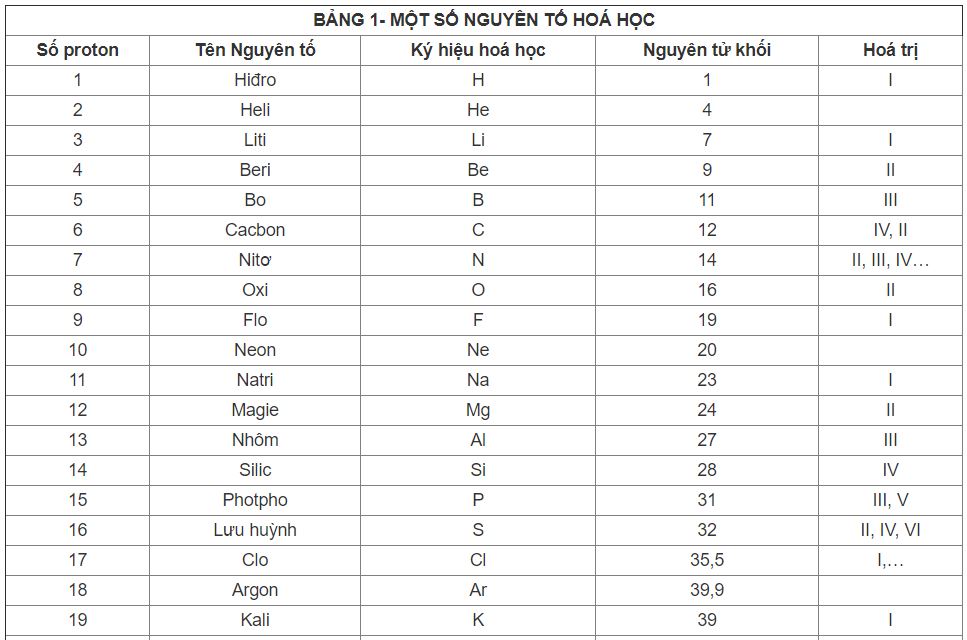
Bảng Nguyên Tử Khối và Hóa Trị Lớp 8
Bảng nguyên tử khối và hóa trị là kiến thức nền tảng của môn Hóa học lớp 8. Dưới đây là danh sách các nguyên tố, nguyên tử khối và hóa trị giúp các bạn học sinh nắm vững để áp dụng vào bài tập và các kỳ thi.
1. Bảng Nguyên Tử Khối Các Nguyên Tố Hóa Học
| Nguyên tố | Ký hiệu | Nguyên tử khối |
| Hiđro | H | 1 |
| Heli | He | 4 |
| Cacbon | C | 12 |
| Oxi | O | 16 |
| Natri | Na | 23 |
| Magie | Mg | 24 |
2. Hóa Trị của Các Nguyên Tố Hóa Học
Hóa trị là khả năng liên kết của một nguyên tố hóa học, phụ thuộc vào số electron ở lớp ngoài cùng của nguyên tử. Dưới đây là hóa trị của một số nguyên tố phổ biến:
- Hóa trị I: \(\text{H, Na, K, F, Cl, Br}\)
- Hóa trị II: \(\text{O, Mg, Ca, Zn}\)
- Hóa trị III: \(\text{Al, B}\)
- Hóa trị IV: \(\text{C, Si}\)
3. Mẹo Ghi Nhớ Nguyên Tử Khối và Hóa Trị
Để dễ dàng ghi nhớ nguyên tử khối và hóa trị, các bạn học sinh có thể áp dụng các mẹo sau:
- Học theo nhóm nguyên tố có cùng hóa trị. Ví dụ: các nguyên tố hóa trị I bao gồm H, Na, K, F, Cl...
- Sử dụng bài hát hóa trị, công cụ ghi nhớ truyền thống nhưng rất hiệu quả.
- Làm nhiều bài tập để ghi nhớ nguyên tố và hóa trị nhanh chóng.
4. Bài Hát Ghi Nhớ Hóa Trị
Bài hát dưới đây giúp các bạn học sinh ghi nhớ hóa trị một cách dễ dàng:
Kali, Iốt, Hiđro
Natri kết hợp với bạc, Clo là một liên minh
Hóa trị 1, đừng quên nhé!
Oxi, Magiê, thủy ngân
Canxi, Đồng cùng Bari
Hóa trị 2 dễ nhớ ngay thôi!
Bác Nhôm, hóa trị 3
Ghi chép kỹ và nhớ ngay
Sắt kia, hóa trị 2 và 3

.png)
1. Giới Thiệu Về Bảng Nguyên Tử Khối và Hóa Trị Lớp 8
Bảng nguyên tử khối và hóa trị là một công cụ quan trọng trong việc học môn Hóa học lớp 8. Nó giúp học sinh dễ dàng tra cứu và ghi nhớ khối lượng của các nguyên tử và hóa trị của chúng, từ đó áp dụng vào các bài tập tính toán và phân tích phản ứng hóa học.
Nguyên tử khối là khối lượng tương đối của một nguyên tử được đo so với 1/12 khối lượng của nguyên tử carbon-12. Đơn vị này không có đơn vị tuyệt đối mà được biểu diễn bằng đơn vị khối lượng nguyên tử (amu).
Hóa trị là khả năng kết hợp của một nguyên tử để tạo thành các hợp chất. Đó là số lượng liên kết mà nguyên tử có thể tạo ra với các nguyên tử khác. Các nguyên tố khác nhau có hóa trị khác nhau tùy thuộc vào cấu trúc electron của chúng.
- Nguyên tử khối: Giúp xác định khối lượng tương đối của các nguyên tử trong các phản ứng hóa học.
- Hóa trị: Giúp dự đoán cách mà các nguyên tố sẽ kết hợp với nhau trong các phản ứng.
Việc nắm vững bảng nguyên tử khối và hóa trị không chỉ giúp học sinh làm tốt các bài tập trong sách giáo khoa mà còn là nền tảng để hiểu sâu hơn về Hóa học ở các cấp học cao hơn.
| Nguyên Tố | Nguyên Tử Khối | Hóa Trị |
| Hydro (H) | \(1\) | \(I\) |
| Oxy (O) | \(16\) | \(II\) |
| Cacbon (C) | \(12\) | \(IV\) |
2. Bảng Nguyên Tử Khối Chi Tiết
Bảng nguyên tử khối là công cụ hữu ích giúp học sinh dễ dàng tra cứu khối lượng tương đối của các nguyên tử. Mỗi nguyên tố hóa học đều có một nguyên tử khối riêng, được xác định dựa trên khối lượng của proton và neutron trong hạt nhân. Dưới đây là bảng chi tiết của một số nguyên tố thông dụng trong chương trình lớp 8:
| Nguyên Tố | Ký Hiệu | Nguyên Tử Khối |
| Hydro | H | \(1\) |
| Heli | He | \(4\) |
| Carbon | C | \(12\) |
| Nitơ | N | \(14\) |
| Oxy | O | \(16\) |
| Magie | Mg | \(24\) |
| Lưu huỳnh | S | \(32\) |
| Sắt | Fe | \(56\) |
Các nguyên tử khối này được sử dụng trong các tính toán hóa học, giúp học sinh dễ dàng giải quyết các bài toán liên quan đến phương trình hóa học và phản ứng.
Ví dụ, trong phản ứng giữa hydro và oxy để tạo ra nước, học sinh có thể sử dụng nguyên tử khối của hydro (\(1\)) và oxy (\(16\)) để tính khối lượng phân tử và cân bằng phương trình:
Bảng nguyên tử khối này không chỉ giúp trong việc học tập mà còn cung cấp một cái nhìn tổng quan về khối lượng của các nguyên tử, hỗ trợ trong việc hiểu sâu hơn về cấu trúc vật chất.

3. Bảng Hóa Trị Các Nguyên Tố Hóa Học Lớp 8
Hóa trị là khả năng của một nguyên tố kết hợp với các nguyên tố khác để tạo thành hợp chất hóa học. Trong chương trình Hóa học lớp 8, học sinh cần nắm vững hóa trị của các nguyên tố để thực hiện các phép tính và cân bằng phương trình hóa học. Dưới đây là bảng hóa trị chi tiết của một số nguyên tố phổ biến:
| Nguyên Tố | Ký Hiệu | Hóa Trị |
| Hydro | H | I |
| Oxy | O | II |
| Carbon | C | IV |
| Nitơ | N | III, V |
| Magie | Mg | II |
| Nhôm | Al | III |
| Sắt | Fe | II, III |
| Lưu huỳnh | S | II, IV, VI |
Bảng hóa trị trên được sử dụng thường xuyên trong các bài toán hóa học. Ví dụ, khi học sinh cân bằng phương trình hóa học giữa nhôm và oxy để tạo thành oxit nhôm, học sinh có thể sử dụng hóa trị của nhôm (\(III\)) và oxy (\(II\)):
Hóa trị không chỉ giúp học sinh xác định cách kết hợp giữa các nguyên tố mà còn giúp cân bằng phản ứng một cách chính xác.

4. Ứng Dụng của Bảng Nguyên Tử Khối và Hóa Trị Trong Học Tập
Bảng nguyên tử khối và hóa trị là hai công cụ quan trọng trong việc học tập Hóa học. Chúng giúp học sinh hiểu rõ hơn về tính chất của các nguyên tố và cách thức chúng kết hợp với nhau trong các phản ứng hóa học. Dưới đây là một số ứng dụng của bảng nguyên tử khối và hóa trị trong học tập:
- Cân bằng phương trình hóa học: Sử dụng hóa trị để xác định tỉ lệ kết hợp giữa các nguyên tố trong phản ứng, giúp học sinh cân bằng phương trình chính xác.
- Xác định khối lượng mol: Bằng cách tra cứu nguyên tử khối, học sinh có thể tính toán khối lượng mol của các chất trong bài toán hóa học. Ví dụ, nguyên tử khối của oxi là \(16\), nên phân tử khối của khí \(O_2\) là \(2 \times 16 = 32\).
- Tính toán tỷ lệ phần trăm khối lượng: Dựa vào nguyên tử khối của các nguyên tố trong hợp chất, học sinh có thể tính tỷ lệ phần trăm khối lượng của từng nguyên tố trong hợp chất. Ví dụ, trong hợp chất nước (\(H_2O\)), tỉ lệ phần trăm khối lượng của H và O có thể tính như sau: \[ \%H = \left(\frac{2 \times 1}{18}\right) \times 100 = 11.11\% \] \[ \%O = \left(\frac{16}{18}\right) \times 100 = 88.89\% \]
- Giúp hiểu rõ bản chất các phản ứng hóa học: Nhờ bảng hóa trị, học sinh biết cách các nguyên tố kết hợp với nhau, tạo thành các hợp chất mới, qua đó hiểu sâu hơn về tính chất hóa học của chúng.
Nhìn chung, việc nắm vững bảng nguyên tử khối và hóa trị không chỉ giúp học sinh giải quyết các bài toán hóa học mà còn giúp họ hiểu sâu hơn về các khái niệm cơ bản trong môn học này.

5. Mẹo Ghi Nhớ Nhanh Nguyên Tử Khối và Hóa Trị
Để học sinh lớp 8 có thể ghi nhớ nhanh và hiệu quả bảng nguyên tử khối và hóa trị, dưới đây là một số mẹo đơn giản và dễ áp dụng:
- Nhóm các nguyên tố tương tự nhau: Hãy phân loại các nguyên tố theo nhóm có hóa trị hoặc nguyên tử khối tương tự nhau. Ví dụ, các kim loại kiềm như Li, Na, K đều có hóa trị 1, điều này giúp việc ghi nhớ dễ dàng hơn.
- Sử dụng cách đọc vần điệu: Học sinh có thể sáng tạo các câu thơ hoặc vần điệu để ghi nhớ các nguyên tử khối theo thứ tự tăng dần. Ví dụ:
- "Liti ba, cacbon mười hai, nitơ mười bốn"
- "Oxi mười sáu, flo mười chín, natri hai mươi ba"
- Liên hệ với thực tế: Liên kết các nguyên tố với các sự vật, sự việc trong cuộc sống hàng ngày. Ví dụ, ghi nhớ hóa trị của oxi bằng cách liên tưởng đến không khí (\(O_2\)) mà chúng ta hít thở mỗi ngày.
- Chia nhỏ kiến thức và ôn tập thường xuyên: Hãy chia nhỏ bảng nguyên tử khối thành nhiều phần nhỏ để học dần. Mỗi ngày chỉ cần học một ít và ôn tập lại kiến thức đã học sẽ giúp bạn ghi nhớ lâu hơn.
- Sử dụng hình ảnh và sơ đồ: Học sinh có thể vẽ sơ đồ hoặc sử dụng các hình ảnh trực quan về bảng tuần hoàn để dễ dàng ghi nhớ nguyên tử khối và hóa trị của các nguyên tố.
- Áp dụng vào bài tập thực tế: Hãy sử dụng bảng nguyên tử khối và hóa trị vào việc giải các bài tập hóa học. Việc áp dụng kiến thức vào thực tế sẽ giúp học sinh nhớ nhanh và lâu hơn.
Với những mẹo này, việc ghi nhớ bảng nguyên tử khối và hóa trị sẽ trở nên dễ dàng và thú vị hơn, giúp học sinh lớp 8 tự tin hơn trong học tập.
XEM THÊM:
6. Tầm Quan Trọng của Việc Nắm Vững Nguyên Tử Khối và Hóa Trị
Việc nắm vững kiến thức về nguyên tử khối và hóa trị đóng vai trò rất quan trọng trong quá trình học tập hóa học, đặc biệt là đối với học sinh lớp 8. Hiểu được giá trị này giúp các em dễ dàng giải quyết các bài tập liên quan đến phản ứng hóa học và cấu tạo nguyên tử.
- Hiểu rõ bản chất của các phản ứng hóa học: Nắm vững nguyên tử khối giúp học sinh hiểu rõ cách tính toán khối lượng mol, một yếu tố quan trọng trong phản ứng hóa học. Điều này giúp học sinh phân tích và tính toán chính xác lượng chất tham gia và sản phẩm tạo ra.
- Xác định hóa trị và lập công thức hóa học: Việc nắm vững hóa trị giúp học sinh dễ dàng lập công thức hóa học chính xác cho các hợp chất. Ví dụ, hóa trị của Oxi là 2, vì vậy khi kết hợp với Natri (hóa trị 1), công thức của hợp chất sẽ là \( Na_2O \).
- Giải bài tập tính toán hóa học: Kiến thức về nguyên tử khối và hóa trị là nền tảng để giải các bài toán hóa học như tính toán tỉ lệ khối lượng, tính lượng chất tham gia phản ứng hay xác định thành phần phần trăm khối lượng của hợp chất.
- Tăng cường tư duy logic và khoa học: Việc áp dụng nguyên tử khối và hóa trị vào các bài tập không chỉ giúp học sinh phát triển kỹ năng tính toán mà còn rèn luyện tư duy logic, giúp các em phân tích và suy luận khoa học tốt hơn.
- Hỗ trợ cho các môn học khác: Ngoài môn hóa học, kiến thức về nguyên tử khối và hóa trị còn có thể áp dụng trong môn vật lý khi tính toán khối lượng các chất, hay trong sinh học để hiểu rõ hơn về cấu tạo phân tử của các chất trong cơ thể sống.
Nhìn chung, việc nắm vững nguyên tử khối và hóa trị không chỉ giúp học sinh đạt kết quả cao trong môn hóa học mà còn tạo nền tảng cho các môn khoa học khác, đồng thời phát triển tư duy phân tích và giải quyết vấn đề.