Chủ đề bảng khối lượng mol nguyên tử: Bảng khối lượng mol nguyên tử là một công cụ quan trọng trong hóa học, giúp tính toán khối lượng các nguyên tố và hợp chất. Bài viết này sẽ cung cấp cho bạn kiến thức về khái niệm, cách tính khối lượng mol nguyên tử, cũng như những ứng dụng thực tiễn trong các phản ứng hóa học và cuộc sống hàng ngày.
Mục lục
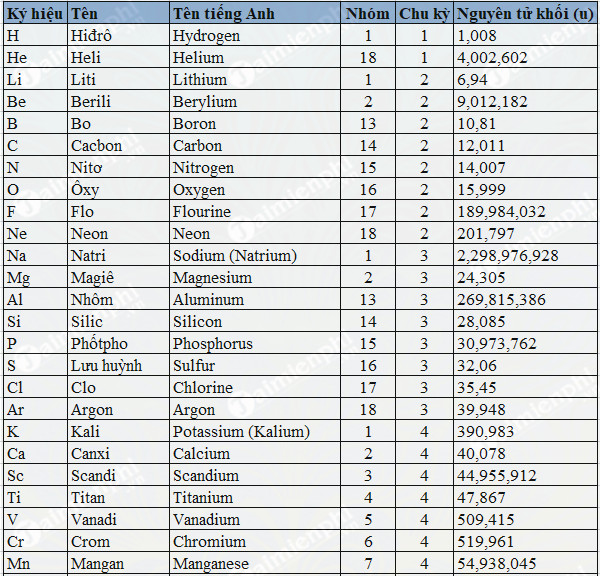
Bảng Khối Lượng Mol Nguyên Tử
Bảng khối lượng mol nguyên tử là một công cụ quan trọng giúp các nhà hóa học tính toán các phản ứng hóa học dựa trên khối lượng của các nguyên tử và phân tử. Các nguyên tố hóa học được sắp xếp trong bảng tuần hoàn và mỗi nguyên tố có khối lượng nguyên tử riêng biệt, tính bằng đơn vị mol (g/mol).
Khái niệm về khối lượng mol nguyên tử
Khối lượng mol của một nguyên tử hoặc một chất là khối lượng tính cho một mol của chất đó, đơn vị thường là gram trên mol \((g/mol)\). Công thức tính khối lượng mol của một nguyên tố hoặc hợp chất là:
\[M = \frac{m}{n}\]
Trong đó:
- \(M\) là khối lượng mol \((g/mol)\)
- \(m\) là khối lượng của chất (g)
- \(n\) là số mol
Ví dụ về bảng khối lượng mol của các nguyên tố phổ biến
Bảng dưới đây liệt kê khối lượng mol của một số nguyên tố phổ biến:
| Nguyên tố | Ký hiệu | Khối lượng mol (g/mol) |
|---|---|---|
| Hydro | H | 1.008 |
| Cacbon | C | 12.011 |
| Oxy | O | 15.999 |
| Nitơ | N | 14.007 |
| Vàng | Au | 196.967 |
Cách tính toán khối lượng của một nguyên tử
Khối lượng của một nguyên tử được tính bằng cách sử dụng công thức:
\[\text{Khối lượng} = \text{Số mol} \times \text{Khối lượng mol}\]
Ví dụ, nếu chúng ta có 2 mol Oxy \((O_2)\), khối lượng của nó sẽ là:
\[m = 2 \times 15.999 = 31.998 \, g\]
Tầm quan trọng của bảng khối lượng mol nguyên tử
Bảng khối lượng mol nguyên tử giúp xác định nhanh khối lượng của các chất tham gia và tạo thành trong các phản ứng hóa học. Từ đó, các nhà khoa học và học sinh có thể tính toán và dự đoán kết quả của các phản ứng một cách chính xác hơn.
Ứng dụng của khối lượng mol trong thực tế
Trong thực tế, khối lượng mol nguyên tử được sử dụng để:
- Tính toán khối lượng các chất trong các phản ứng hóa học.
- Xác định nồng độ dung dịch và hỗ trợ trong công việc thí nghiệm hóa học.
- Ứng dụng trong các lĩnh vực như hóa học, sinh học, vật lý và kỹ thuật.

.png)
Giới thiệu về bảng khối lượng mol nguyên tử
Bảng khối lượng mol nguyên tử là một công cụ quan trọng trong hóa học, giúp các nhà khoa học và học sinh xác định khối lượng của các nguyên tố và hợp chất tham gia vào các phản ứng hóa học. Mỗi nguyên tố trong bảng tuần hoàn có một khối lượng mol riêng biệt, và khối lượng này được đo bằng đơn vị gram trên mol \((g/mol)\).
Để hiểu rõ hơn về khối lượng mol, ta cần biết:
- Mol là gì? Mol là đơn vị đo lường lượng chất trong hóa học, đại diện cho 6.022 × 1023 hạt (nguyên tử, phân tử, electron,...).
- Khối lượng mol là gì? Khối lượng mol là khối lượng của một mol nguyên tử hoặc phân tử của một chất, được tính bằng gram.
Khối lượng mol nguyên tử được tính dựa trên số nguyên tử khối của nguyên tố. Ví dụ, nguyên tử khối của Cacbon (C) là 12, do đó khối lượng mol của nó là 12g/mol.
Ví dụ:
- Khối lượng mol của Hydro \((H)\) là 1.008 g/mol.
- Khối lượng mol của Cacbon \((C)\) là 12.011 g/mol.
- Khối lượng mol của Oxy \((O)\) là 15.999 g/mol.
Bảng khối lượng mol nguyên tử giúp đơn giản hóa quá trình tính toán các phản ứng hóa học, bằng cách cung cấp khối lượng chính xác của các chất tham gia và sản phẩm phản ứng. Nhờ đó, chúng ta có thể dễ dàng xác định được lượng chất cần thiết hoặc sản phẩm tạo thành trong các phản ứng.
Một ví dụ điển hình là phản ứng hóa học giữa Hydro và Oxy để tạo ra nước. Ta có phương trình:
\[2H_2 + O_2 \rightarrow 2H_2O\]
Sử dụng bảng khối lượng mol, ta có thể tính toán được khối lượng Hydro và Oxy cần thiết để tạo ra một lượng nhất định nước \((H_2O)\).
Các nguyên tố và khối lượng mol phổ biến
Trong hóa học, khối lượng mol của một nguyên tố là khối lượng của một mol nguyên tử hoặc phân tử của nguyên tố đó. Dưới đây là khối lượng mol của một số nguyên tố phổ biến mà bạn có thể gặp trong các phản ứng hóa học.
Các nguyên tố kim loại và phi kim thông dụng có khối lượng mol khác nhau, được tính bằng đơn vị gram trên mol \((g/mol)\). Hãy cùng khám phá các nguyên tố và khối lượng mol của chúng:
- Hydro (H): Khối lượng mol là 1.008 g/mol.
- Cacbon (C): Khối lượng mol là 12.011 g/mol.
- Nitơ (N): Khối lượng mol là 14.007 g/mol.
- Oxy (O): Khối lượng mol là 15.999 g/mol.
- Flo (F): Khối lượng mol là 18.998 g/mol.
- Neon (Ne): Khối lượng mol là 20.180 g/mol.
Chúng ta cũng có các kim loại quan trọng với khối lượng mol cụ thể, ví dụ:
- Natri (Na): Khối lượng mol là 22.990 g/mol.
- Nhôm (Al): Khối lượng mol là 26.982 g/mol.
- Lưu huỳnh (S): Khối lượng mol là 32.06 g/mol.
- Kẽm (Zn): Khối lượng mol là 65.38 g/mol.
- Bạc (Ag): Khối lượng mol là 107.87 g/mol.
Dưới đây là bảng tổng hợp khối lượng mol của các nguyên tố phổ biến:
| Nguyên tố | Ký hiệu | Khối lượng mol (g/mol) |
|---|---|---|
| Hydro | H | 1.008 |
| Cacbon | C | 12.011 |
| Oxy | O | 15.999 |
| Natri | Na | 22.990 |
| Nhôm | Al | 26.982 |
Khối lượng mol của mỗi nguyên tố là yếu tố cơ bản để tính toán trong các phản ứng hóa học, giúp xác định được lượng chất cần thiết hoặc sản phẩm tạo thành.

Ứng dụng của khối lượng mol nguyên tử trong thực tế
Khối lượng mol nguyên tử có nhiều ứng dụng quan trọng trong các lĩnh vực khoa học và công nghệ, đặc biệt là trong hóa học và vật lý. Việc hiểu và tính toán khối lượng mol giúp giải quyết nhiều vấn đề thực tế trong nghiên cứu, sản xuất và đời sống hàng ngày.
Dưới đây là một số ứng dụng cụ thể của khối lượng mol nguyên tử:
- Nghiên cứu phản ứng hóa học: Khối lượng mol được sử dụng để xác định lượng chất tham gia và sản phẩm trong các phản ứng hóa học. Điều này giúp các nhà khoa học và kỹ thuật viên tính toán chính xác các tỷ lệ cần thiết cho phản ứng.
- Sản xuất công nghiệp: Trong sản xuất hóa chất và dược phẩm, khối lượng mol là cơ sở để tính toán lượng nguyên liệu cần thiết và lượng sản phẩm thu được, đảm bảo quá trình sản xuất hiệu quả và tiết kiệm chi phí.
- Y học và dược phẩm: Trong ngành y học, khối lượng mol được sử dụng để xác định liều lượng các loại thuốc, đảm bảo chính xác lượng hoạt chất cần thiết để điều trị bệnh một cách hiệu quả và an toàn.
- Vật lý và năng lượng: Khối lượng mol giúp tính toán năng lượng cần thiết trong các phản ứng hạt nhân hoặc quá trình biến đổi vật chất, từ đó tối ưu hóa các công nghệ năng lượng hạt nhân và phát triển các nguồn năng lượng sạch.
Để làm rõ thêm cách khối lượng mol nguyên tử được sử dụng trong thực tế, dưới đây là ví dụ về một phép tính:
Giả sử chúng ta cần tính lượng oxy cần thiết để đốt cháy 1 mol metan \((CH_4)\) trong phản ứng:
\[ CH_4 + 2O_2 \rightarrow CO_2 + 2H_2O \]
Theo phương trình hóa học, ta thấy rằng để đốt cháy 1 mol metan, cần 2 mol oxy \((O_2)\). Biết rằng khối lượng mol của oxy là 32 g/mol, ta có thể tính toán:
\[ 2 \text{ mol } O_2 \times 32 \text{ g/mol } = 64 \text{ g oxy} \]
Nhờ vào khối lượng mol, các tính toán này trở nên đơn giản và chính xác, giúp dự đoán được lượng chất tham gia và sản phẩm trong các quá trình phản ứng.

XEM THÊM:
Phương pháp tính toán và sử dụng khối lượng mol nguyên tử
Khối lượng mol nguyên tử là một trong những khái niệm cơ bản trong hóa học, được sử dụng rộng rãi để tính toán lượng chất tham gia và sản phẩm trong các phản ứng hóa học. Dưới đây là các bước cơ bản để tính toán và sử dụng khối lượng mol nguyên tử:
- Xác định khối lượng mol nguyên tử của nguyên tố: Khối lượng mol của một nguyên tố được lấy từ bảng tuần hoàn, thường được biểu thị bằng đơn vị g/mol. Ví dụ, khối lượng mol của Carbon \((C)\) là 12 g/mol và của Oxy \((O)\) là 16 g/mol.
- Tính khối lượng mol của hợp chất: Để tính khối lượng mol của một hợp chất, bạn cần cộng khối lượng mol của tất cả các nguyên tử trong hợp chất. Ví dụ, khối lượng mol của nước \((H_2O)\) được tính bằng cách:
- Khối lượng mol của Hydrogen \((H)\): 2 \times 1 = 2 \text{ g/mol}
- Khối lượng mol của Oxy \((O)\): 16 \text{ g/mol}
- Tổng khối lượng mol của \((H_2O)\): 2 + 16 = 18 \text{ g/mol}
- Tính toán số mol từ khối lượng: Khi biết khối lượng của một chất và khối lượng mol của nó, ta có thể tính số mol của chất đó bằng công thức:
\[
n = \frac{m}{M}
\]
Trong đó:
- \(n\) là số mol
- \(m\) là khối lượng của chất (tính bằng gram)
- \(M\) là khối lượng mol của chất (tính bằng g/mol)
Ví dụ, nếu bạn có 36 gram nước \((H_2O)\), số mol nước sẽ là:
\[ n = \frac{36 \text{ g}}{18 \text{ g/mol}} = 2 \text{ mol} \] - Sử dụng số mol trong phản ứng hóa học: Khi biết số mol của các chất tham gia, bạn có thể áp dụng định luật bảo toàn khối lượng để tính toán lượng chất tham gia và sản phẩm trong phản ứng. Ví dụ, với phản ứng đốt cháy metan:
\[
CH_4 + 2O_2 \rightarrow CO_2 + 2H_2O
\]
Nếu bạn có 1 mol metan \((CH_4)\), bạn sẽ cần 2 mol oxy \((O_2)\) để phản ứng hoàn toàn, tạo ra 1 mol carbon dioxide \((CO_2)\) và 2 mol nước \((H_2O)\).
Nhờ vào phương pháp tính toán khối lượng mol, chúng ta có thể dự đoán chính xác lượng chất cần thiết và lượng sản phẩm thu được trong các quá trình hóa học, từ đó giúp tối ưu hóa quy trình sản xuất và nghiên cứu khoa học.

So sánh giữa các bảng khối lượng mol nguyên tử theo chuẩn quốc tế
Bảng khối lượng mol nguyên tử theo chuẩn quốc tế thường được các tổ chức khoa học hàng đầu công bố, với mục tiêu đảm bảo tính chính xác và thống nhất trên toàn cầu. Tuy nhiên, mỗi bảng có thể có những sự khác biệt nhỏ do phương pháp đo lường và cập nhật thông tin mới nhất. Dưới đây là sự so sánh giữa các bảng khối lượng mol nguyên tử phổ biến nhất hiện nay:
| Nguyên tố | Bảng IUPAC | Bảng NIST | Bảng ASTM |
|---|---|---|---|
| Hydrogen (H) | 1.00794 g/mol | 1.00797 g/mol | 1.00798 g/mol |
| Carbon (C) | 12.0107 g/mol | 12.011 g/mol | 12.0106 g/mol |
| Oxygen (O) | 15.9994 g/mol | 15.999 g/mol | 15.99903 g/mol |
| Nitrogen (N) | 14.0067 g/mol | 14.007 g/mol | 14.0068 g/mol |
Nhìn vào bảng so sánh trên, ta thấy rằng sự khác biệt giữa các giá trị khối lượng mol nguyên tử là rất nhỏ, chủ yếu do các tổ chức quốc tế khác nhau áp dụng phương pháp đo lường và làm tròn số liệu khác nhau. Tuy nhiên, sự khác biệt này không ảnh hưởng lớn đến kết quả tính toán trong thực tế.
- Phương pháp đo lường: Các bảng khác nhau thường dựa vào các phương pháp đo lường khác nhau, đặc biệt là các kỹ thuật phổ học và khối phổ để xác định chính xác khối lượng nguyên tử.
- Sự cập nhật: IUPAC, NIST và các tổ chức khác thường xuyên cập nhật giá trị khối lượng mol dựa trên những nghiên cứu mới nhất, nhằm đảm bảo độ chính xác cao nhất có thể.
- Sử dụng trong thực tiễn: Mặc dù có sự khác biệt nhỏ về khối lượng mol giữa các bảng, trong thực tế giảng dạy và nghiên cứu, các bảng này đều có thể sử dụng một cách linh hoạt mà không gây ảnh hưởng đáng kể đến các tính toán.
Việc so sánh giữa các bảng khối lượng mol nguyên tử giúp ta hiểu rõ hơn về sự tiến bộ của khoa học và vai trò của các tổ chức quốc tế trong việc duy trì sự thống nhất về số liệu hóa học trên toàn cầu.