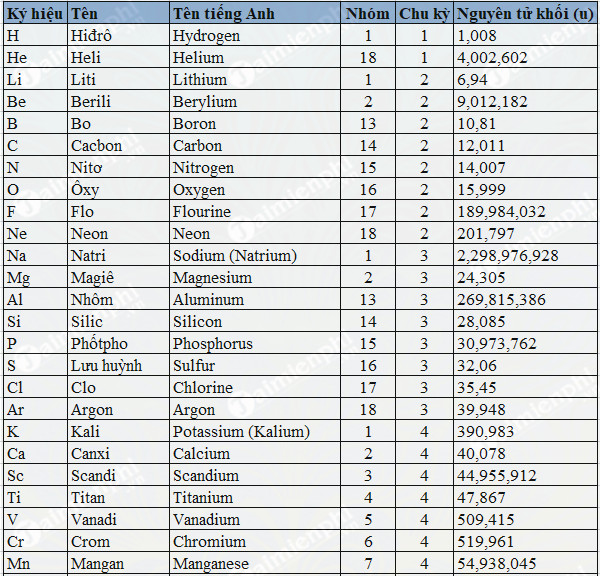
Chủ đề m nguyên tử bằng: M nguyên tử bằng bao nhiêu? Câu hỏi này được giải đáp chi tiết thông qua các công thức tính khối lượng nguyên tử cùng với những ứng dụng thực tiễn trong lĩnh vực hóa học. Khám phá cách sử dụng khối lượng nguyên tử để tính toán và phân tích các phản ứng hóa học một cách chính xác và hiệu quả.
Mục lục
- Cách Tính Khối Lượng Tuyệt Đối của Nguyên Tử
- 1. Khái Niệm Khối Lượng Nguyên Tử
- 2. Công Thức Tính Khối Lượng Nguyên Tử
- 3. Ứng Dụng của Khối Lượng Nguyên Tử
- 4. Các Yếu Tố Ảnh Hưởng Đến Khối Lượng Nguyên Tử
- 5. Sự Khác Biệt Giữa Khối Lượng Tương Đối và Tuyệt Đối
- 6. Cách Đo Lường Khối Lượng Nguyên Tử Trong Phòng Thí Nghiệm
- 7. Tầm Quan Trọng của Khối Lượng Nguyên Tử Trong Các Phản Ứng Hóa Học
- 8. Lịch Sử Phát Triển Khái Niệm Khối Lượng Nguyên Tử
Cách Tính Khối Lượng Tuyệt Đối của Nguyên Tử
Khối lượng tuyệt đối của một nguyên tử được xác định dựa trên số lượng proton, neutron trong hạt nhân và electron bao quanh hạt nhân. Công thức cơ bản để tính khối lượng tuyệt đối của một nguyên tử là:
- Khối lượng của proton: \( m_p = 1.6726219 \times 10^{-27} \, kg \)
- Khối lượng của neutron: \( m_n = 1.674929 \times 10^{-27} \, kg \)
- Khối lượng của electron: \( m_e = 9.10938356 \times 10^{-31} \, kg \)
Khối lượng tuyệt đối của nguyên tử có thể được tính như sau:
\[ m = Z \times m_p + N \times m_n + e \times m_e \]
Trong đó:
- \( Z \) là số proton
- \( N \) là số neutron
- \( e \) là số electron
Tính Khối Lượng Tuyệt Đối của Nguyên Tử Bằng Đơn Vị amu
Đơn vị amu (atomic mass unit) là đơn vị chuẩn để đo khối lượng của nguyên tử. 1 amu bằng \(\frac{1}{12}\) khối lượng của nguyên tử carbon-12. Khối lượng của các hạt thành phần trong đơn vị amu như sau:
- Khối lượng proton: \( m_p \approx 1.0073 \, amu \)
- Khối lượng neutron: \( m_n \approx 1.0087 \, amu \)
- Khối lượng electron: \( m_e \approx 0.0005485799 \, amu \)
Ví dụ: Đối với nguyên tử Carbon-12 với 6 proton và 6 neutron, khối lượng tuyệt đối của nguyên tử được tính như sau:
\[ m = 6 \times 1.0073 \, amu + 6 \times 1.0087 \, amu = 12 \, amu \]
Chuyển Đổi Khối Lượng Từ amu Sang Gam và Kilogram
Khối lượng tuyệt đối trong đơn vị amu có thể chuyển đổi sang gam hoặc kilogram bằng cách sử dụng hệ số chuyển đổi:
- 1 amu = \( 1.6605 \times 10^{-24} \, g \)
- 1 amu = \( 1.6605 \times 10^{-27} \, kg \)
Ví dụ: Với nguyên tử oxy-16 có khối lượng tuyệt đối khoảng 16 amu, khối lượng tuyệt đối trong gam và kilogram là:
\[ m (g) = 16 \times 1.6605 \times 10^{-24} = 2.6568 \times 10^{-23} \, g \]
\[ m (kg) = 16 \times 1.6605 \times 10^{-27} = 2.6568 \times 10^{-26} \, kg \]
Sự Khác Biệt Giữa Khối Lượng Tương Đối và Tuyệt Đối
Khối lượng tương đối (hay nguyên tử khối) là khối lượng của một nguyên tử so với \(\frac{1}{12}\) khối lượng của nguyên tử carbon-12. Nguyên tử khối thường được sử dụng để biểu diễn khối lượng của nguyên tử trong các phản ứng hóa học.
Khối lượng tuyệt đối là khối lượng thực tế của nguyên tử được tính bằng các đơn vị vật lý như gam hoặc kilogram, giúp định lượng chính xác khối lượng của nguyên tử trong các thí nghiệm vật lý và hóa học.

.png)
1. Khái Niệm Khối Lượng Nguyên Tử
Khối lượng nguyên tử là khái niệm cơ bản trong hóa học và vật lý, phản ánh trọng lượng của một nguyên tử trong một nguyên tố hóa học. Khối lượng này thường được đo bằng đơn vị khối lượng nguyên tử (amu), ký hiệu là \(\text{u}\), với 1 amu tương đương với \(\frac{1}{12}\) khối lượng của một nguyên tử carbon-12.
Khối lượng nguyên tử được xác định bởi tổng khối lượng của các proton, neutron và electron trong nguyên tử. Tuy nhiên, electron có khối lượng rất nhỏ nên đóng góp không đáng kể vào khối lượng tổng.
Khối lượng nguyên tử có thể được chia thành hai loại:
- Khối lượng nguyên tử tuyệt đối: Đây là khối lượng thực của một nguyên tử, đo bằng đơn vị kilogram (kg). Để tính toán khối lượng tuyệt đối, người ta sử dụng công thức sau:
Trong đó:
- \(m\) là khối lượng tuyệt đối của nguyên tử.
- \(A\) là khối lượng nguyên tử tính bằng amu.
- Khối lượng nguyên tử tương đối: Là khối lượng của một nguyên tử so với khối lượng của một nguyên tử carbon-12. Đây là con số không có đơn vị, biểu thị tỷ lệ giữa khối lượng của nguyên tử và \(1/12\) khối lượng của một nguyên tử carbon-12.
Khối lượng nguyên tử tương đối thường được sử dụng trong các phép tính hóa học và bảng tuần hoàn, nơi nó giúp so sánh khối lượng của các nguyên tử khác nhau một cách dễ dàng và thuận tiện hơn.
2. Công Thức Tính Khối Lượng Nguyên Tử
Khối lượng nguyên tử của một nguyên tố được tính bằng công thức:
\[
m_{\text{nguyên tử}} = \frac{M_{\text{nguyên tử}}}{N_A}
\]
Trong đó:
- \(m_{\text{nguyên tử}}\): Khối lượng của một nguyên tử (đơn vị: gam).
- \(M_{\text{nguyên tử}}\): Khối lượng mol của nguyên tố đó (đơn vị: gam/mol).
- \(N_A\): Số Avogadro, với giá trị xấp xỉ \(6.022 \times 10^{23}\) hạt/mol.
Ví dụ, để tính khối lượng của một nguyên tử cacbon:
\[
m_{\text{C}} = \frac{12.01 \, \text{g/mol}}{6.022 \times 10^{23} \, \text{nguyên tử/mol}} \approx 1.994 \times 10^{-23} \, \text{g}
\]
Bằng cách sử dụng công thức này, bạn có thể tính toán khối lượng của bất kỳ nguyên tử nào dựa trên khối lượng mol của nó. Đây là một công cụ quan trọng trong hóa học giúp bạn hiểu rõ hơn về các nguyên tố ở mức độ vi mô và ứng dụng chúng trong nghiên cứu cũng như thực tiễn.

3. Ứng Dụng của Khối Lượng Nguyên Tử
Khối lượng nguyên tử là một đại lượng quan trọng trong hóa học và vật lý, được sử dụng để xác định nhiều tính chất và quá trình liên quan đến các nguyên tử và phân tử. Dưới đây là một số ứng dụng tiêu biểu của khối lượng nguyên tử:
-
Xác định khối lượng mol:
Khối lượng nguyên tử được dùng để tính khối lượng mol của một nguyên tố hay hợp chất. Khối lượng mol (\(M\)) của một chất được tính bằng cách nhân khối lượng nguyên tử trung bình của các nguyên tử trong chất đó với số mol (n). Công thức tính khối lượng mol là:
\[ M = n \times m_{\text{nguyên tử}} \]
-
Tính toán hóa học:
Khối lượng nguyên tử là cơ sở để tính toán lượng chất tham gia và tạo thành trong các phản ứng hóa học, từ đó giúp xác định được tỉ lệ hợp lý giữa các chất phản ứng và sản phẩm.
-
Phân tích thành phần nguyên tố:
Thông qua khối lượng nguyên tử, người ta có thể xác định thành phần phần trăm khối lượng của mỗi nguyên tố trong hợp chất, hỗ trợ trong việc phân tích thành phần hóa học của vật liệu.
-
Xác định tỉ lệ đồng vị:
Khối lượng nguyên tử cũng giúp xác định tỉ lệ phần trăm của các đồng vị khác nhau của một nguyên tố trong tự nhiên, từ đó có thể tính toán được khối lượng nguyên tử trung bình của nguyên tố đó.
Những ứng dụng trên không chỉ giới hạn trong phòng thí nghiệm, mà còn có tầm quan trọng lớn trong nhiều lĩnh vực như y học, môi trường, và công nghệ.

4. Các Yếu Tố Ảnh Hưởng Đến Khối Lượng Nguyên Tử
Khối lượng nguyên tử của một nguyên tố được xác định bởi tổng khối lượng của proton và neutron trong hạt nhân của nó. Tuy nhiên, có nhiều yếu tố khác nhau có thể ảnh hưởng đến khối lượng nguyên tử thực tế của một nguyên tố, bao gồm:
- Đồng vị: Một nguyên tố có thể tồn tại dưới nhiều dạng đồng vị khác nhau, mỗi đồng vị có số neutron khác nhau trong hạt nhân. Khối lượng nguyên tử trung bình của một nguyên tố là kết quả trung bình của các khối lượng của các đồng vị, có tính đến tỉ lệ phần trăm xuất hiện của mỗi đồng vị.
- Năng lượng liên kết hạt nhân: Khi các proton và neutron liên kết với nhau để tạo thành hạt nhân, một phần khối lượng của chúng bị mất đi dưới dạng năng lượng theo phương trình nổi tiếng của Einstein \[E = mc^2\]. Năng lượng liên kết càng lớn, khối lượng hạt nhân càng giảm, dẫn đến sự khác biệt giữa tổng khối lượng của các nucleon riêng lẻ và khối lượng của hạt nhân thực tế.
- Ảnh hưởng của electron: Mặc dù khối lượng của electron rất nhỏ so với proton và neutron, nhưng chúng vẫn góp phần vào tổng khối lượng nguyên tử. Tuy nhiên, sự đóng góp này thường không đáng kể và có thể bỏ qua trong nhiều trường hợp.
- Hiệu ứng tương đối tính: Ở các nguyên tố nặng, các electron di chuyển với vận tốc rất cao, gần với tốc độ ánh sáng. Hiệu ứng tương đối tính làm tăng khối lượng của các electron này, ảnh hưởng đến tổng khối lượng nguyên tử.
Những yếu tố trên đóng vai trò quan trọng trong việc xác định khối lượng nguyên tử của các nguyên tố khác nhau, đặc biệt là khi xem xét các nguyên tố nặng hoặc các nguyên tố có nhiều đồng vị khác nhau.

5. Sự Khác Biệt Giữa Khối Lượng Tương Đối và Tuyệt Đối
Khối lượng nguyên tử là một đại lượng quan trọng trong hóa học, và nó có thể được đo lường dưới hai dạng chính: khối lượng tuyệt đối và khối lượng tương đối. Mỗi loại có cách tính toán và ứng dụng riêng biệt trong nghiên cứu khoa học.
- Khối lượng tuyệt đối: Đây là khối lượng thực tế của một nguyên tử, thường được tính bằng đơn vị kilogram (kg). Tuy nhiên, do khối lượng của một nguyên tử rất nhỏ, đơn vị này ít khi được sử dụng trực tiếp. Ví dụ, khối lượng tuyệt đối của một nguyên tử carbon-12 là \(1.992 \times 10^{-26}\) kg.
- Khối lượng tương đối: Khối lượng tương đối của một nguyên tử được tính bằng cách so sánh khối lượng của nó với khối lượng của một đơn vị chuẩn. Đơn vị chuẩn này thường là \(\frac{1}{12}\) của khối lượng nguyên tử carbon-12. Kết quả được biểu diễn dưới dạng một đại lượng không thứ nguyên, thường được gọi là "đơn vị khối lượng nguyên tử" (u) hoặc Dalton (Da). Ví dụ, khối lượng tương đối của nguyên tử carbon-12 là 12 u.
Các yếu tố khác nhau như sự phổ biến của các đồng vị hoặc năng lượng liên kết trong hạt nhân có thể làm thay đổi khối lượng tuyệt đối của một nguyên tử. Tuy nhiên, khối lượng tương đối, vì được chuẩn hóa so với một đơn vị chuẩn, thường ổn định hơn và dễ sử dụng trong các phép tính hóa học.
Như vậy, sự khác biệt cơ bản giữa khối lượng tuyệt đối và tương đối nằm ở cách đo lường và mục đích sử dụng của chúng trong các ngữ cảnh khác nhau của nghiên cứu khoa học.
XEM THÊM:
6. Cách Đo Lường Khối Lượng Nguyên Tử Trong Phòng Thí Nghiệm
Để đo lường khối lượng nguyên tử trong phòng thí nghiệm, người ta sử dụng những thiết bị hiện đại cùng với các phương pháp đo lường truyền thống. Các bước cơ bản bao gồm:
6.1 Sử Dụng Thiết Bị Hiện Đại
- Máy Quang Phổ Khối Lượng (Mass Spectrometer): Thiết bị này hoạt động dựa trên nguyên lý ion hóa các nguyên tử, sau đó đo lường tỷ số giữa khối lượng và điện tích (m/z) để xác định khối lượng của từng nguyên tử một cách chính xác.
- Cân Vi Tế Bào (Microbalance): Cân vi tế bào là một loại cân siêu nhạy, có khả năng đo lường khối lượng cực nhỏ đến cỡ vài picogram, được sử dụng để đo lường khối lượng của các mẫu nguyên tử cực kỳ nhỏ.
- Phổ Kế Raman: Thiết bị này đo tán xạ Raman của các nguyên tử, qua đó giúp xác định được các đặc tính về khối lượng và cấu trúc của chúng.
6.2 Phương Pháp Truyền Thống
- Cân Thăng Bằng (Analytical Balance): Đây là phương pháp cổ điển, sử dụng cân để đo khối lượng mẫu. Phương pháp này có độ chính xác thấp hơn so với các thiết bị hiện đại nhưng vẫn được sử dụng rộng rãi trong các thí nghiệm cơ bản.
- Phương Pháp Tính Toán: Khối lượng nguyên tử có thể được tính toán dựa trên khối lượng mol và số Avogadro. Công thức tính khối lượng nguyên tử tuyệt đối:
\[
m_{\text{nguyên tử}} = \frac{M_{\text{mol}}}{N_{\text{A}}}
\]
Trong đó:
- \( m_{\text{nguyên tử}} \) là khối lượng nguyên tử (g)
- \( M_{\text{mol}} \) là khối lượng mol (g/mol)
- \( N_{\text{A}} \) là số Avogadro \(6.022 \times 10^{23}\) (mol\(^{-1}\))
Cả hai phương pháp hiện đại và truyền thống đều có vai trò quan trọng trong việc đo lường khối lượng nguyên tử. Sự kết hợp giữa chúng giúp đạt được kết quả chính xác và tin cậy hơn trong nghiên cứu khoa học.

7. Tầm Quan Trọng của Khối Lượng Nguyên Tử Trong Các Phản Ứng Hóa Học
Khối lượng nguyên tử đóng vai trò cực kỳ quan trọng trong các phản ứng hóa học, vì nó quyết định lượng chất tham gia và sản phẩm được tạo ra trong quá trình phản ứng. Để hiểu rõ hơn về tầm quan trọng này, chúng ta cần xem xét các khía cạnh sau:
7.1. Tính Toán Số Mol và Khối Lượng Chất
Trong hóa học, khối lượng của một chất thường được đo lường dưới dạng số mol. Công thức tính số mol dựa trên khối lượng và khối lượng mol như sau:
\[ n = \frac{m}{M} \]
Trong đó:
- \( n \) là số mol của chất
- \( m \) là khối lượng của chất (g)
- \( M \) là khối lượng mol của chất (g/mol)
Ví dụ, để tính số mol của 8g oxy (\(O_2\)), ta sử dụng công thức trên:
\[ n_{O_2} = \frac{8}{32} = 0,25 \, \text{mol} \]
7.2. Xác Định Số Lượng Nguyên Tử và Phân Tử
Khối lượng nguyên tử cũng là yếu tố quyết định số lượng nguyên tử hoặc phân tử có trong một lượng chất xác định. Điều này được xác định bằng cách sử dụng hằng số Avogadro, với giá trị:
\[ N_A = 6,022 \times 10^{23} \, \text{hạt/mol} \]
Sử dụng công thức:
\[ N = n \times N_A \]
Chẳng hạn, với 0,25 mol oxy, số phân tử oxy sẽ là:
\[ N_{O_2} = 0,25 \times 6,022 \times 10^{23} = 1,506 \times 10^{23} \, \text{phân tử} \]
7.3. Ảnh Hưởng Đến Hiệu Quả Phản Ứng Hóa Học
Trong các phản ứng hóa học, khối lượng nguyên tử của các chất tham gia không chỉ ảnh hưởng đến tốc độ phản ứng mà còn quyết định sự cân bằng giữa các chất phản ứng và sản phẩm. Một phản ứng có thể diễn ra một cách hiệu quả khi tỉ lệ mol của các chất tham gia phù hợp với phương trình hóa học.
Ví dụ, trong phản ứng tạo nước từ khí hydro và khí oxy:
\[ 2H_2 + O_2 \rightarrow 2H_2O \]
Để phản ứng diễn ra hoàn toàn, cần có 2 mol khí hydro và 1 mol khí oxy. Việc tính toán đúng khối lượng của các chất này sẽ đảm bảo rằng không có chất dư thừa sau phản ứng.
7.4. Ứng Dụng Trong Thực Tế
Khối lượng nguyên tử và các phép tính liên quan được sử dụng rộng rãi trong các ngành công nghiệp hóa chất, dược phẩm, và môi trường. Việc xác định chính xác khối lượng các chất giúp tối ưu hóa quy trình sản xuất và giảm thiểu lãng phí.
Ví dụ, trong sản xuất thuốc, việc tính toán chính xác liều lượng các thành phần dựa trên khối lượng nguyên tử giúp đảm bảo an toàn và hiệu quả cho người sử dụng.
Như vậy, khối lượng nguyên tử không chỉ là một khái niệm cơ bản trong hóa học mà còn là yếu tố then chốt quyết định sự thành công của các phản ứng hóa học và ứng dụng trong thực tiễn.

8. Lịch Sử Phát Triển Khái Niệm Khối Lượng Nguyên Tử
Khái niệm về khối lượng nguyên tử đã trải qua nhiều giai đoạn phát triển quan trọng trong lịch sử hóa học, đóng vai trò then chốt trong việc hiểu rõ bản chất của các phản ứng hóa học và cấu trúc của các chất.
Sự Khởi Đầu của Khái Niệm
Khái niệm khối lượng nguyên tử bắt đầu từ thế kỷ 19 khi các nhà khoa học như John Dalton đề xuất ý tưởng rằng nguyên tử là các hạt cơ bản không thể chia nhỏ và mỗi nguyên tố có một khối lượng nguyên tử cố định. Dalton đã sử dụng khối lượng tương đối của nguyên tử để giải thích các phản ứng hóa học và tạo ra bảng khối lượng nguyên tử đầu tiên.
Sự Phát Triển Qua Các Giai Đoạn
- Giữa thế kỷ 19: Các nhà khoa học như Stanislao Cannizzaro và Dmitri Mendeleev đã cải tiến và hệ thống hóa khái niệm khối lượng nguyên tử. Mendeleev đặc biệt nổi tiếng với việc sắp xếp các nguyên tố theo khối lượng nguyên tử tăng dần, từ đó xây dựng bảng tuần hoàn các nguyên tố.
- Đầu thế kỷ 20: Với sự phát triển của vật lý lượng tử và mô hình nguyên tử Bohr, hiểu biết về khối lượng nguyên tử đã được mở rộng. Các hạt nhân nguyên tử, bao gồm proton và neutron, được phát hiện, dẫn đến việc xác định khối lượng nguyên tử chính xác hơn.
- Ngày nay: Khối lượng nguyên tử được đo lường chính xác nhờ các kỹ thuật tiên tiến như phổ khối, và được sử dụng rộng rãi trong việc xác định thành phần hóa học và cấu trúc của các chất.
Tầm Quan Trọng Của Khối Lượng Nguyên Tử
Khối lượng nguyên tử không chỉ là một khái niệm cơ bản trong hóa học mà còn là yếu tố then chốt trong nhiều lĩnh vực khoa học khác. Nó giúp các nhà hóa học xác định chính xác tỷ lệ giữa các nguyên tố trong hợp chất, hiểu rõ hơn về cấu trúc phân tử, và dự đoán kết quả của các phản ứng hóa học. Trong vật lý, khối lượng nguyên tử đóng vai trò quan trọng trong việc nghiên cứu các hiện tượng vi mô và sự tương tác giữa các hạt cơ bản.