Chủ đề số nguyên tử khối của ba: Số nguyên tử khối của Ba không chỉ là con số trong bảng tuần hoàn, mà còn mang lại nhiều ứng dụng quan trọng trong cả nghiên cứu hóa học và thực tiễn đời sống. Bài viết này sẽ cung cấp một cái nhìn toàn diện về số nguyên tử khối của Ba, từ các đồng vị đến ứng dụng thực tế, giúp bạn nắm rõ và áp dụng hiệu quả.
Mục lục
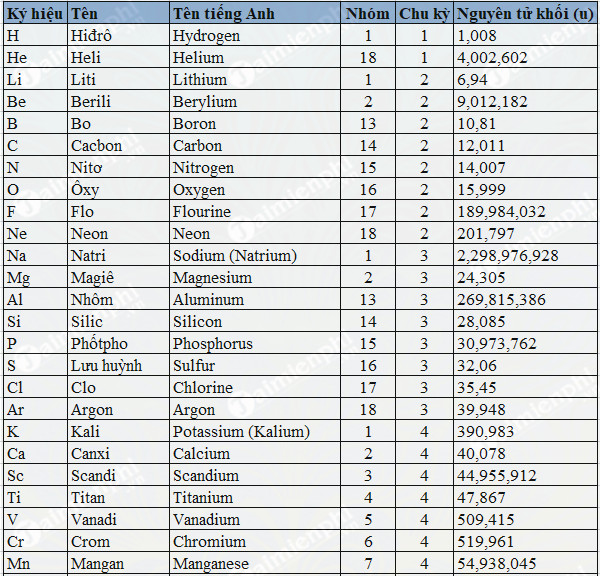
Nguyên Tử Khối Của Ba (Bari)
Nguyên tử khối của Bari (Ba) là một thông tin quan trọng trong hóa học, đặc biệt khi bạn cần tính toán các phản ứng hóa học hoặc xác định tỷ lệ phần trăm khối lượng của các nguyên tố trong hợp chất. Bari là một nguyên tố hóa học thuộc nhóm kim loại kiềm thổ, có ký hiệu hóa học là Ba và số nguyên tử là 56.
1. Nguyên Tử Khối Trung Bình Của Bari
Nguyên tử khối của Bari được tính toán dựa trên khối lượng trung bình của tất cả các đồng vị tự nhiên của nguyên tố này. Công thức tổng quát để tính nguyên tử khối trung bình như sau:
\[
\text{Nguyên tử khối trung bình của Bari} = \sum_{i} \left(\text{khối lượng đồng vị}_i \times \text{phần trăm đồng vị}_i\right)
\]
Áp dụng công thức này cho các đồng vị của Bari, chúng ta có nguyên tử khối trung bình của Bari là khoảng 137.33 amu (đơn vị khối lượng nguyên tử).
2. Các Đồng Vị Ổn Định Của Bari
Bari có bảy đồng vị ổn định trong tự nhiên, với các tỷ lệ phần trăm tồn tại như sau:
- Ba-130: 0.106%
- Ba-132: 0.101%
- Ba-134: 2.417%
- Ba-135: 6.592%
- Ba-136: 7.854%
- Ba-137: 11.232%
- Ba-138: 71.698%
3. Ứng Dụng Của Bari
Bari có nhiều ứng dụng quan trọng trong y học và công nghiệp:
- Trong y học: Bari sulfat (BaSO4) được sử dụng trong chẩn đoán hình ảnh, đặc biệt trong các xét nghiệm X-quang để tăng độ tương phản.
- Trong công nghiệp: Bari được sử dụng trong sản xuất pháo hoa, tạo màu xanh lục cho ngọn lửa. Ngoài ra, Bari còn được sử dụng trong sản xuất gốm sứ và thủy tinh.
4. Bài Tập Về Nguyên Tử Khối Của Bari
Để hiểu rõ hơn về cách tính toán nguyên tử khối, bạn có thể tham khảo các bài tập ví dụ sau:
Ví dụ: Tính nguyên tử khối trung bình của Bari dựa trên các đồng vị sau:
- Ba-134 có khối lượng 134 amu và chiếm 2.417%.
- Ba-135 có khối lượng 135 amu và chiếm 6.592%.
Lời giải:
\[
\text{Nguyên tử khối trung bình của Bari} = (134 \times 0.02417) + (135 \times 0.06592) + \dots = 137.33 \text{ amu}
\]
5. Kết Luận
Nguyên tử khối của Bari là một thông tin cơ bản nhưng vô cùng quan trọng trong lĩnh vực hóa học. Việc nắm vững kiến thức này giúp bạn hiểu sâu hơn về tính chất hóa học của Bari và các ứng dụng thực tiễn trong đời sống.

.png)
1. Giới Thiệu Về Nguyên Tử Khối Của Ba
Nguyên tử khối của Ba (Bari) là khối lượng trung bình của các đồng vị của nguyên tố này, được biểu thị bằng đơn vị khối lượng nguyên tử (amu). Giá trị này phản ánh khối lượng tương đối của nguyên tử Ba so với một nguyên tử cacbon-12. Bari là một nguyên tố kim loại kiềm thổ nằm ở nhóm II trong bảng tuần hoàn với nguyên tử khối trung bình khoảng \(137.33\) amu.
Nguyên tử khối của một nguyên tố được tính toán dựa trên tỉ lệ phần trăm và khối lượng của các đồng vị tự nhiên của nó. Các đồng vị của Ba bao gồm:
- \(^{130}Ba\) - chiếm khoảng 0.106%
- \(^{132}Ba\) - chiếm khoảng 0.101%
- \(^{134}Ba\) - chiếm khoảng 2.417%
- \(^{135}Ba\) - chiếm khoảng 6.592%
- \(^{136}Ba\) - chiếm khoảng 7.854%
- \(^{137}Ba\) - chiếm khoảng 11.232%
- \(^{138}Ba\) - chiếm khoảng 71.698%
Nguyên tử khối trung bình của Ba được tính bằng cách áp dụng công thức:
Nhờ vào các tính toán này, chúng ta xác định được nguyên tử khối trung bình của Ba là \(137.33\) amu, con số quan trọng trong việc xác định các tính chất hóa học và vật lý của nguyên tố này.
2. Các Đồng Vị Của Ba và Nguyên Tử Khối Trung Bình
Nguyên tố Bari (Ba) có nhiều đồng vị khác nhau trong tự nhiên. Mỗi đồng vị có một khối lượng riêng và tỷ lệ xuất hiện trong tự nhiên. Những đồng vị này đóng vai trò quan trọng trong việc xác định nguyên tử khối trung bình của Bari.
Các đồng vị ổn định của Bari bao gồm:
- Ba-130: 0,106%
- Ba-132: 0,101%
- Ba-134: 2,417%
- Ba-135: 6,592%
- Ba-136: 7,854%
- Ba-137: 11,232%
- Ba-138: 71,698%
Nguyên tử khối trung bình của Bari được tính dựa trên khối lượng của từng đồng vị và tỷ lệ của chúng trong tự nhiên. Công thức để tính nguyên tử khối trung bình như sau:
\[
\text{Nguyên tử khối trung bình} = \sum_{i} (\text{khối lượng đồng vị}_i \times \text{phần trăm đồng vị}_i)
\]
Áp dụng công thức này, nguyên tử khối trung bình của Bari được tính như sau:
\[
\text{Nguyên tử khối trung bình của Ba} = (130 \times 0,00106) + (132 \times 0,00101) + (134 \times 0,02417) + (135 \times 0,06592) + (136 \times 0,07854) + (137 \times 0,11232) + (138 \times 0,71698)
\]
Sau khi thực hiện các phép tính trên, kết quả nguyên tử khối trung bình của Bari là khoảng 137,33 amu (đơn vị khối lượng nguyên tử).
Kết quả này là cơ sở quan trọng trong nhiều ứng dụng khoa học và công nghiệp liên quan đến nguyên tố Bari.

3. Ứng Dụng Của Nguyên Tử Khối Trong Hóa Học
Nguyên tử khối đóng vai trò quan trọng trong nhiều lĩnh vực hóa học, đặc biệt là trong việc tính toán và xác định khối lượng phân tử, tỷ lệ phản ứng và cả trong phân tích định lượng các chất hóa học. Dưới đây là một số ứng dụng tiêu biểu của nguyên tử khối trong hóa học:
- Tính toán khối lượng phân tử: Sử dụng nguyên tử khối để xác định khối lượng phân tử của một hợp chất là một trong những ứng dụng cơ bản và quan trọng nhất. Ví dụ, khối lượng phân tử của nước \((H_2O)\) có thể tính bằng cách cộng khối lượng của hai nguyên tử hydro \((H)\) và một nguyên tử oxy \((O)\) lại với nhau.
- Xác định tỷ lệ phản ứng: Nguyên tử khối cũng được sử dụng để xác định tỷ lệ mol giữa các chất tham gia trong một phản ứng hóa học. Điều này giúp dự đoán lượng sản phẩm tạo ra hoặc lượng chất tham gia phản ứng cần thiết.
- Phân tích định lượng: Trong các phân tích định lượng, nguyên tử khối được sử dụng để tính toán nồng độ các chất trong một mẫu. Điều này rất hữu ích trong việc phân tích môi trường, thực phẩm, và các ngành công nghiệp khác.
- Ứng dụng trong y học: Ví dụ, trong y học, nguyên tử khối của bari \((Ba)\) và các hợp chất của nó như bari sulfat \((BaSO_4)\) được sử dụng rộng rãi trong các xét nghiệm hình ảnh chẩn đoán, giúp tăng độ tương phản trong các hình chụp X-quang.
Những ứng dụng trên cho thấy nguyên tử khối không chỉ là một con số mang tính lý thuyết mà còn có nhiều giá trị thực tiễn trong hóa học và các ngành liên quan.

4. Các Ví Dụ Cụ Thể Về Tính Toán Nguyên Tử Khối
Để hiểu rõ hơn về cách tính toán nguyên tử khối, hãy cùng xem qua một số ví dụ cụ thể dưới đây. Những ví dụ này sẽ minh họa cách áp dụng nguyên tử khối trong việc tính toán khối lượng phân tử và khối lượng mol của các hợp chất.
- Ví dụ 1: Tính khối lượng phân tử của nước
Để tính khối lượng phân tử của nước \((H_2O)\), ta cần biết nguyên tử khối của hydrogen \((H)\) và oxygen \((O)\). Hydrogen có nguyên tử khối là 1, và oxygen là 16. Do đó, khối lượng phân tử của nước là:
\[ H_2O = 2 \times 1 + 16 = 18 \text{ đvC} \] - Ví dụ 2: Tính khối lượng mol của khí carbon dioxide
Carbon dioxide \((CO_2)\) gồm một nguyên tử carbon \((C)\) và hai nguyên tử oxygen \((O)\). Carbon có nguyên tử khối là 12, và oxygen là 16. Vậy khối lượng mol của carbon dioxide là:
\[ CO_2 = 12 + 2 \times 16 = 44 \text{ g/mol} \] - Ví dụ 3: Tính nguyên tử khối trung bình của đồng vị bari
Bari \((Ba)\) có nhiều đồng vị, trong đó đồng vị phổ biến nhất là \(^{{137}}Ba\) với nguyên tử khối là 137 đvC. Để tính nguyên tử khối trung bình, ta có thể áp dụng công thức tính dựa trên tỷ lệ phần trăm của từng đồng vị.
Các ví dụ trên giúp minh họa rõ ràng cách sử dụng nguyên tử khối trong các phép tính toán học và hóa học cụ thể.

5. Tầm Quan Trọng Của Việc Hiểu Rõ Nguyên Tử Khối
Hiểu rõ nguyên tử khối là yếu tố quan trọng giúp chúng ta nắm vững bản chất của các phản ứng hóa học. Nguyên tử khối không chỉ giúp tính toán chính xác khối lượng của các nguyên tố và hợp chất, mà còn đóng vai trò quan trọng trong việc xác định lượng chất phản ứng và sản phẩm trong các phương trình hóa học.
Nguyên tử khối còn là cơ sở để hiểu và dự đoán tính chất vật lý và hóa học của các nguyên tố, từ đó áp dụng vào thực tế trong các lĩnh vực như sản xuất, nghiên cứu khoa học và giảng dạy. Việc nắm vững nguyên tử khối cũng giúp chúng ta hiểu sâu hơn về cấu trúc vi mô của vật chất và sự tương tác giữa các nguyên tử, đóng góp vào sự tiến bộ của khoa học và công nghệ.
Với vai trò to lớn như vậy, việc học và hiểu nguyên tử khối không chỉ cần thiết đối với các nhà hóa học mà còn với bất kỳ ai quan tâm đến khoa học tự nhiên, đảm bảo tính chính xác trong nghiên cứu và ứng dụng thực tế.
XEM THÊM:
6. Kết Luận
Tổng kết lại, việc hiểu rõ về nguyên tử khối của Ba và các yếu tố liên quan như đồng vị và cách tính toán nguyên tử khối trung bình là nền tảng quan trọng trong hóa học. Nguyên tử khối không chỉ giúp ích trong các bài toán tính toán khối lượng chất, mà còn cung cấp cái nhìn sâu sắc về cấu trúc và tính chất của các nguyên tố. Sự hiểu biết này không chỉ hỗ trợ trong học tập mà còn mở rộng ứng dụng thực tế trong nghiên cứu và công nghiệp.
Với kiến thức về nguyên tử khối, chúng ta có thể tiếp cận các vấn đề khoa học với sự tự tin và chính xác hơn, từ đó góp phần vào sự phát triển của nhiều lĩnh vực khoa học và công nghệ trong tương lai.