Chủ đề chương 1 cấu tạo nguyên tử: Chương 1 "Cấu Tạo Nguyên Tử" giới thiệu về cấu trúc cơ bản của nguyên tử, bao gồm các thành phần như proton, neutron và electron cùng với cách chúng tương tác để tạo nên sự ổn định của nguyên tử. Bài viết này cung cấp cái nhìn sâu sắc về các nguyên lý phân bố electron, cấu hình electron, và ứng dụng thực tiễn của các khái niệm này trong nhiều lĩnh vực khoa học và công nghệ.
Mục lục
- Chương 1: Cấu Tạo Nguyên Tử - Hóa Học Lớp 10
- 1. Giới thiệu về cấu tạo nguyên tử
- 2. Thành phần cấu tạo của nguyên tử
- 3. Các loại hạt trong nguyên tử
- 4. Kích thước và khối lượng của nguyên tử
- 5. Nguyên tố hóa học và số khối
- 6. Đồng vị và nguyên tử khối trung bình
- 7. Cấu trúc lớp vỏ electron của nguyên tử
- 8. Tính chất của các hạt trong nguyên tử
- 9. Bài tập và ôn tập chương 1
- 10. Tài liệu và phương pháp học tập
Chương 1: Cấu Tạo Nguyên Tử - Hóa Học Lớp 10
Chương 1 "Cấu tạo nguyên tử" thuộc môn Hóa học lớp 10, bao gồm các kiến thức cơ bản về thành phần, cấu trúc, và tính chất của nguyên tử. Nội dung này giúp học sinh hiểu rõ hơn về cấu trúc vi mô của vật chất và các khái niệm liên quan.
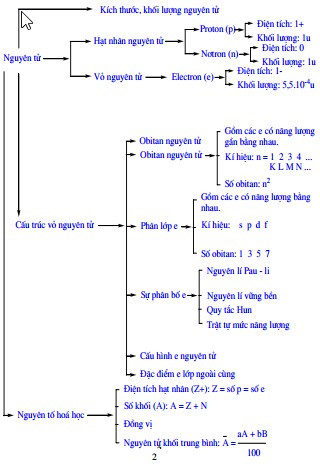
1. Thành phần cấu tạo của nguyên tử
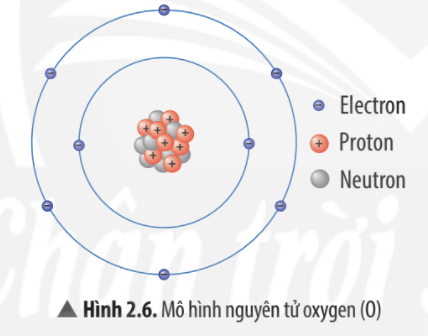
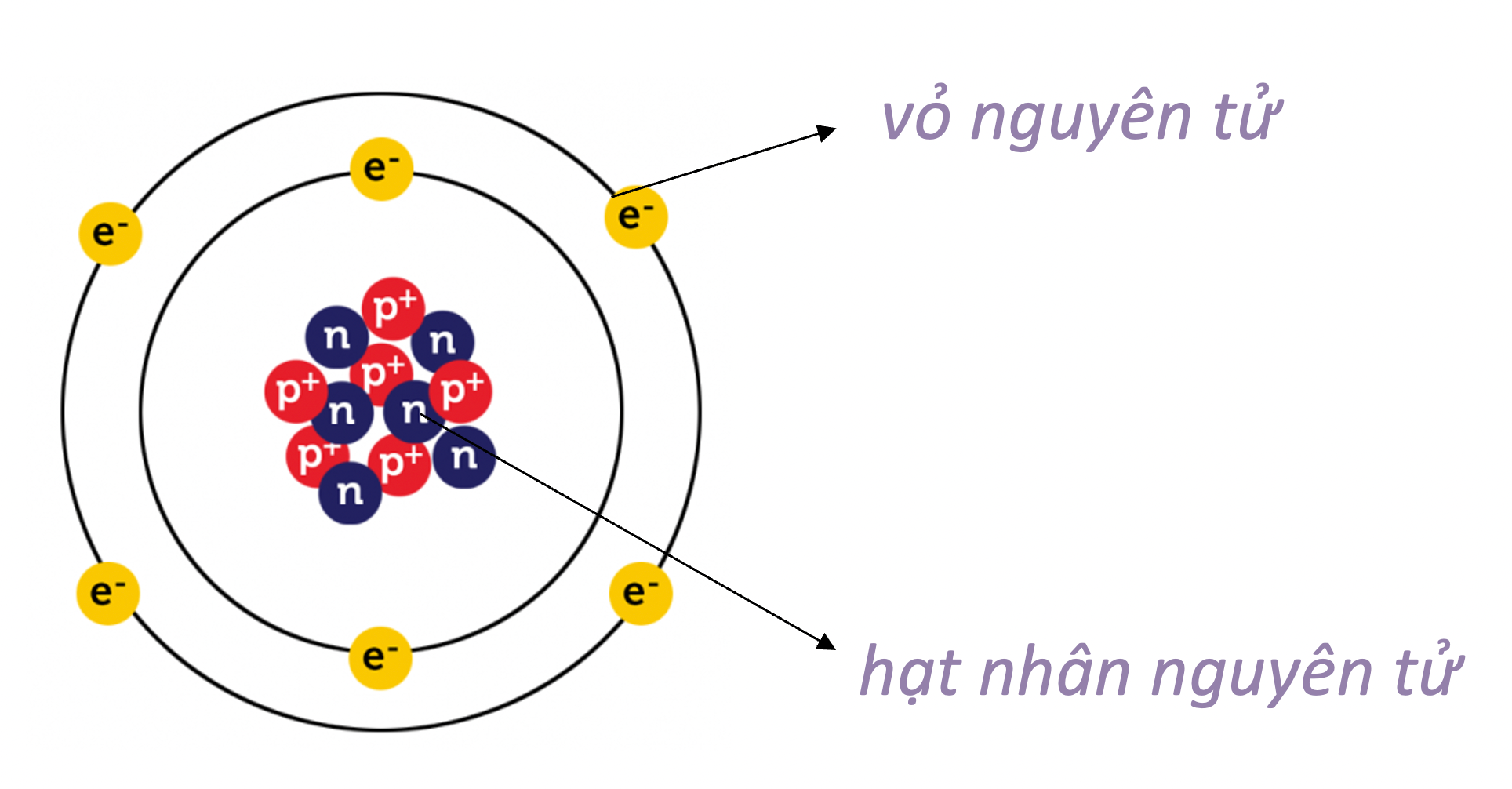
- Nguyên tử bao gồm hai phần chính: hạt nhân và vỏ electron.
- Hạt nhân: Gồm các proton (mang điện tích dương) và neutron (không mang điện).
- Vỏ electron: Bao gồm các electron (mang điện tích âm) chuyển động xung quanh hạt nhân.
2. Các khái niệm quan trọng trong cấu tạo nguyên tử
- Số khối (A): Tổng số proton và neutron trong hạt nhân của một nguyên tử, ký hiệu là \( A = Z + N \), với:
- \( Z \) là số proton.
- \( N \) là số neutron.
- Ký hiệu nguyên tử: Biểu diễn với số hiệu nguyên tử \( Z \) ở phía dưới và số khối \( A \) ở phía trên bên trái ký hiệu nguyên tố.
- Đồng vị: Các nguyên tử của cùng một nguyên tố có cùng số proton nhưng khác số neutron.
3. Cấu trúc lớp vỏ electron
Electron được phân bố trên các lớp và phân lớp khác nhau, mỗi lớp electron có mức năng lượng xác định:
| Lớp electron | Ký hiệu lớp | Phân lớp | Số orbital (AO) | Số electron tối đa |
|---|---|---|---|---|
| n = 1 | K | 1s | 1 | 2 |
| n = 2 | L | 2s, 2p | 4 | 8 |
| n = 3 | M | 3s, 3p, 3d | 9 | 18 |
| n = 4 | N | 4s, 4p, 4d, 4f | 16 | 32 |
4. Cấu hình electron của nguyên tử
Cấu hình electron biểu diễn sự phân bố electron trên các phân lớp và lớp khác nhau, tuân theo nguyên lý vững bền và quy tắc Hund:
- Nguyên lý vững bền: Electron chiếm các phân lớp có mức năng lượng thấp trước khi vào phân lớp có mức năng lượng cao hơn.
- Quy tắc Hund: Trong cùng một phân lớp, electron được phân bố sao cho số electron độc thân là tối đa.
5. Vai trò của cấu tạo nguyên tử trong hóa học
Cấu tạo nguyên tử giúp hiểu rõ bản chất của các nguyên tố hóa học, cách chúng liên kết với nhau để tạo ra các hợp chất và cơ chế của các phản ứng hóa học. Những kiến thức này là nền tảng để học sinh tiếp tục nghiên cứu các khái niệm phức tạp hơn trong hóa học.

.png)
1. Giới thiệu về cấu tạo nguyên tử
Nguyên tử là đơn vị cơ bản cấu thành nên mọi vật chất. Mỗi nguyên tử bao gồm ba thành phần chính: proton, neutron và electron. Proton và neutron tạo thành hạt nhân của nguyên tử, trong khi electron di chuyển xung quanh hạt nhân trong các quỹ đạo năng lượng xác định.
- Proton: Hạt mang điện tích dương \((+1)\), ký hiệu là \(p\), với khối lượng xấp xỉ \(1.6726 \times 10^{-27}\) kg.
- Neutron: Hạt không mang điện tích, ký hiệu là \(n\), với khối lượng xấp xỉ \(1.6749 \times 10^{-27}\) kg.
- Electron: Hạt mang điện tích âm \((-1)\), ký hiệu là \(e\), với khối lượng xấp xỉ \(9.1094 \times 10^{-31}\) kg. Electron di chuyển trong các quỹ đạo hoặc lớp vỏ nguyên tử.
Cấu tạo của nguyên tử giúp xác định các tính chất hóa học và vật lý của nguyên tố. Mỗi nguyên tử có số proton xác định trong hạt nhân gọi là số nguyên tử, quyết định loại nguyên tố. Số neutron có thể khác nhau, tạo ra các đồng vị khác nhau của một nguyên tố.
Electron được sắp xếp trong các quỹ đạo xung quanh hạt nhân theo nguyên lý năng lượng thấp nhất trước, tuân theo các nguyên lý như:
- Nguyên lý Aufbau: Electron chiếm các quỹ đạo có mức năng lượng thấp nhất trước.
- Nguyên lý Pauli: Mỗi quỹ đạo chỉ chứa tối đa hai electron với spin ngược nhau.
- Quy tắc Hund: Các electron sẽ chiếm các orbital trống trong cùng một phân lớp trước khi ghép đôi.
Hiểu biết về cấu tạo nguyên tử không chỉ giúp chúng ta hiểu rõ hơn về tính chất của các nguyên tố mà còn giúp áp dụng các khái niệm này trong nhiều lĩnh vực khác nhau như hóa học, vật lý, và công nghệ.
2. Thành phần cấu tạo của nguyên tử
Nguyên tử là đơn vị cơ bản cấu thành nên mọi chất. Mỗi nguyên tử bao gồm ba thành phần chính: proton, neutron và electron. Các thành phần này kết hợp với nhau để tạo nên cấu trúc của nguyên tử, giúp xác định tính chất hóa học của các nguyên tố.
- Proton: Là hạt mang điện tích dương, nằm trong hạt nhân của nguyên tử. Số lượng proton quyết định số thứ tự nguyên tố trong bảng tuần hoàn và tính chất hóa học cơ bản của nguyên tố đó. Khối lượng của một proton xấp xỉ \(1.6726 \times 10^{-27}\) kg.
- Neutron: Là hạt không mang điện tích, cũng nằm trong hạt nhân nguyên tử. Số lượng neutron có thể thay đổi trong các đồng vị của cùng một nguyên tố mà không ảnh hưởng đến tính chất hóa học của nguyên tố đó. Khối lượng của neutron gần bằng với khối lượng của proton.
- Electron: Là hạt mang điện tích âm, chuyển động xung quanh hạt nhân theo các quỹ đạo nhất định. Số lượng electron trong một nguyên tử bằng với số lượng proton, đảm bảo nguyên tử có điện tích trung hòa. Khối lượng của electron rất nhỏ, chỉ bằng khoảng \(9.109 \times 10^{-31}\) kg.
Các hạt này sắp xếp theo cách thức rất cụ thể để tạo nên sự ổn định cho nguyên tử. Hạt nhân nguyên tử bao gồm proton và neutron, trong khi electron chuyển động xung quanh hạt nhân theo các lớp vỏ điện tử. Sự tương tác giữa các hạt này tạo ra năng lượng và quyết định tính chất của nguyên tử.

3. Các loại hạt trong nguyên tử
Nguyên tử bao gồm ba loại hạt cơ bản: proton, neutron và electron. Mỗi loại hạt có đặc điểm riêng biệt và đóng vai trò quan trọng trong việc xác định cấu trúc và tính chất của nguyên tử.
- Proton: Là hạt mang điện tích dương (+). Proton nằm trong hạt nhân của nguyên tử và số lượng proton quyết định tính chất hóa học của nguyên tố. Khối lượng của proton xấp xỉ \(1.6726 \times 10^{-27}\) kg.
- Neutron: Là hạt không mang điện tích (trung hòa). Neutron cũng nằm trong hạt nhân nguyên tử cùng với proton. Số lượng neutron có thể thay đổi giữa các đồng vị của cùng một nguyên tố mà không ảnh hưởng đến tính chất hóa học của nguyên tố đó. Khối lượng của neutron gần bằng với proton, khoảng \(1.675 \times 10^{-27}\) kg.
- Electron: Là hạt mang điện tích âm (-). Electron di chuyển xung quanh hạt nhân theo các quỹ đạo hoặc lớp vỏ điện tử. Số lượng electron trong một nguyên tử bằng với số lượng proton, giúp nguyên tử trung hòa về điện. Khối lượng của electron rất nhỏ, chỉ bằng khoảng \(9.109 \times 10^{-31}\) kg.
Các hạt này tương tác với nhau thông qua các lực cơ bản của tự nhiên: lực điện từ và lực hạt nhân mạnh. Proton và neutron bị giữ chặt trong hạt nhân nhờ lực hạt nhân mạnh, trong khi electron bị hút về hạt nhân bởi lực điện từ. Sự kết hợp của ba loại hạt này tạo nên tính chất đa dạng và phong phú của các nguyên tử và các nguyên tố hóa học.
| Loại hạt | Điện tích | Khối lượng | Vị trí |
|---|---|---|---|
| Proton | +1 | \(1.6726 \times 10^{-27}\) kg | Hạt nhân |
| Neutron | 0 | \(1.675 \times 10^{-27}\) kg | Hạt nhân |
| Electron | -1 | \(9.109 \times 10^{-31}\) kg | Xung quanh hạt nhân |

XEM THÊM:
4. Kích thước và khối lượng của nguyên tử
Nguyên tử là đơn vị cơ bản của vật chất và có kích thước cực kỳ nhỏ. Mỗi nguyên tử bao gồm một hạt nhân nhỏ ở trung tâm và các electron quay xung quanh hạt nhân. Kích thước của một nguyên tử được xác định bởi bán kính của đám mây electron, thường nằm trong khoảng từ \(10^{-10}\) đến \(10^{-9}\) mét (tương đương với 0,1 đến 1 nanomet).
- Bán kính nguyên tử: Được đo bằng đơn vị Angstrom (\(1 \ \text{Å} = 10^{-10}\) mét). Bán kính nguyên tử thay đổi tùy thuộc vào loại nguyên tố và mức năng lượng của các electron trong nguyên tử.
- Khối lượng nguyên tử: Chủ yếu tập trung ở hạt nhân, do proton và neutron chiếm gần như toàn bộ khối lượng của nguyên tử. Khối lượng nguyên tử được đo bằng đơn vị khối lượng nguyên tử (u), với \(1 \ \text{u} = 1.66053906660 \times 10^{-27}\) kg. Ví dụ, khối lượng của một nguyên tử hydro (nguyên tố nhẹ nhất) xấp xỉ 1 u.
Mặc dù electron cũng có khối lượng, nhưng do khối lượng của electron rất nhỏ (khoảng \(9.109 \times 10^{-31}\) kg), nó không đáng kể so với khối lượng của proton và neutron. Do đó, khối lượng của một nguyên tử được xác định chủ yếu bởi tổng số proton và neutron trong hạt nhân.
| Đại lượng | Giá trị | Đơn vị |
|---|---|---|
| Bán kính nguyên tử | 0,1 - 1 | nanomet (nm) |
| Khối lượng nguyên tử | 1 - 238 | đơn vị khối lượng nguyên tử (u) |
Kích thước và khối lượng của nguyên tử rất quan trọng trong việc xác định tính chất hóa học và vật lý của các nguyên tố. Sự khác biệt về kích thước và khối lượng giữa các nguyên tử đóng vai trò quan trọng trong cấu trúc và phản ứng của các chất trong tự nhiên.

5. Nguyên tố hóa học và số khối
Mỗi nguyên tố hóa học được xác định bởi số lượng proton trong hạt nhân, được gọi là số nguyên tử (Z). Số nguyên tử đặc trưng cho một nguyên tố và quyết định vị trí của nó trong bảng tuần hoàn. Ví dụ, nguyên tố hydro có số nguyên tử Z = 1, nghĩa là hạt nhân của nó chứa 1 proton.
- Nguyên tố hóa học: Là những chất bao gồm các nguyên tử có cùng số proton trong hạt nhân. Mỗi nguyên tố có một ký hiệu hóa học riêng, chẳng hạn như H cho hydro, O cho oxy, và Fe cho sắt.
- Số khối (A): Là tổng số proton và neutron trong hạt nhân của một nguyên tử. Số khối được tính bằng công thức:
\[A = Z + N\]
trong đó:
- \(A\): Số khối
- \(Z\): Số nguyên tử (số proton)
- \(N\): Số neutron
Ví dụ, một nguyên tử carbon có 6 proton và 6 neutron sẽ có số khối:
\[
A = 6 + 6 = 12
\]
Do đó, số khối của nguyên tử carbon này là 12.
| Nguyên tố | Số nguyên tử (Z) | Số neutron (N) | Số khối (A) |
|---|---|---|---|
| Hydro (H) | 1 | 0 | 1 |
| Carbon (C) | 6 | 6 | 12 |
| Oxy (O) | 8 | 8 | 16 |
Số khối giúp xác định khối lượng nguyên tử và phân biệt giữa các đồng vị của cùng một nguyên tố. Đồng vị là những dạng khác nhau của cùng một nguyên tố, có cùng số proton nhưng khác nhau về số neutron. Ví dụ, carbon-12 và carbon-14 đều là đồng vị của nguyên tố carbon, nhưng chúng khác nhau về số neutron và do đó có số khối khác nhau.
6. Đồng vị và nguyên tử khối trung bình
Đồng vị là các dạng khác nhau của cùng một nguyên tố hóa học, có cùng số proton (Z) nhưng khác nhau về số neutron trong hạt nhân, dẫn đến sự khác biệt về số khối (A). Mặc dù đồng vị của một nguyên tố có tính chất hóa học giống nhau, chúng khác nhau về khối lượng nguyên tử.
- Đồng vị: Một nguyên tố có thể tồn tại ở nhiều đồng vị khác nhau. Ví dụ, nguyên tố carbon có hai đồng vị phổ biến:
- \(^{12}\text{C}\): Đồng vị có 6 proton và 6 neutron, với số khối là 12.
- \(^{14}\text{C}\): Đồng vị có 6 proton và 8 neutron, với số khối là 14.
- Nguyên tử khối trung bình: Là giá trị trung bình của khối lượng các đồng vị của một nguyên tố, được tính theo công thức: \[ \text{Nguyên tử khối trung bình} = \frac{\sum (\text{Nguyên tử khối} \times \text{Tỷ lệ phần trăm đồng vị})}{100} \]
Ví dụ, để tính nguyên tử khối trung bình của nguyên tố Cl (chlorine), với hai đồng vị:
\[
\text{Cl-35: } 75.77\% \, (\text{có khối lượng} = 34.969)
\]
\[
\text{Cl-37: } 24.23\% \, (\text{có khối lượng} = 36.966)
\]
Nguyên tử khối trung bình của Cl sẽ được tính như sau:
\[
\text{Nguyên tử khối trung bình} = \frac{34.969 \times 75.77 + 36.966 \times 24.23}{100} \approx 35.45
\]
| Nguyên tố | Đồng vị | Số khối (A) | Tỷ lệ phần trăm | Nguyên tử khối |
|---|---|---|---|---|
| Carbon (C) | \(^{12}\text{C}\) | 12 | 98.89% | 12.000 |
| Carbon (C) | \(^{14}\text{C}\) | 14 | 1.11% | 14.003 |
| Chlorine (Cl) | \(^{35}\text{Cl}\) | 35 | 75.77% | 34.969 |
| Chlorine (Cl) | \(^{37}\text{Cl}\) | 37 | 24.23% | 36.966 |
Nguyên tử khối trung bình giúp xác định khối lượng thực tế của các nguyên tố trong tự nhiên, phản ánh sự phân bố các đồng vị của chúng. Điều này rất quan trọng trong các tính toán hóa học và vật lý, đặc biệt là khi nghiên cứu về phản ứng hạt nhân hoặc phân tích khối lượng nguyên tố trong mẫu vật chất.
7. Cấu trúc lớp vỏ electron của nguyên tử
Lớp vỏ electron của nguyên tử đóng vai trò quan trọng trong việc quyết định tính chất hóa học của nguyên tố. Lớp vỏ này gồm các electron, được sắp xếp theo từng lớp và phân lớp xung quanh hạt nhân. Dưới đây là chi tiết về cấu trúc lớp vỏ electron:
7.1 Lớp và phân lớp electron
Electron trong nguyên tử được sắp xếp thành các lớp (shell) và phân lớp (subshell). Mỗi lớp electron được ký hiệu bằng các chữ cái K, L, M, N,... tương ứng với các mức năng lượng từ thấp đến cao. Mỗi lớp này lại chia thành các phân lớp với các loại quỹ đạo khác nhau:
- Lớp K: chỉ có một phân lớp s.
- Lớp L: có hai phân lớp là s và p.
- Lớp M: có ba phân lớp là s, p, và d.
- Lớp N: có bốn phân lớp là s, p, d, và f.
Mỗi phân lớp chứa một số lượng nhất định các electron:
| Phân lớp | Số electron tối đa |
|---|---|
| s | 2 |
| p | 6 |
| d | 10 |
| f | 14 |
7.2 Quy luật sắp xếp electron
Quy luật sắp xếp electron trong nguyên tử tuân theo hai nguyên tắc chính:
- Nguyên lý vững bền (Aufbau principle): Electron sẽ điền vào các mức năng lượng thấp trước rồi mới đến mức năng lượng cao. Thứ tự điền electron có thể theo sơ đồ sau: \[ 1s \rightarrow 2s \rightarrow 2p \rightarrow 3s \rightarrow 3p \rightarrow 4s \rightarrow 3d \rightarrow 4p \rightarrow 5s \rightarrow 4d \rightarrow 5p \rightarrow 6s \rightarrow 4f \rightarrow 5d \rightarrow 6p \rightarrow 7s \ldots \]
- Nguyên lý Pauli (Pauli exclusion principle): Mỗi obitan chỉ chứa tối đa hai electron, và hai electron này phải có spin ngược nhau.
- Quy tắc Hund: Electron sẽ điền đơn vào từng obitan trong cùng một phân lớp trước khi điền cặp.
Quy luật này giúp xác định cấu hình electron của nguyên tử, từ đó hiểu được tính chất hóa học của nó.

8. Tính chất của các hạt trong nguyên tử
Nguyên tử được cấu tạo từ ba loại hạt cơ bản: proton, neutron và electron. Mỗi loại hạt này có các tính chất vật lý và hóa học đặc trưng, đóng vai trò quan trọng trong việc xác định cấu trúc và tính chất của nguyên tử. Dưới đây là các tính chất chính của từng loại hạt:
- Proton (\(p^+\)):
- Proton là hạt mang điện tích dương, với điện tích bằng \(+1\) đơn vị điện tích cơ bản (\(e\)).
- Khối lượng của proton xấp xỉ \(1.6726 \times 10^{-27}\) kg, tương đương với \(1\) đơn vị khối lượng nguyên tử (amu).
- Proton nằm trong hạt nhân nguyên tử và đóng vai trò quyết định số thứ tự nguyên tử (số proton = số nguyên tử).
- Neutron (\(n^0\)):
- Neutron là hạt không mang điện tích, với điện tích bằng \(0\).
- Khối lượng của neutron xấp xỉ \(1.6750 \times 10^{-27}\) kg, gần bằng khối lượng của proton và cũng được xem là \(1\) amu.
- Neutron cũng nằm trong hạt nhân nguyên tử và có vai trò giữ cân bằng lực giữa các proton, giúp duy trì sự ổn định của hạt nhân.
- Electron (\(e^-\)):
- Electron là hạt mang điện tích âm, với điện tích bằng \(-1\) đơn vị điện tích cơ bản (\(-e\)).
- Khối lượng của electron xấp xỉ \(9.1094 \times 10^{-31}\) kg, nhẹ hơn proton và neutron khoảng \(1836\) lần.
- Electron chuyển động xung quanh hạt nhân trong các đám mây điện tử và xác định tính chất hóa học của nguyên tử thông qua cấu hình electron.
Tóm lại, proton và neutron nằm trong hạt nhân và chiếm phần lớn khối lượng của nguyên tử, trong khi electron chuyển động xung quanh hạt nhân trong các mức năng lượng khác nhau. Sự tương tác giữa các hạt này quyết định cấu trúc nguyên tử cũng như tính chất hóa học và vật lý của các nguyên tố.
| Loại Hạt | Ký Hiệu | Điện Tích | Khối Lượng (kg) |
|---|---|---|---|
| Proton | \(p^+\) | +1 | \(1.6726 \times 10^{-27}\) |
| Neutron | \(n^0\) | 0 | \(1.6750 \times 10^{-27}\) |
| Electron | \(e^-\) | -1 | \(9.1094 \times 10^{-31}\) |
Các hạt này tương tác với nhau thông qua các lực cơ bản như lực điện từ, lực hạt nhân mạnh, và lực hạt nhân yếu, để tạo nên cấu trúc nguyên tử ổn định.
9. Bài tập và ôn tập chương 1
Chương 1 về cấu tạo nguyên tử là nền tảng quan trọng trong hóa học, giúp học sinh hiểu rõ hơn về các khái niệm cơ bản như proton, neutron, electron và cấu trúc của nguyên tử. Dưới đây là một số bài tập và hướng dẫn ôn tập giúp củng cố kiến thức.
9.1. Bài tập lý thuyết
- Hãy mô tả cấu tạo của một nguyên tử. Nguyên tử bao gồm những hạt nào và vị trí của chúng trong nguyên tử ra sao?
- Trình bày khái niệm số khối (\(A\)) và số hiệu nguyên tử (\(Z\)). Chúng có ý nghĩa gì trong việc xác định cấu trúc của một nguyên tử?
- Nêu định nghĩa của ion. Phân biệt giữa cation và anion.
- Làm thế nào để xác định số proton, neutron và electron của một nguyên tử dựa trên ký hiệu hóa học của nó?
9.2. Bài tập tính toán
- Một nguyên tử có số hiệu nguyên tử \(Z = 17\) và số khối \(A = 35\). Tính số proton, neutron và electron của nguyên tử đó.
- Cho biết một nguyên tử có 15 proton và 16 neutron. Hãy xác định số khối của nguyên tử này và ký hiệu hóa học của nó.
- Một ion \(\text{Na}^+\) có số hiệu nguyên tử \(Z = 11\). Hãy tính số proton, neutron và electron trong ion này, biết số khối của nó là \(A = 23\).
9.3. Ôn tập
Để ôn tập chương 1 một cách hiệu quả, học sinh nên tuân theo các bước sau:
- Đọc kỹ lại lý thuyết trong sách giáo khoa, đặc biệt chú ý đến các khái niệm quan trọng như cấu trúc nguyên tử, số khối và số hiệu nguyên tử.
- Thực hành giải các bài tập từ cơ bản đến nâng cao để nắm vững cách tính toán và vận dụng lý thuyết vào thực tế.
- Ôn lại các định luật cơ bản liên quan đến cấu tạo nguyên tử, ví dụ như định luật bảo toàn khối lượng và định luật bảo toàn điện tích.
- Sử dụng các công cụ trực quan như mô hình 3D, hình ảnh minh họa để dễ dàng hình dung cấu trúc của nguyên tử và các thành phần của nó.
9.4. Bài tập mẫu
Dưới đây là một số bài tập mẫu giúp học sinh làm quen với các dạng bài tập liên quan đến cấu tạo nguyên tử:
| Câu hỏi | Đáp án |
|---|---|
| Một nguyên tử \(X\) có số khối \(A = 40\) và số hiệu nguyên tử \(Z = 20\). Tính số neutron trong nguyên tử \(X\). | Số neutron = \(A - Z = 40 - 20 = 20\) |
| Nguyên tử nào có 26 proton, 30 neutron và 26 electron? Xác định ký hiệu hóa học của nguyên tử này. | Đó là nguyên tử Fe với số khối \(A = 56\). |
| Một ion \(\text{Cl}^-\) có số hiệu nguyên tử là \(Z = 17\). Tính số proton, neutron và electron của ion này, biết số khối là \(A = 35\). | Số proton = 17, số neutron = 18, số electron = 18 |
Việc ôn tập kỹ lưỡng và thực hành nhiều dạng bài tập khác nhau sẽ giúp học sinh nắm vững cấu trúc và tính chất của nguyên tử, làm nền tảng cho các chương học tiếp theo trong hóa học.

10. Tài liệu và phương pháp học tập
Để nắm vững kiến thức về cấu tạo nguyên tử, học sinh và sinh viên cần sử dụng các tài liệu phù hợp và áp dụng các phương pháp học tập hiệu quả. Dưới đây là một số gợi ý:
- Sách giáo khoa và tài liệu tham khảo:
- Sách giáo khoa Hóa học lớp 10: Cung cấp kiến thức cơ bản về cấu tạo nguyên tử, giúp học sinh hiểu rõ các khái niệm cơ bản.
- Các sách tham khảo: Sách chuyên sâu như "Cấu tạo nguyên tử và liên kết hóa học" giúp mở rộng kiến thức và cung cấp các bài tập ứng dụng.
- Tài liệu trực tuyến:
- Bài giảng điện tử: Các trang web giáo dục như hocmai.vn, violet.vn cung cấp bài giảng video và tài liệu tham khảo chất lượng.
- Tài liệu PDF: Tải xuống các tài liệu học tập từ các trang web giáo dục, diễn đàn học tập, hoặc thư viện trực tuyến.
- Phương pháp học tập:
- Học qua ví dụ: Sử dụng ví dụ thực tế để liên kết kiến thức về cấu tạo nguyên tử với các hiện tượng trong đời sống.
- Ôn tập qua bài tập: Thực hành giải bài tập đa dạng từ cơ bản đến nâng cao để củng cố kiến thức.
- Thảo luận nhóm: Học theo nhóm để trao đổi ý kiến, giải đáp thắc mắc và chia sẻ kinh nghiệm học tập.
- Áp dụng công thức toán học: Sử dụng MathJax để biểu diễn các công thức liên quan đến cấu tạo nguyên tử: \[ N = Z + N \] Trong đó, \( N \) là số khối, \( Z \) là số proton, và \( N \) là số neutron.
Việc kết hợp tài liệu đa dạng và phương pháp học tập phù hợp sẽ giúp học sinh nắm vững kiến thức về cấu tạo nguyên tử một cách hiệu quả, chuẩn bị tốt cho các kỳ thi và ứng dụng trong thực tiễn.
| Tài liệu | Mô tả | Ưu điểm |
|---|---|---|
| Sách giáo khoa | Cung cấp kiến thức cơ bản và bài tập theo chương trình học. | Phù hợp với mọi đối tượng học sinh. |
| Tài liệu trực tuyến | Bài giảng video, tài liệu PDF từ các trang web giáo dục. | Linh hoạt, dễ dàng tiếp cận và cập nhật. |
| Thảo luận nhóm | Học tập qua trao đổi ý kiến và giải đáp thắc mắc. | Khuyến khích tương tác và sự hiểu biết sâu rộng. |