Chủ đề cấu tạo nguyên tử oxi: Cấu tạo nguyên tử oxi không chỉ đơn giản là các hạt proton, neutron và electron. Khám phá chi tiết về nguyên tử này giúp chúng ta hiểu rõ hơn về tính chất hóa học, cấu hình electron và vai trò quan trọng của oxi trong các phản ứng hóa học, ứng dụng trong đời sống và công nghiệp hiện đại.
Mục lục
- Cấu Tạo Nguyên Tử Oxi: Khám Phá Chi Tiết
- 1. Giới thiệu về nguyên tử Oxi
- 2. Cấu tạo nguyên tử Oxi
- 3. Các mô hình nguyên tử Oxi
- 4. Tính chất vật lý và hóa học của Oxi
- 5. Vai trò của Oxi trong các phản ứng hóa học
- 6. Ứng dụng của Oxi trong đời sống và công nghiệp
- 7. Tác động của Oxi đến môi trường và sự sống
- 8. Kết luận
Cấu Tạo Nguyên Tử Oxi: Khám Phá Chi Tiết
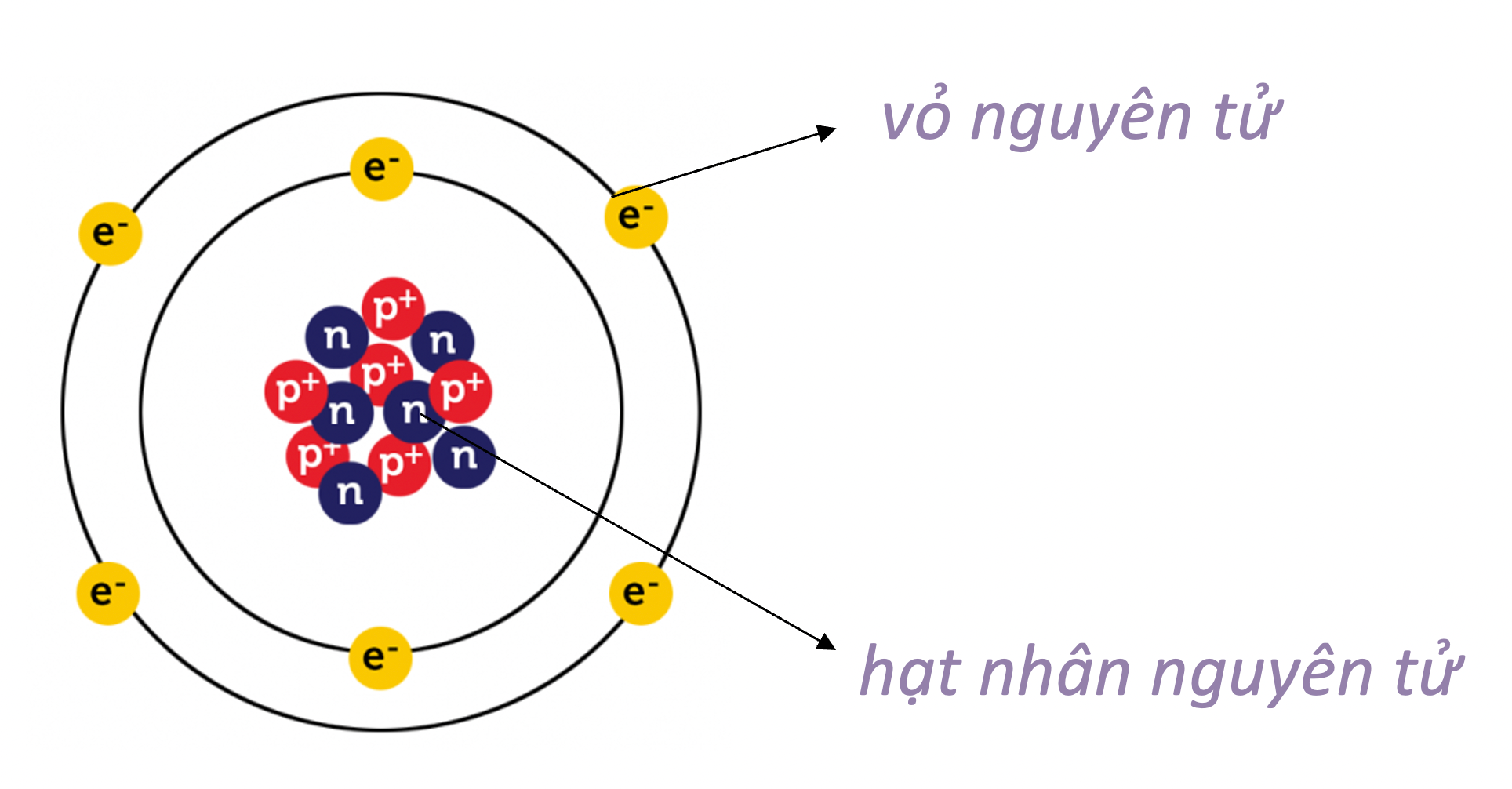
Nguyên tử oxi là một nguyên tố quan trọng trong hóa học, và việc hiểu rõ cấu trúc cũng như tính chất của nó là rất cần thiết. Nguyên tử oxi (ký hiệu hóa học: O) có số hiệu nguyên tử là 8, nghĩa là trong hạt nhân của nó có 8 proton. Đây là nguyên tố phổ biến thứ ba trong vũ trụ và là một thành phần thiết yếu của sự sống trên Trái Đất.
Cấu tạo của Nguyên Tử Oxi
Nguyên tử oxi bao gồm ba loại hạt cơ bản: proton, neutron và electron.
- Proton: Mỗi nguyên tử oxi có 8 proton nằm trong hạt nhân, mang điện tích dương.
- Neutron: Nguyên tử oxi cũng có 8 neutron không mang điện tích, nằm trong hạt nhân và giúp ổn định cấu trúc hạt nhân.
- Electron: Có 8 electron quay xung quanh hạt nhân trong các lớp vỏ electron, mang điện tích âm.
Cấu hình Electron của Nguyên Tử Oxi
Cấu hình electron của nguyên tử oxi là \(1s^2 2s^2 2p^4\). Điều này có nghĩa là nguyên tử oxi có:
- 2 electron trong phân lớp \(1s\).
- 2 electron trong phân lớp \(2s\).
- 4 electron trong phân lớp \(2p\).
Nguyên tử oxi có hai lớp electron, trong đó lớp 1 chứa 2 electron và lớp 2 chứa 6 electron. Cấu hình này giúp xác định vị trí của oxi trong bảng tuần hoàn, nằm ở ô thứ 8, chu kỳ 2, nhóm VIA.
Liên Kết Hóa Học và Công Thức Phân Tử Oxi
Oxi thường tồn tại ở dạng phân tử \(O_2\), gồm hai nguyên tử oxi liên kết với nhau bằng một liên kết đôi. Mỗi nguyên tử oxi cần thêm 2 electron để đạt được cấu hình bền vững như khí hiếm. Do đó, chúng chia sẻ electron với nhau, tạo ra một phân tử với công thức cấu tạo là \(O=O\).
Tính Chất Vật Lý và Hóa Học của Oxi
| Tính chất | Giá trị |
| Khối lượng nguyên tử | 16 amu |
| Độ âm điện | 3.44 (thang Pauling) |
| Nhiệt độ sôi | -183°C |
| Nhiệt độ nóng chảy | -218.79°C |
| Màu sắc | Không màu |
Các Phản Ứng Hóa Học Phổ Biến Của Oxi
- Tác dụng với hydro: \(2H_2 + O_2 → 2H_2O\).
- Tạo oxit với các kim loại: \(4Na + O_2 → 2Na_2O\).
- Phản ứng với hợp chất hữu cơ: \(C_6H_{12}O_6 + 6O_2 → 6CO_2 + 6H_2O\).
Ứng Dụng Của Oxi Trong Đời Sống và Công Nghiệp
Oxi (\(O_2\)) có vai trò quan trọng trong nhiều lĩnh vực, bao gồm y tế, công nghiệp, và khoa học môi trường. Trong y tế, oxi được sử dụng để hỗ trợ hô hấp cho bệnh nhân trong các tình huống cấp cứu. Trong công nghiệp, oxi được sử dụng để đốt cháy nhiên liệu và trong các quá trình sản xuất hóa chất.
.png)
1. Giới thiệu về nguyên tử Oxi
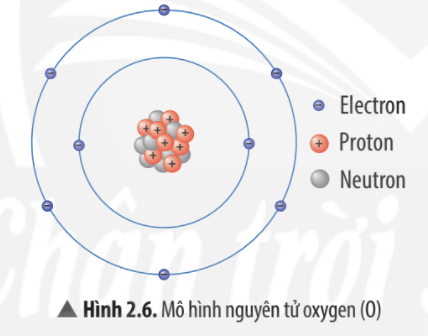
Nguyên tử oxi là một trong những nguyên tố quan trọng trong bảng tuần hoàn, với số hiệu nguyên tử là 8. Điều này có nghĩa là oxi có 8 proton trong hạt nhân và 8 electron xung quanh hạt nhân. Các electron này được phân bố trong hai lớp: lớp thứ nhất chứa 2 electron, lớp thứ hai chứa 6 electron (2 ở phân lớp 2s và 4 ở phân lớp 2p). Cấu hình electron của nguyên tử oxi là \(1s^2 2s^2 2p^4\).
Với cấu hình electron này, nguyên tử oxi có xu hướng nhận thêm 2 electron để đạt cấu hình bền vững giống như khí hiếm (neon). Do đó, oxi là một chất oxy hóa mạnh và dễ dàng tham gia vào các phản ứng hóa học với nhiều nguyên tố khác, đặc biệt là để tạo thành oxit.
Nguyên tử oxi liên kết với nhau bằng liên kết đôi để tạo thành phân tử \(O_2\). Liên kết này được biểu diễn bằng công thức cấu tạo \(O=O\), cho phép mỗi nguyên tử oxi hoàn thiện lớp vỏ electron ngoài cùng. Liên kết đôi này làm cho phân tử \(O_2\) trở nên ổn định trong điều kiện tự nhiên.
| Tính chất vật lý của oxi | Giá trị |
|---|---|
| Khối lượng nguyên tử | 16 amu |
| Độ âm điện | 3.44 |
| Nhiệt độ sôi | -183°C |
| Nhiệt độ nóng chảy | -218.79°C |
| Màu sắc | Không màu |
Nguyên tử oxi có đặc tính phi kim hoạt động mạnh và có thể tạo ra các hợp chất oxit với hầu hết các nguyên tố khác. Oxi đóng vai trò quan trọng trong nhiều quá trình hóa học, sinh học, và công nghiệp, và là một phần không thể thiếu của sự sống trên Trái Đất.
2. Cấu tạo nguyên tử Oxi
Nguyên tử oxi có số hiệu nguyên tử là 8, nghĩa là nó chứa 8 proton trong hạt nhân và 8 electron bao quanh hạt nhân. Các electron của oxi được phân bố trong hai lớp:
- Lớp thứ nhất: Chứa 2 electron trong phân lớp 1s.
- Lớp thứ hai: Chứa 6 electron, trong đó có 2 electron ở phân lớp 2s và 4 electron ở phân lớp 2p.
Cấu hình electron của nguyên tử oxi được viết là:
\[1s^2 \, 2s^2 \, 2p^4\]
Cấu trúc phân tử của Oxi (O2)
Phân tử oxi (O2) được tạo thành từ hai nguyên tử oxi liên kết với nhau bằng một liên kết đôi. Điều này xảy ra vì mỗi nguyên tử oxi cần thêm 2 electron để đạt được cấu hình bền vững như khí hiếm, do đó chúng chia sẻ electron với nhau để tạo thành một phân tử với công thức cấu tạo là:
\[O = O\]
Tính chất hóa học của Oxi
Oxi là một phi kim hoạt động mạnh và có khả năng phản ứng với hầu hết các nguyên tố khác để tạo thành các oxit. Một số phản ứng hóa học phổ biến của oxi bao gồm:
- Phản ứng với hydro: \[2H_2 + O_2 → 2H_2O\]
- Tạo oxit với kim loại: \[4Na + O_2 → 2Na_2O\]
- Phản ứng với hợp chất hữu cơ: \[C_6H_{12}O_6 + 6O_2 → 6CO_2 + 6H_2O\]
Tính chất vật lý của Oxi
| Khối lượng nguyên tử | 16 amu |
| Độ âm điện | 3.44 |
| Nhiệt độ sôi | -183°C |
| Nhiệt độ nóng chảy | -218.79°C |
| Màu sắc | Không màu |
Cấu trúc nguyên tử và phân tử của oxi đóng vai trò quan trọng trong việc quyết định tính chất hóa học và vật lý của nó, từ đó ảnh hưởng đến các ứng dụng trong cuộc sống và công nghiệp.

3. Các mô hình nguyên tử Oxi
Mô hình nguyên tử đã phát triển qua nhiều giai đoạn, giúp chúng ta hiểu rõ hơn về cấu trúc và tính chất của nguyên tử oxi. Dưới đây là những mô hình lịch sử quan trọng trong việc miêu tả cấu trúc của nguyên tử:
-
Mô hình nguyên tử của Dalton
John Dalton đã đưa ra lý thuyết hiện đại đầu tiên về nguyên tử vào đầu thế kỷ 19. Theo ông, nguyên tử là các hạt nhỏ không thể chia cắt, là thành phần cơ bản của mọi chất.
- Nguyên tử của cùng một nguyên tố có khối lượng và tính chất giống nhau.
- Phản ứng hóa học là sự sắp xếp lại các nguyên tử.
-
Mô hình "bánh bèo" của Thomson
Năm 1897, J.J. Thomson đề xuất mô hình "bánh bèo" (plum pudding model) sau khi phát hiện ra electron. Theo mô hình này, nguyên tử là một khối cầu tích điện dương với các electron tích điện âm phân bố đều bên trong.
- Giải thích sự tồn tại của electron trong nguyên tử.
- Không giải thích được cấu trúc chi tiết của nguyên tử.
-
Mô hình hạt nhân của Rutherford
Năm 1911, Ernest Rutherford phát hiện ra hạt nhân nguyên tử thông qua thí nghiệm bắn hạt alpha vào lá vàng mỏng. Ông nhận thấy nguyên tử có một hạt nhân rất nhỏ, tích điện dương ở trung tâm, và các electron chuyển động xung quanh.
- Phát hiện ra hạt nhân nguyên tử.
- Nguyên tử phần lớn là không gian trống.
-
Mô hình nguyên tử Bohr
Năm 1913, Niels Bohr phát triển mô hình nguyên tử dựa trên lý thuyết lượng tử. Theo đó, electron chuyển động trên các quỹ đạo xác định quanh hạt nhân và chỉ có thể tồn tại ở các mức năng lượng nhất định.
- Giải thích quang phổ của nguyên tử hydrogen.
- Đưa ra khái niệm về các mức năng lượng lượng tử.
-
Mô hình cơ học lượng tử
Mô hình hiện đại nhất là mô hình cơ học lượng tử, phát triển vào những năm 1920. Theo mô hình này, các electron không chuyển động trên các quỹ đạo cố định mà tồn tại trong các vùng không gian gọi là orbital.
- Electron có tính chất sóng-hạt kép.
- Các orbital có hình dạng và năng lượng khác nhau.
Mỗi mô hình này đã đóng góp quan trọng vào sự hiểu biết ngày càng sâu sắc hơn về cấu trúc và tính chất của nguyên tử oxi và các nguyên tố hóa học khác, đồng thời ứng dụng trong nhiều lĩnh vực khoa học và công nghệ.

XEM THÊM:
4. Tính chất vật lý và hóa học của Oxi
Oxi (O2) là nguyên tố hóa học phổ biến trong tự nhiên, có nhiều tính chất vật lý và hóa học quan trọng. Dưới đây là chi tiết về các tính chất này:
Tính chất vật lý của Oxi
- Màu sắc và trạng thái: Oxi là chất khí không màu, không mùi, không vị ở điều kiện bình thường. Khi hóa lỏng, oxi có màu xanh nhạt.
- Trọng lượng: Khí oxi nặng hơn không khí với tỷ trọng \(\frac{32}{29}\).
- Nhiệt độ hóa lỏng: Oxi hóa lỏng ở -183°C và hóa rắn ở -218.79°C dưới áp suất khí quyển.
- Tính tan: Oxi tan kém trong nước; ở 20°C, chỉ có 30,8 mL oxi hòa tan trong 1 lít nước.
Tính chất hóa học của Oxi
Oxi là một phi kim hoạt động mạnh và có tính oxi hóa cao. Độ âm điện của oxi là 3.44, chỉ đứng sau flo (3.98). Dưới đây là các tính chất hóa học nổi bật của oxi:
- Tác dụng với kim loại: Oxi phản ứng với hầu hết các kim loại, tạo ra oxit kim loại. Ví dụ:
- \(4Fe + 3O_{2} \rightarrow 2Fe_{2}O_{3}\)
- \(4Al + 3O_{2} \rightarrow 2Al_{2}O_{3}\)
- Tác dụng với phi kim: Oxi tác dụng với nhiều phi kim tạo thành oxit phi kim, trừ các nguyên tố halogen. Ví dụ:
- \(C + O_{2} \rightarrow CO_{2}\)
- \(S + O_{2} \rightarrow SO_{2}\)
- Tác dụng với hợp chất: Oxi cũng phản ứng với nhiều hợp chất hữu cơ và vô cơ, tạo ra các sản phẩm mới. Ví dụ:
- \(2H_{2} + O_{2} \rightarrow 2H_{2}O\)
- \(CH_{4} + 2O_{2} \rightarrow CO_{2} + 2H_{2}O\)
- Phản ứng oxi hóa - khử: Trong các phản ứng oxi hóa - khử, oxi đóng vai trò là chất oxi hóa, nhận electron từ các chất khác.
Oxi là một trong những nguyên tố quan trọng nhất trong tự nhiên, đóng vai trò thiết yếu trong quá trình hô hấp của sinh vật và trong nhiều quá trình hóa học công nghiệp khác.

5. Vai trò của Oxi trong các phản ứng hóa học
Oxi đóng vai trò quan trọng trong nhiều phản ứng hóa học, đặc biệt là trong các phản ứng cháy, phản ứng oxi hóa-khử, và các phản ứng hóa học khác. Dưới đây là một số vai trò chính của oxi trong các phản ứng hóa học:
- Phản ứng cháy: Oxi là yếu tố không thể thiếu trong quá trình đốt cháy. Nó kết hợp với các chất cháy để tạo ra năng lượng và các sản phẩm phụ như \(CO_2\) và \(H_2O\). Ví dụ: phản ứng giữa metan và oxi: \[ CH_4 + 2O_2 \rightarrow CO_2 + 2H_2O \]
- Phản ứng với kim loại: Oxi tác dụng mạnh với nhiều kim loại để tạo ra oxit kim loại. Ví dụ, khi phản ứng với magie, sẽ tạo thành magie oxit: \[ 2Mg + O_2 \rightarrow 2MgO \] Các phản ứng tương tự xảy ra với sắt, nhôm, và các kim loại khác, tạo ra các oxit tương ứng.
- Phản ứng với phi kim: Oxi cũng tác dụng với phi kim để tạo ra các oxit phi kim. Ví dụ, lưu huỳnh kết hợp với oxi tạo ra lưu huỳnh dioxit: \[ S + O_2 \rightarrow SO_2 \] Hoặc phospho tác dụng với oxi tạo ra phospho pentoxit: \[ 4P + 5O_2 \rightarrow 2P_2O_5 \]
- Phản ứng oxi hóa - khử: Oxi thường tham gia vào các phản ứng oxi hóa - khử, nơi nó đóng vai trò như một chất oxi hóa. Ví dụ, phản ứng giữa glucozo và kali nitrat: \[ KNO_3 + C_6H_{12}O_6 \rightarrow 3CO_2 + 3H_2O + 6N_2 + 6KOH \] Trong phản ứng này, oxi đóng vai trò là chất oxi hóa, tạo ra các sản phẩm khác nhau.
- Ứng dụng trong công nghiệp và đời sống: Oxi được sử dụng rộng rãi trong công nghiệp như một chất oxi hóa để tổng hợp các hóa chất, sản xuất thép, và làm chất hỗ trợ hô hấp trong y học. Trong đời sống, oxi là thành phần quan trọng để duy trì sự sống của con người và các sinh vật khác.
Những ví dụ trên cho thấy vai trò đa dạng và quan trọng của oxi trong nhiều loại phản ứng hóa học, từ công nghiệp đến đời sống hàng ngày.
6. Ứng dụng của Oxi trong đời sống và công nghiệp
Oxi là một nguyên tố hóa học cực kỳ quan trọng và có nhiều ứng dụng thiết yếu trong đời sống hàng ngày cũng như trong nhiều ngành công nghiệp khác nhau. Dưới đây là các ứng dụng chính của oxi trong cả hai lĩnh vực:
- Ứng dụng trong y học: Oxi được sử dụng rộng rãi trong y học để hỗ trợ hô hấp. Các bệnh viện thường sử dụng bình oxi để cung cấp khí cho bệnh nhân gặp khó khăn về hô hấp hoặc những người cần trợ thở.
- Ứng dụng trong hàng không và thám hiểm vũ trụ: Khí oxi được nén trong các bình chứa để cung cấp khí thở cho phi công, thợ lặn, và cả các phi hành gia trong vũ trụ. Oxi lỏng cũng được sử dụng làm chất oxi hóa trong động cơ tên lửa.
- Ứng dụng trong công nghiệp hóa chất: Oxi được sử dụng để sản xuất các hợp chất hóa học như ethylene oxit, methanol, và amoniac. Ngoài ra, nó còn được sử dụng trong quá trình oxy hóa để tạo ra nhiều loại sản phẩm khác nhau.
- Ứng dụng trong công nghiệp luyện kim: Oxi được sử dụng trong quá trình luyện thép và các kim loại khác để đốt cháy các tạp chất, giúp tăng cường chất lượng sản phẩm và nâng cao hiệu suất sản xuất. Oxi cung cấp nhiệt độ cao cần thiết cho quá trình này, nhờ vào phản ứng cháy với các nhiên liệu.
- Ứng dụng trong ngành năng lượng: Oxi được sử dụng trong các phản ứng oxi hóa-khử để tạo ra năng lượng. Ví dụ, trong các nhà máy điện, oxi tham gia vào quá trình đốt cháy nhiên liệu để sản xuất điện.
- Ứng dụng trong xử lý nước và khử trùng: Oxi được sử dụng để xử lý nước thải và làm sạch môi trường. Oxi cũng được dùng làm chất khử trùng để tiêu diệt vi khuẩn và các vi sinh vật có hại, đảm bảo nước sạch và an toàn cho con người.
- Ứng dụng trong công nghệ thực phẩm: Oxi được sử dụng để bảo quản thực phẩm, nhất là trong việc đóng gói khí quyển điều chỉnh, giúp kéo dài thời gian bảo quản và giữ nguyên chất lượng thực phẩm.
- Ứng dụng trong chế tạo chất nổ: Hỗn hợp oxi lỏng và bột than có thể được sử dụng làm chất nổ trong các ngành công nghiệp khai thác mỏ và xây dựng, mang lại hiệu quả cao trong việc phá vỡ đá và khai thác khoáng sản.
Nhờ vào những ứng dụng đa dạng và quan trọng trong cả đời sống và công nghiệp, oxi không chỉ là một thành phần thiết yếu để duy trì sự sống mà còn là một chất hóa học quan trọng giúp thúc đẩy phát triển trong nhiều lĩnh vực khác nhau.

7. Tác động của Oxi đến môi trường và sự sống
Oxi đóng vai trò vô cùng quan trọng trong việc duy trì sự sống và cân bằng môi trường trên Trái Đất. Từ quá trình quang hợp của thực vật đến các phản ứng sinh học trong cơ thể con người và động vật, Oxi luôn hiện diện như một yếu tố cốt lõi giúp duy trì sự sống.
7.1. Oxi và sự duy trì sự sống
- Vai trò trong quá trình hô hấp: Oxi là yếu tố không thể thiếu cho quá trình hô hấp của con người và động vật. Thông qua việc cung cấp Oxi cho tế bào, quá trình chuyển hóa năng lượng từ thức ăn diễn ra hiệu quả hơn, giúp cơ thể duy trì hoạt động sống hàng ngày.
- Quang hợp: Oxi được sản sinh từ quá trình quang hợp của thực vật. Thực vật hấp thụ khí CO2 và nước, dưới tác động của ánh sáng mặt trời, chúng sản xuất Oxi, góp phần duy trì sự cân bằng của khí quyển và hỗ trợ quá trình sống của các loài sinh vật.
- Chuỗi thức ăn: Oxi có vai trò trong việc duy trì các mắt xích trong chuỗi thức ăn. Từ các vi sinh vật cho đến các động vật bậc cao hơn, Oxi giúp hỗ trợ các quá trình sinh học và đảm bảo sự cân bằng trong hệ sinh thái.
7.2. Oxi và môi trường
- Xử lý môi trường: Oxi là một chất oxi hóa mạnh, được sử dụng trong các quy trình xử lý nước thải và khí thải. Sự hiện diện của Oxi giúp phân hủy các chất ô nhiễm, chuyển chúng thành các dạng ít độc hại hơn, từ đó làm sạch môi trường.
- Ảnh hưởng đến hệ sinh thái: Sự thiếu hụt Oxi trong các hệ sinh thái như ao hồ, đại dương có thể dẫn đến hiện tượng "thiếu Oxi", gây chết hàng loạt sinh vật thủy sinh. Do đó, duy trì mức độ Oxi ổn định trong môi trường nước là yếu tố quan trọng để bảo vệ hệ sinh thái.
7.3. Tác động tích cực của Oxi trong tự nhiên
- Chống ô nhiễm không khí: Oxi tự nhiên trong không khí giúp phân hủy và loại bỏ các chất độc hại, như các hợp chất hữu cơ dễ bay hơi và các chất khí gây ô nhiễm.
- Bảo vệ tầng ozone: Mặc dù Oxi dạng phân tử (O2) không trực tiếp tham gia vào việc bảo vệ tầng ozone, nhưng nó là nguồn gốc tạo thành O3 (ozone), chất này giúp bảo vệ Trái Đất khỏi tia cực tím có hại từ Mặt Trời.
7.4. Oxi và các quá trình sinh học
- Phản ứng cháy: Oxi là tác nhân chính trong các phản ứng cháy, không chỉ trong các hoạt động tự nhiên mà còn trong các quy trình công nghiệp, từ việc đốt cháy nhiên liệu đến quá trình sản xuất năng lượng.
- Phản ứng oxi hóa-khử: Oxi tham gia vào các phản ứng oxi hóa-khử, đóng vai trò quan trọng trong các quá trình chuyển hóa sinh học, giúp điều chỉnh năng lượng trong các tế bào sống.

8. Kết luận
Nguyên tử Oxi đóng vai trò quan trọng không chỉ trong các phản ứng hóa học mà còn trong cuộc sống hàng ngày của con người và toàn bộ sinh vật trên Trái Đất. Với vai trò là một thành phần thiết yếu trong không khí, oxi duy trì sự sống thông qua quá trình hô hấp, đồng thời tham gia tích cực trong các phản ứng hóa học, đặc biệt là quá trình oxy hóa và đốt cháy.
Cấu tạo của nguyên tử oxi, với hạt nhân chứa 8 proton và 8 neutron cùng với 8 electron quay quanh các mức năng lượng, là tiền đề cho nhiều tính chất hóa học quan trọng của nó. Sự phân bố của các electron trong các phân lớp xác định cũng giải thích lý do tại sao oxi có khả năng tạo liên kết hóa học mạnh và phản ứng dễ dàng với nhiều nguyên tố khác.
Oxi không chỉ là nguồn cung cấp năng lượng cho quá trình hô hấp của con người và động vật, mà còn là yếu tố chính trong các ngành công nghiệp quan trọng như luyện kim, sản xuất thép và hóa chất. Bên cạnh đó, vai trò của oxi trong y tế, đặc biệt trong hỗ trợ hô hấp và cấp cứu, cũng không thể thiếu.
Nhìn chung, sự hiểu biết về cấu tạo và tính chất của nguyên tử oxi không chỉ giúp chúng ta hiểu rõ hơn về vai trò của nguyên tố này trong khoa học mà còn mở ra nhiều hướng nghiên cứu và ứng dụng mới trong tương lai, từ việc bảo vệ môi trường đến việc phát triển các công nghệ năng lượng xanh.