Chủ đề cho mô hình cấu tạo nguyên tử aluminium: Bài viết này sẽ giúp bạn khám phá chi tiết về mô hình cấu tạo nguyên tử aluminium, từ cấu trúc cơ bản đến tính chất vật lý và hóa học nổi bật của kim loại này. Aluminium không chỉ là nguyên tố phổ biến trong đời sống mà còn có vai trò quan trọng trong nhiều ngành công nghiệp nhờ những tính chất độc đáo của nó.
Mục lục
- Mô Hình Cấu Tạo Nguyên Tử Aluminium
- 1. Giới Thiệu Về Aluminium
- 2. Cấu Trúc Nguyên Tử Aluminium
- 3. Tính Chất Vật Lý Của Aluminium
- 4. Tính Chất Hóa Học Của Aluminium
- 5. Tính Toán Khối Lượng Nguyên Tử Aluminium
- 6. Ứng Dụng Thực Tiễn Của Aluminium
- 7. Phương Pháp Sản Xuất Aluminium
- 8. Bài Tập Về Nguyên Tử Aluminium
Mô Hình Cấu Tạo Nguyên Tử Aluminium
Mô hình cấu tạo nguyên tử aluminium là một trong những công cụ quan trọng giúp học sinh và sinh viên hiểu rõ hơn về cấu trúc của nguyên tử. Việc sử dụng mô hình này trong học tập và nghiên cứu khoa học mang lại nhiều lợi ích và ứng dụng thực tế, đặc biệt trong các lĩnh vực như hóa học và vật lý.
1. Giới Thiệu Về Nguyên Tử Aluminium
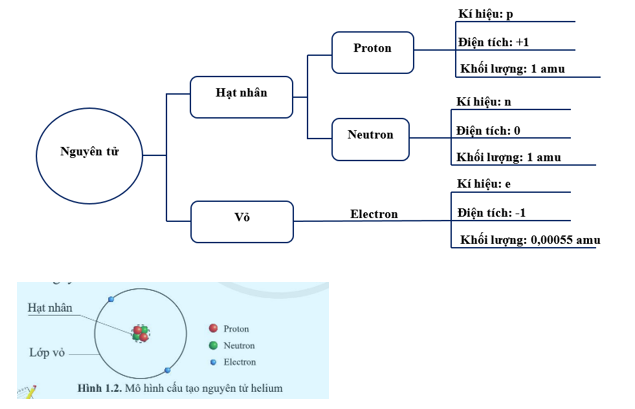
Nguyên tử aluminium có cấu trúc bao gồm các hạt proton, neutron, và electron. Cấu hình electron của aluminium là:
\[1s^2 2s^2 2p^6 3s^2 3p^1\]
Nguyên tử aluminium có 13 proton, 14 neutron và 13 electron. Các electron được sắp xếp trong các lớp vỏ xung quanh hạt nhân, giúp xác định tính chất hóa học của nguyên tố này.
2. Các Bước Tạo Mô Hình Nguyên Tử Aluminium
- Chuẩn bị vật liệu: Sử dụng các vật liệu đơn giản như dây đồng, giấy bạc, hoặc các bộ dụng cụ mô hình nguyên tử có sẵn.
- Lắp ráp hạt nhân: Hạt nhân bao gồm proton và neutron được lắp ráp bằng các hạt cườm nhỏ hoặc giấy bạc.
- Tạo quỹ đạo electron: Sử dụng dây đồng hoặc giấy bạc để uốn thành các quỹ đạo xung quanh hạt nhân.
- Thêm electron: Dùng các hạt nhỏ hoặc giấy bạc cuộn để làm electron và gắn lên các quỹ đạo đã tạo.
3. Sử Dụng Phần Mềm Mô Phỏng
Phần mềm mô phỏng như Jmol, Avogadro, hoặc ChemSketch giúp tạo và quan sát mô hình 3D của nguyên tử aluminium. Các bước thực hiện bao gồm:
- Chọn phần mềm và nhập thông tin về aluminium.
- Tạo mô hình nguyên tử bằng các công cụ trong phần mềm.
- Chỉnh sửa và tùy chỉnh các quỹ đạo, số lượng hạt, và vị trí electron.
4. Ứng Dụng Của Mô Hình Nguyên Tử Aluminium
- Hiểu rõ cấu trúc nguyên tử: Mô hình giúp minh họa cấu trúc của nguyên tử aluminium, giúp người học dễ dàng nắm bắt các khái niệm phức tạp.
- Tăng cường tư duy trực quan: Qua mô hình, học sinh có thể hình dung rõ ràng cách các hạt trong nguyên tử được sắp xếp và tương tác với nhau.
- Thực hành thí nghiệm: Mô hình được sử dụng trong các bài thực hành, giúp áp dụng lý thuyết vào thực tế hiệu quả.
5. Ví Dụ Thực Tế Về Sử Dụng Mô Hình Nguyên Tử Aluminium
| Phản ứng với axit: | \(2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2\) |
| Mô tả: | Sử dụng mô hình để minh họa cách aluminium phản ứng với axit hydrochloric tạo ra nhôm clorua và khí hydro. |
| Phản ứng với bazơ: | \(2Al + 2NaOH + 6H_2O \rightarrow 2Na[Al(OH)_4] + 3H_2\) |
| Mô tả: | Sử dụng mô hình để minh họa cách aluminium phản ứng với dung dịch kiềm tạo ra natri aluminat và khí hydro. |
6. Lợi Ích Của Việc Sử Dụng Mô Hình Nguyên Tử
Mô hình nguyên tử aluminium không chỉ là công cụ học tập hữu ích mà còn giúp tăng cường khả năng tư duy và hiểu biết của học sinh về hóa học và vật lý. Đây là một phương pháp học tập hiệu quả, khuyến khích sự sáng tạo và tư duy logic trong các bài thực hành và nghiên cứu khoa học.
.png)
1. Giới Thiệu Về Aluminium
Aluminium, hay còn gọi là nhôm, là một nguyên tố hóa học có ký hiệu là Al và số nguyên tử là 13. Đây là kim loại phổ biến thứ ba trong vỏ Trái Đất, chỉ sau oxy và silicon, và chiếm khoảng 8% khối lượng rắn của vỏ Trái Đất.
Nguyên tử aluminium bao gồm:
- 13 proton mang điện tích dương, khối lượng mỗi proton khoảng \(1.6726 \times 10^{-27}\) kg.
- 14 neutron không mang điện tích, khối lượng mỗi neutron khoảng \(1.6749 \times 10^{-27}\) kg. Neutron đóng vai trò ổn định hạt nhân.
- 13 electron mang điện tích âm, có khối lượng rất nhỏ, khoảng \(9.109 \times 10^{-31}\) kg, chuyển động xung quanh hạt nhân trong các lớp vỏ năng lượng.
Mô hình nguyên tử của aluminium mô tả sự sắp xếp của các hạt proton, neutron, và electron:
| Thành phần | Số lượng | Khối lượng (kg) |
|---|---|---|
| Proton | 13 | \(13 \times 1.6726 \times 10^{-27}\) |
| Neutron | 14 | \(14 \times 1.6749 \times 10^{-27}\) |
| Electron | 13 | \(13 \times 9.109 \times 10^{-31}\) |
Tổng khối lượng của nguyên tử chủ yếu do các proton và neutron quyết định, trong khi electron ảnh hưởng đến tính chất hóa học. Nhôm là kim loại nhẹ, mềm, có khả năng chống ăn mòn tốt nhờ lớp oxide bảo vệ hình thành trên bề mặt khi tiếp xúc với không khí.
Aluminium được sử dụng rộng rãi trong nhiều ngành công nghiệp như sản xuất bao bì, vật liệu xây dựng, linh kiện điện tử, và ngành hàng không vũ trụ nhờ vào đặc tính nhẹ, bền, và dễ gia công.
2. Cấu Trúc Nguyên Tử Aluminium
Nguyên tử aluminium được cấu tạo từ ba loại hạt cơ bản: proton, neutron, và electron. Các hạt này được sắp xếp theo cấu trúc cụ thể, tạo nên tính chất vật lý và hóa học của nguyên tố aluminium.
1. Hạt nhân nguyên tử:
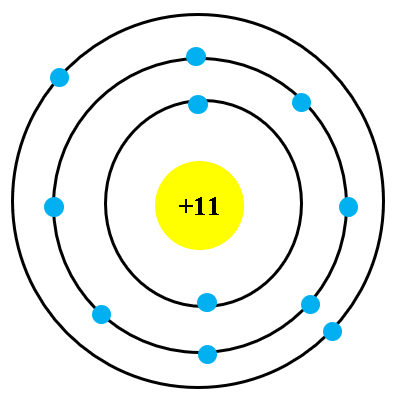
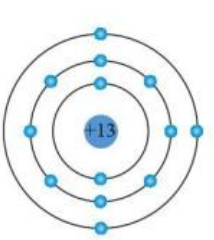
- Proton: Có 13 proton trong hạt nhân của nguyên tử aluminium, mỗi proton mang điện tích dương (+).
- Neutron: Aluminium có 14 neutron trong hạt nhân, không mang điện tích, đóng vai trò duy trì tính ổn định của hạt nhân.
2. Các lớp electron:
Electron là hạt mang điện tích âm (-), chuyển động xung quanh hạt nhân trong các lớp vỏ năng lượng. Cấu trúc lớp electron của aluminium được phân bố như sau:
- Lớp thứ nhất: Chứa 2 electron.
- Lớp thứ hai: Chứa 8 electron.
- Lớp thứ ba: Chứa 3 electron.
Sự phân bố này tuân theo nguyên lý Pauli và quy tắc Hund, giúp xác định cấu trúc và tính chất hóa học của aluminium. Công thức phân bố electron của aluminium là: \(1s^2 2s^2 2p^6 3s^2 3p^1\).
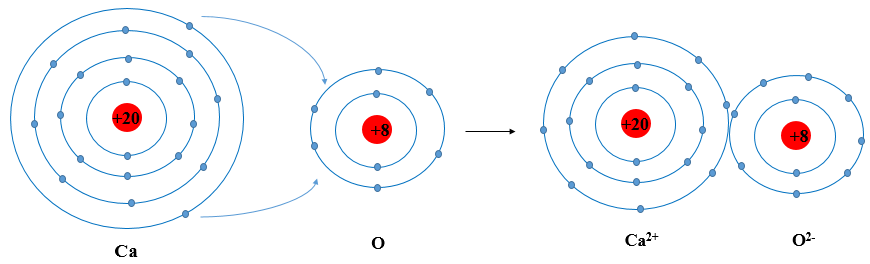
3. Mô hình Bohr của nguyên tử aluminium:
- Hạt nhân nằm ở trung tâm chứa proton và neutron.
- Electron chuyển động xung quanh hạt nhân theo các quỹ đạo xác định.
4. Cấu hình electron:
Aluminium có cấu hình electron: \( \text{[Ne]} 3s^2 3p^1 \). Điều này cho thấy aluminium có khả năng mất 3 electron ở lớp ngoài cùng để tạo thành ion \( \text{Al}^{3+} \), tạo nên tính chất hóa học đặc trưng của kim loại này.
Với cấu trúc đơn giản và khả năng tạo liên kết hóa học mạnh mẽ, aluminium được ứng dụng rộng rãi trong sản xuất công nghiệp và đời sống hàng ngày.

3. Tính Chất Vật Lý Của Aluminium
Aluminium là một kim loại có nhiều tính chất vật lý đặc biệt, giúp nó trở thành vật liệu quan trọng trong nhiều lĩnh vực. Dưới đây là các tính chất vật lý nổi bật của aluminium:
- Màu sắc và vẻ ngoài: Aluminium có màu bạc trắng, bề mặt sáng bóng và có khả năng phản chiếu ánh sáng tốt. Bề mặt kim loại có thể được xử lý để tạo ra lớp bảo vệ chống ăn mòn tự nhiên.
- Khối lượng riêng: Aluminium có khối lượng riêng thấp, khoảng \(2.7 \, \text{g/cm}^3\), nhẹ hơn nhiều so với hầu hết các kim loại khác, giúp giảm tải trọng khi sử dụng trong các ứng dụng cần sự nhẹ nhàng và bền bỉ.
- Độ cứng và độ bền: Aluminium có độ cứng vừa phải, dễ gia công và định hình. Tuy nhiên, nhờ các hợp kim đặc biệt, aluminium có thể tăng cường độ bền và khả năng chịu lực.
- Nhiệt độ nóng chảy: Aluminium có nhiệt độ nóng chảy khoảng \(660.3^\circ \text{C}\), giúp nó dễ dàng đúc và tạo hình trong quá trình sản xuất.
- Tính dẫn điện: Aluminium có khả năng dẫn điện tốt, chỉ xếp sau đồng, làm cho nó trở thành vật liệu phổ biến trong các ứng dụng dẫn điện như dây dẫn và thiết bị điện tử.
- Tính dẫn nhiệt: Với khả năng dẫn nhiệt cao, aluminium được sử dụng rộng rãi trong các thiết bị làm mát và hệ thống tản nhiệt.
- Tính phản xạ: Aluminium phản xạ tốt ánh sáng và nhiệt, được ứng dụng trong việc chế tạo gương và các bề mặt phản xạ năng lượng mặt trời.
Nhờ vào những tính chất vật lý đặc biệt này, aluminium không chỉ là vật liệu nhẹ và bền mà còn rất linh hoạt trong sản xuất công nghiệp, xây dựng, hàng không, và nhiều lĩnh vực khác. Sự kết hợp giữa độ bền và tính nhẹ đã giúp aluminium trở thành một trong những kim loại được ưa chuộng nhất trên thế giới.

4. Tính Chất Hóa Học Của Aluminium
Aluminium là kim loại có tính chất hóa học phong phú và thường xuyên tham gia vào các phản ứng hóa học nhờ tính chất hoạt động mạnh. Dưới đây là những tính chất hóa học nổi bật của aluminium:
- Phản ứng với oxi: Aluminium có khả năng phản ứng mạnh với oxi trong không khí, tạo thành lớp oxit \( \text{Al}_2\text{O}_3 \). Lớp oxit này rất mỏng nhưng bền vững, giúp bảo vệ kim loại khỏi quá trình ăn mòn thêm. Đây là lý do vì sao aluminium có tính chống ăn mòn tốt.
- Phản ứng với axit: Aluminium phản ứng mạnh với các axit như axit hydrochloric (\(\text{HCl}\)) tạo thành muối nhôm và giải phóng khí hydro (\(\text{H}_2\)). Phản ứng này được mô tả bởi phương trình: \[ 2\text{Al} + 6\text{HCl} \rightarrow 2\text{AlCl}_3 + 3\text{H}_2 \uparrow \]
- Phản ứng với bazơ: Không giống như nhiều kim loại khác, aluminium có thể phản ứng với dung dịch bazơ mạnh như natri hydroxide (\(\text{NaOH}\)), tạo thành aluminat natri (\(\text{NaAlO}_2\)) và giải phóng khí hydro. Phương trình phản ứng: \[ 2\text{Al} + 2\text{NaOH} + 6\text{H}_2\text{O} \rightarrow 2\text{NaAl(OH)}_4 + 3\text{H}_2 \uparrow \]
- Phản ứng với nước: Aluminium nguyên chất thường không phản ứng với nước do lớp oxit bảo vệ, nhưng khi lớp bảo vệ này bị phá vỡ, nhôm có thể phản ứng với nước, tạo ra hydro và nhôm hydroxit (\(\text{Al(OH)}_3\)).
- Khả năng khử: Aluminium là chất khử mạnh và thường được sử dụng trong quá trình nhiệt luyện để khử oxit kim loại khác. Ví dụ, trong phản ứng nhiệt nhôm, nhôm khử oxit sắt thành sắt nguyên chất: \[ 2\text{Al} + \text{Fe}_2\text{O}_3 \rightarrow 2\text{Fe} + \text{Al}_2\text{O}_3 \]
Nhờ các tính chất hóa học đa dạng và hoạt động mạnh, aluminium đóng vai trò quan trọng trong nhiều phản ứng công nghiệp và hóa học, đặc biệt là trong các quá trình khử oxit và sản xuất vật liệu mới.

5. Tính Toán Khối Lượng Nguyên Tử Aluminium
Khối lượng nguyên tử của aluminium là một thông số quan trọng trong các tính toán hóa học và vật lý. Để tính toán khối lượng nguyên tử của aluminium, chúng ta cần hiểu rõ các thành phần cấu tạo nên nguyên tử này.
- Số hiệu nguyên tử và khối lượng nguyên tử: Aluminium có số hiệu nguyên tử là 13, tức là có 13 proton trong hạt nhân. Khối lượng nguyên tử trung bình của aluminium được xác định là khoảng \( 26.98 \, \text{u} \) (đơn vị khối lượng nguyên tử).
- Cấu trúc hạt nhân: Aluminium gồm 13 proton và 14 neutron trong hạt nhân, tạo nên khối lượng hạt nhân chủ yếu. Khối lượng electron rất nhỏ so với proton và neutron nên thường được bỏ qua khi tính khối lượng tổng.
- Tính toán khối lượng: Khối lượng nguyên tử aluminium được tính bằng tổng khối lượng của các proton, neutron, và electron, nhưng chủ yếu tập trung vào proton và neutron do khối lượng electron không đáng kể:
\[
m = Z \cdot m_p + N \cdot m_n
\]
Trong đó:
- \( Z = 13 \) là số proton.
- \( N = 14 \) là số neutron.
- \( m_p \approx 1.0073 \, \text{u} \) là khối lượng của một proton.
- \( m_n \approx 1.0087 \, \text{u} \) là khối lượng của một neutron.
Áp dụng các giá trị vào công thức, ta có khối lượng của aluminium là:
Khối lượng này phù hợp với giá trị khối lượng nguyên tử chuẩn của aluminium được sử dụng trong các tính toán hóa học và vật lý.
XEM THÊM:
6. Ứng Dụng Thực Tiễn Của Aluminium
Aluminium là một kim loại nhẹ và có tính chất chống ăn mòn tuyệt vời, làm cho nó trở thành một vật liệu quan trọng trong nhiều lĩnh vực khác nhau của cuộc sống hàng ngày và công nghiệp. Dưới đây là một số ứng dụng thực tiễn phổ biến của aluminium:
6.1. Ứng Dụng Trong Công Nghiệp Hàng Không
Aluminium được sử dụng rộng rãi trong ngành hàng không do trọng lượng nhẹ và độ bền cao của nó. Các đặc điểm này giúp máy bay giảm trọng lượng, tiết kiệm nhiên liệu và tăng hiệu suất bay.
- Khung máy bay: Aluminium được sử dụng để làm khung và các bộ phận của máy bay.
- Vỏ máy bay: Do tính chất nhẹ và bền, aluminium cũng được dùng làm vật liệu chính cho vỏ máy bay.
- Các thành phần nội thất: Aluminium cũng được sử dụng để sản xuất các thành phần nội thất trong máy bay nhằm giảm trọng lượng tổng thể.
6.2. Sử Dụng Trong Xây Dựng và Điện Tử
Trong ngành xây dựng, aluminium được sử dụng cho nhiều mục đích khác nhau do tính chất nhẹ và chống ăn mòn.
- Cửa sổ và cửa ra vào: Aluminium được dùng làm khung cửa sổ và cửa ra vào nhờ vào khả năng chống ăn mòn và độ bền cao.
- Kết cấu xây dựng: Các tòa nhà cao tầng và cầu đều sử dụng aluminium để giảm trọng lượng mà vẫn đảm bảo tính chắc chắn.
- Điện tử: Aluminium được sử dụng trong các thiết bị điện tử như điện thoại, máy tính xách tay, và các thiết bị khác nhờ vào tính dẫn điện tốt và khả năng tản nhiệt hiệu quả.
6.3. Các Ứng Dụng Khác Trong Đời Sống Hàng Ngày
Aluminium cũng có rất nhiều ứng dụng trong đời sống hàng ngày, từ bao bì đến đồ gia dụng.
- Đồ bếp: Aluminium được sử dụng để làm nồi, chảo và các dụng cụ nhà bếp khác vì khả năng truyền nhiệt tốt và trọng lượng nhẹ.
- Bao bì thực phẩm: Aluminium foil và các loại bao bì khác được sử dụng rộng rãi trong ngành công nghiệp thực phẩm để bảo quản thực phẩm và đồ uống.
- Xe đạp và xe máy: Các bộ phận của xe đạp và xe máy như khung và vành xe thường được làm bằng aluminium để giảm trọng lượng và tăng độ bền.
7. Phương Pháp Sản Xuất Aluminium
Aluminium, hay còn gọi là nhôm, là một kim loại nhẹ và bền, được sử dụng rộng rãi trong nhiều ngành công nghiệp. Quá trình sản xuất aluminium từ quặng bô xít bao gồm ba bước chính: khai thác quặng, tinh chế quặng thành alumin (oxit nhôm), và điện phân alumin để sản xuất aluminium kim loại.
- Khai thác quặng bô xít
Quặng bô xít là nguồn chính để sản xuất nhôm, được khai thác từ các mỏ quặng. Sau khi khai thác, quặng bô xít được nghiền nhỏ và rửa sạch để loại bỏ các tạp chất không mong muốn.
- Tinh chế quặng thành alumin
Quặng bô xít sau khi được làm sạch sẽ được chuyển qua quá trình tinh chế bằng phương pháp Bayer. Trong phương pháp này, quặng bô xít được hòa tan trong dung dịch natri hydroxide (NaOH). Quá trình này tách alumina (Al2O3) từ quặng bô xít thông qua phản ứng hóa học:
\[ \text{Al}_2\text{O}_3 + 2\text{NaOH} + 3\text{H}_2\text{O} \rightarrow 2\text{NaAl(OH)}_4 \]Hỗn hợp này sau đó được làm mát và lọc để thu được alumin tinh khiết dưới dạng bột.
- Điện phân alumin để sản xuất aluminium kim loại
Trong bước cuối cùng, alumin tinh khiết được chuyển qua quá trình điện phân trong lò điện phân Hall-Héroult. Alumin được hòa tan trong cryolit nóng chảy (\(\text{Na}_3\text{AlF}_6\)) để tạo ra dung dịch dẫn điện. Khi điện áp được áp dụng, alumin bị phân tách thành nhôm kim loại và oxy. Phản ứng điện phân diễn ra như sau:
\[ 2\text{Al}_2\text{O}_3 + 3\text{C} \rightarrow 4\text{Al} + 3\text{CO}_2 \]Nhôm kim loại được thu thập tại cực âm của buồng điện phân, trong khi oxy phản ứng với cực dương làm từ carbon để tạo ra khí carbon dioxide.
Nhờ quy trình này, aluminium được sản xuất với hiệu suất cao và chất lượng đảm bảo, phục vụ cho nhiều ngành công nghiệp như hàng không, xây dựng, và điện tử.

8. Bài Tập Về Nguyên Tử Aluminium
Bài tập này giúp bạn hiểu rõ hơn về cấu tạo và tính chất của nguyên tử aluminium (nhôm), bao gồm các thành phần cấu tạo như proton, neutron, và electron.
-
Tính số proton, neutron và electron trong nguyên tử aluminium:
- Số proton: 13
- Số neutron: 14
- Số electron: 13
-
Tính tổng khối lượng của nguyên tử aluminium:
Khối lượng của proton: \(1.673 \times 10^{-24}\) g
Khối lượng của neutron: \(1.675 \times 10^{-24}\) g
Khối lượng của electron: \(9.109 \times 10^{-28}\) gTính toán tổng khối lượng của nguyên tử aluminium bằng công thức:
\[ M = (13 \times 1.673 \times 10^{-24}) + (14 \times 1.675 \times 10^{-24}) + (13 \times 9.109 \times 10^{-28}) \]Kết quả: \(M \approx 4.5199 \times 10^{-23}\) g
-
Bài tập tính chất hóa học của aluminium:
- Phản ứng với axit HCl: \(2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2 \uparrow\)
- Phản ứng với dung dịch kiềm: \(2Al + 2NaOH + 6H_2O \rightarrow 2Na[Al(OH)_4] + 3H_2 \uparrow\)
- Phản ứng với oxy: \(4Al + 3O_2 \rightarrow 2Al_2O_3\)
- Phản ứng với clo: \(2Al + 3Cl_2 \rightarrow 2AlCl_3\)
Giải thích các phản ứng hóa học trên và viết phương trình cân bằng cho các phản ứng này.
-
Bài tập phân tích cấu trúc electron của aluminium:
Xác định số lượng electron trong mỗi lớp vỏ năng lượng của nguyên tử aluminium và mô tả cách sắp xếp này ảnh hưởng đến tính chất hóa học của nguyên tử.
- Lớp K: 2 electron
- Lớp L: 8 electron
- Lớp M: 3 electron
Viết cấu hình electron đầy đủ của aluminium: \(1s^2 2s^2 2p^6 3s^2 3p^1\)
-
Bài tập tìm hiểu ứng dụng thực tế của aluminium:
Tìm hiểu và liệt kê một số ứng dụng phổ biến của aluminium trong cuộc sống hàng ngày và trong công nghiệp, như trong sản xuất bao bì, xây dựng, và ngành công nghiệp điện tử.