Chủ đề cấu tạo nguyên tử sắt: Cấu tạo nguyên tử sắt là nền tảng quan trọng trong lĩnh vực hóa học và vật lý. Bài viết này sẽ giúp bạn khám phá chi tiết về cấu hình electron, đặc điểm vật lý, hóa học của sắt và ứng dụng thực tiễn của nó trong đời sống, từ sản xuất thép đến công nghệ y học.
Mục lục
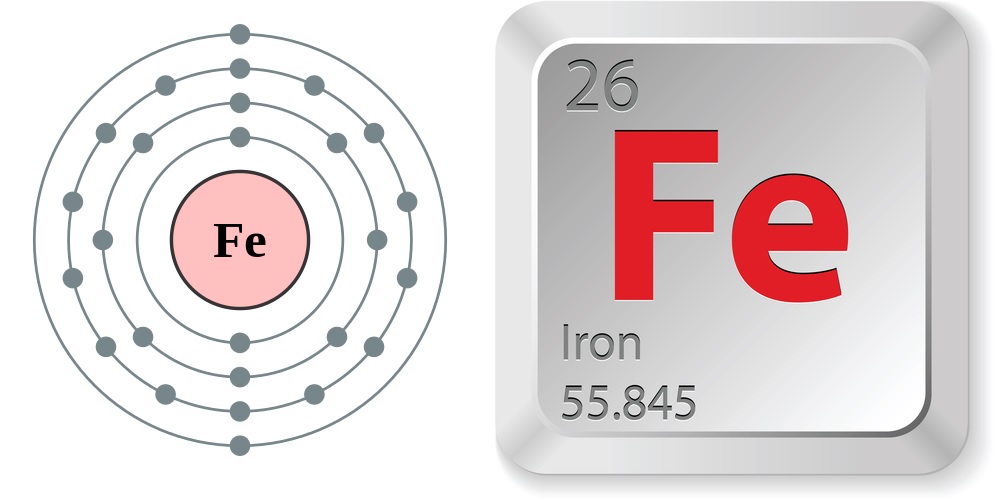
Cấu Tạo Nguyên Tử Sắt
Nguyên tử sắt (Fe) là một nguyên tố hóa học trong bảng tuần hoàn với số hiệu nguyên tử 26. Cấu tạo của nguyên tử sắt bao gồm:
1. Cấu hình electron
- Cấu hình electron của sắt là: \([Ar] 3d^{6} 4s^{2}\)
- Điều này có nghĩa là nguyên tử sắt có 26 electron phân bố trong các lớp vỏ như sau:
- \(1s^{2} 2s^{2} 2p^{6} 3s^{2} 3p^{6} 3d^{6} 4s^{2}\)
2. Số hiệu nguyên tử và khối lượng nguyên tử
- Số hiệu nguyên tử: 26
- Khối lượng nguyên tử: \(55.845 \, u\)
3. Đặc điểm vật lý
- Sắt là kim loại màu trắng hơi xám, có khả năng dẫn nhiệt và dẫn điện tốt.
- Sắt có tính nhiễm từ mạnh và nhiệt độ nóng chảy khá cao, đạt \(1540^{\circ}C\).
4. Đặc điểm hóa học
- Sắt có tính khử trung bình, có thể bị oxi hóa lên các mức +2 hoặc +3.
- Các phản ứng đặc trưng:
- Phản ứng với phi kim: \(4Fe + 3O_{2} \rightarrow 2Fe_{2}O_{3}\)
- Phản ứng với axit: \(Fe + 2HCl \rightarrow FeCl_{2} + H_{2}\)
- Phản ứng với dung dịch muối: \(Fe + CuSO_{4} \rightarrow FeSO_{4} + Cu\)
5. Ứng dụng của sắt
- Sắt là thành phần chính trong sản xuất thép, một vật liệu quan trọng trong xây dựng và chế tạo máy móc.
- Các hợp kim của sắt như thép không gỉ được sử dụng rộng rãi nhờ khả năng chống ăn mòn và độ bền cao.
.png)
Tổng Quan Về Nguyên Tử Sắt
Sắt, ký hiệu hóa học là Fe, là một nguyên tố kim loại có số hiệu nguyên tử là 26, thuộc nhóm 8 trong bảng tuần hoàn. Nguyên tử sắt có cấu tạo phức tạp, bao gồm hạt nhân chứa 26 proton và số lượng neutron có thể thay đổi tùy thuộc vào các đồng vị của sắt. Xung quanh hạt nhân là 26 electron phân bố trên các lớp vỏ electron.
Cấu trúc của nguyên tử sắt có thể được biểu diễn như sau:
- Lớp vỏ electron: Sắt có tổng cộng 26 electron, được phân bố trên các lớp vỏ electron theo thứ tự: \(1s^2, 2s^2, 2p^6, 3s^2, 3p^6, 3d^6, 4s^2\).
- Hạt nhân nguyên tử: Hạt nhân của nguyên tử sắt chứa 26 proton và khoảng 30 neutron, tạo nên một khối lượng nguyên tử xấp xỉ 55,85 amu.
Sắt có nhiều tính chất hóa học đáng chú ý. Trong các phản ứng hóa học, sắt thường xuất hiện ở hai trạng thái oxy hóa phổ biến là \(Fe^{2+}\) và \(Fe^{3+}\). Sắt dễ dàng phản ứng với các phi kim như oxy và lưu huỳnh để tạo thành các hợp chất như sắt(III) oxit \(Fe_2O_3\) và sắt(II) sulfide \(FeS\).
Các phản ứng tiêu biểu của sắt bao gồm:
- Phản ứng với oxy: \(4Fe + 3O_2 \rightarrow 2Fe_2O_3\)
- Phản ứng với lưu huỳnh: \(Fe + S \rightarrow FeS\)
Sắt là nguyên tố thiết yếu trong nhiều lĩnh vực công nghiệp và đời sống. Kim loại này chủ yếu được sử dụng để sản xuất thép, một vật liệu quan trọng trong xây dựng, sản xuất ô tô, và nhiều ngành công nghiệp khác. Ngoài ra, sắt còn có mặt trong nhiều hợp chất hữu cơ và vô cơ, đóng vai trò quan trọng trong các phản ứng sinh hóa.
Cấu Trúc Nguyên Tử Sắt
Nguyên tử sắt (Fe) là một trong những nguyên tố quan trọng và phổ biến nhất trong vỏ Trái Đất. Nó có số hiệu nguyên tử là 26 và nằm ở chu kỳ 4, nhóm VIIIB trong bảng tuần hoàn các nguyên tố hóa học.
Cấu hình electron của nguyên tử sắt được biểu diễn như sau:
\[1s^2 2s^2 2p^6 3s^2 3p^6 3d^6 4s^2\]
Trong cấu trúc này, các electron được phân bố trên các lớp vỏ năng lượng và phân lớp cụ thể:
- Lớp vỏ thứ nhất: \[1s^2\]
- Lớp vỏ thứ hai: \[2s^2 2p^6\]
- Lớp vỏ thứ ba: \[3s^2 3p^6 3d^6\]
- Lớp vỏ thứ tư: \[4s^2\]
Nguyên tử sắt có hai trạng thái oxi hóa phổ biến là +2 và +3, tương ứng với các cấu hình electron:
- Sắt (II): \[Fe^{2+}: 1s^2 2s^2 2p^6 3s^2 3p^6 3d^6\]
- Sắt (III): \[Fe^{3+}: 1s^2 2s^2 2p^6 3s^2 3p^6 3d^5\]
Sắt tồn tại chủ yếu dưới dạng hợp chất trong tự nhiên, như oxit, sunfua, silicat và trong các quặng như hematit đỏ \((Fe_2O_3)\), manhetit \((Fe_3O_4)\), và pirit \((FeS_2)\). Với tính chất hóa học đa dạng, sắt dễ dàng phản ứng với phi kim, axit, và nhiều hợp chất khác, thể hiện vai trò quan trọng trong nhiều quá trình hóa học và ứng dụng công nghiệp.

Đặc Điểm Vật Lý Của Nguyên Tử Sắt
Sắt (Fe) là một nguyên tố hóa học có số hiệu nguyên tử là 26 và khối lượng nguyên tử khoảng 56 g/mol. Nguyên tử sắt sở hữu một cấu trúc phức tạp với các đặc điểm vật lý nổi bật, bao gồm:
- Màu sắc: Sắt là kim loại có màu trắng hơi xám, có ánh kim khi đánh bóng.
- Trạng thái: Ở nhiệt độ phòng, sắt ở trạng thái rắn và có cấu trúc tinh thể bền vững.
- Khối lượng riêng: Sắt có khối lượng riêng là \(7.87 \, \text{g/cm}^3\), cho thấy nó là một kim loại khá nặng.
- Nhiệt độ nóng chảy: Sắt có nhiệt độ nóng chảy cao, đạt \(1540^{\circ}\text{C}\), làm cho nó rất hữu ích trong các ứng dụng công nghiệp yêu cầu khả năng chịu nhiệt độ cao.
- Tính dẻo và dễ rèn: Sắt rất dẻo, có thể kéo dài và uốn mà không bị gãy, điều này giúp sắt dễ dàng được gia công trong sản xuất các sản phẩm kim loại.
- Dẫn nhiệt và dẫn điện: Sắt là kim loại dẫn điện và dẫn nhiệt tốt, làm cho nó quan trọng trong các ngành công nghiệp điện và nhiệt.
- Tính nhiễm từ: Một đặc điểm nổi bật của sắt là tính nhiễm từ, tức là nó có khả năng bị hút bởi nam châm, và có thể trở thành một nam châm khi được từ hóa.
Với những đặc điểm vật lý này, sắt không chỉ đóng vai trò quan trọng trong ngành công nghiệp mà còn là thành phần không thể thiếu trong nhiều lĩnh vực khác nhau của đời sống hàng ngày.

Đặc Điểm Hóa Học Của Nguyên Tử Sắt
Nguyên tử sắt (Fe) là một nguyên tố kim loại trong bảng tuần hoàn, thuộc nhóm 8, chu kỳ 4 với số hiệu nguyên tử là 26. Sắt là một trong những nguyên tố phổ biến nhất trong vỏ trái đất và có vai trò quan trọng trong nhiều quá trình hóa học và sinh học.
- Cấu trúc nguyên tử: Nguyên tử sắt có cấu hình electron là \( [\text{Ar}] 3d^6 4s^2 \). Điều này có nghĩa là sắt có 26 proton trong hạt nhân, 26 electron xung quanh hạt nhân, và các electron được phân bố trong các lớp vỏ electron.
- Trạng thái oxi hóa: Sắt có thể tồn tại ở nhiều trạng thái oxi hóa khác nhau, phổ biến nhất là \( +2 \) và \( +3 \). Trong các hợp chất sắt \( (II) \) và sắt \( (III) \), sắt đóng vai trò như một ion kim loại, thường tham gia vào các phản ứng oxi hóa khử.
- Tính chất hóa học:
- Sắt có khả năng dễ dàng phản ứng với oxi để tạo thành oxit sắt, chẳng hạn như \( \text{Fe}_2\text{O}_3 \) (gỉ sắt) và \( \text{Fe}_3\text{O}_4 \) (từ tính).
- Sắt có tính khử mạnh, có thể khử các ion kim loại khác trong dung dịch, biến chúng thành kim loại nguyên chất.
- Sắt có thể tạo thành nhiều hợp chất phối trí với các ligand khác nhau, đặc biệt là trong các phức chất sắt \( (III) \).
Nguyên tử sắt là một nguyên tố có tính chất hóa học đa dạng và phức tạp, đóng vai trò quan trọng trong nhiều ngành công nghiệp, đặc biệt là trong sản xuất thép và các hợp chất hóa học khác.

Ứng Dụng Của Nguyên Tử Sắt Trong Đời Sống
Sắt là một trong những kim loại được sử dụng rộng rãi nhất trên thế giới, đóng vai trò thiết yếu trong nhiều lĩnh vực của đời sống. Dưới đây là những ứng dụng nổi bật của sắt:
- Sản xuất thép: Sắt là nguyên liệu chính để sản xuất thép, một hợp kim được sử dụng trong xây dựng, sản xuất ô tô, tàu thuyền, và nhiều ngành công nghiệp khác. Các loại thép như thép không gỉ, thép carbon, và thép hợp kim đều chứa hàm lượng sắt cao, đem lại độ bền và khả năng chống ăn mòn tuyệt vời.
- Ngành y tế: Sắt là thành phần chính của hemoglobin, một protein trong hồng cầu giúp vận chuyển oxy từ phổi đến các mô trong cơ thể. Thiếu sắt có thể dẫn đến thiếu máu, do đó việc bổ sung sắt qua chế độ ăn uống là rất cần thiết. Sắt có mặt trong nhiều thực phẩm như thịt đỏ, đậu, và rau xanh.
- Ứng dụng trong nông nghiệp: Sắt được sử dụng trong các loại phân bón nhằm cải thiện chất lượng đất và tăng năng suất cây trồng. Sắt giúp cây hấp thu các dưỡng chất khác hiệu quả hơn, từ đó thúc đẩy quá trình sinh trưởng.
- Ngành công nghiệp hóa chất: Sắt được sử dụng để sản xuất các hợp chất hóa học như sắt sulfate (FeSO4) và sắt chloride (FeCl3), được dùng trong xử lý nước và sản xuất thuốc nhuộm.
- Ứng dụng trong đời sống hàng ngày: Các sản phẩm từ sắt xuất hiện hầu hết trong mọi mặt của đời sống hàng ngày, từ các vật dụng gia đình như dao, kéo, và đồ nội thất đến các phương tiện giao thông như xe đạp, xe máy, và ô tô.
Sắt không chỉ là một nguyên tố quan trọng trong công nghiệp và y tế, mà còn đóng vai trò thiết yếu trong cuộc sống hàng ngày của chúng ta.
XEM THÊM:
Kết Luận
Nguyên tử sắt (Fe) không chỉ đóng vai trò quan trọng trong cấu trúc hóa học mà còn có những đặc điểm hóa học đặc trưng, giúp nó trở thành một kim loại không thể thiếu trong nhiều lĩnh vực của đời sống. Sắt có tính khử mạnh, có thể tạo ra nhiều hợp chất khác nhau khi phản ứng với phi kim và axit, chẳng hạn như sắt(III) chloride (\(FeCl_3\)) hay sắt(II) sulfide (\(FeS\)). Những đặc điểm này đã giúp sắt có tính ứng dụng cao trong công nghiệp, y tế, và nhiều lĩnh vực khác.
Với sự kết hợp giữa tính chất hóa học đặc biệt và khả năng ứng dụng rộng rãi, sắt tiếp tục giữ vững vai trò quan trọng trong sự phát triển của xã hội hiện đại. Việc hiểu rõ hơn về đặc điểm hóa học của nguyên tử sắt giúp chúng ta khai thác và sử dụng hiệu quả hơn nguồn tài nguyên này, đồng thời góp phần bảo vệ môi trường và nâng cao chất lượng cuộc sống.


.png)