Chủ đề cấu tạo nguyên tử aluminium: Cấu tạo nguyên tử Aluminium là một chủ đề quan trọng trong hóa học, đóng vai trò nền tảng cho nhiều ứng dụng công nghiệp và đời sống. Bài viết này sẽ đi sâu vào khám phá chi tiết về cấu trúc, tính chất, và ứng dụng của Aluminium, giúp bạn hiểu rõ hơn về nguyên tố này và vai trò thiết yếu của nó trong thế giới hiện đại.
Mục lục
- Cấu tạo nguyên tử Aluminium
- Tính chất hóa học của Aluminium
- Tính chất vật lý của Aluminium
- Ứng dụng của Aluminium
- Tính chất hóa học của Aluminium
- Tính chất vật lý của Aluminium
- Ứng dụng của Aluminium
- Tính chất vật lý của Aluminium
- Ứng dụng của Aluminium
- Ứng dụng của Aluminium
- I. Giới Thiệu Chung Về Aluminium
- II. Cấu Tạo Nguyên Tử Aluminium
- III. Tính Chất Vật Lý Của Aluminium
- IV. Tính Chất Hóa Học Của Aluminium
- V. Quá Trình Điều Chế Aluminium
- VI. Ứng Dụng Của Aluminium
- VII. Kết Luận
Cấu tạo nguyên tử Aluminium
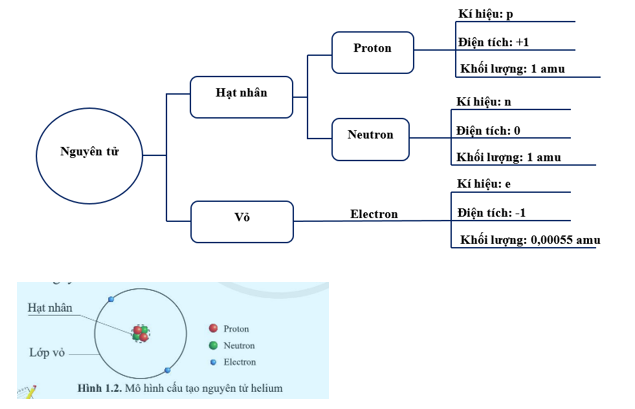
Nguyên tử Aluminium (Nhôm) là một cấu trúc phức tạp bao gồm ba loại hạt cơ bản: proton, neutron và electron. Việc hiểu rõ cấu trúc của nguyên tử này giúp giải thích các tính chất vật lý và hóa học của nhôm, đặc biệt trong ứng dụng công nghiệp và đời sống hàng ngày.
1. Hạt nhân nguyên tử Aluminium
- Nguyên tử Aluminium có 13 proton mang điện tích dương và 14 neutron không mang điện.
- Tổng khối lượng của nguyên tử chủ yếu do các proton và neutron quyết định. Khối lượng của các proton là \(13 \times 1.673 \times 10^{-27}\) kg và neutron là \(14 \times 1.675 \times 10^{-27}\) kg.
2. Cấu hình electron của Aluminium
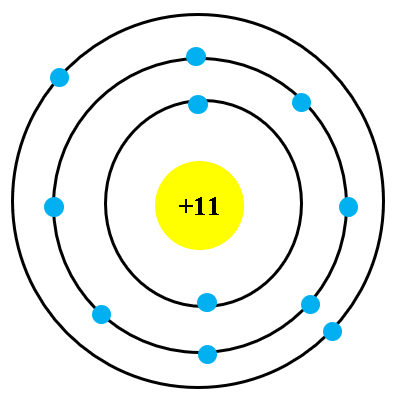
Nguyên tử Aluminium có 13 electron được sắp xếp vào các lớp năng lượng theo cấu hình:
Theo cấu hình này:
- Lớp K: chứa 2 electron
- Lớp L: chứa 8 electron
- Lớp M: chứa 3 electron, trong đó có 3 electron ngoài cùng, quyết định tính chất hóa học của nhôm.
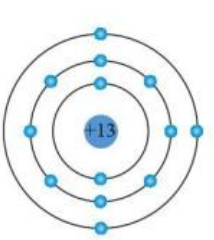
3. Mô hình nguyên tử Aluminium
- Mô hình Bohr cho thấy các electron di chuyển trên những quỹ đạo xác định quanh hạt nhân. Mỗi quỹ đạo tương ứng với một mức năng lượng cụ thể.
- Quỹ đạo càng xa hạt nhân thì electron có năng lượng càng cao. Mô hình này giúp giải thích sự sắp xếp electron và các phản ứng hóa học.
.png)
Tính chất hóa học của Aluminium
Nhôm là một kim loại hoạt động hóa học mạnh, có nhiều tính chất đặc trưng:
1. Phản ứng với axit
Nhôm phản ứng với axit mạnh để tạo ra khí hydro và muối tương ứng:
2. Phản ứng với dung dịch kiềm
Nhôm phản ứng với dung dịch NaOH (natri hydroxide) tạo ra aluminat và khí hydro:
3. Phản ứng với oxy
Nhôm phản ứng với oxy tạo ra lớp màng oxit bảo vệ bề mặt, ngăn chặn sự ăn mòn thêm:
Tính chất vật lý của Aluminium
- Nhôm có khối lượng riêng thấp khoảng 2.7 g/cm³, là một kim loại nhẹ.
- Độ dẫn điện và dẫn nhiệt cao, chỉ sau bạc và đồng.
- Nhiệt độ nóng chảy khoảng 660°C.
- Khả năng chống ăn mòn cao nhờ lớp oxit bảo vệ tự nhiên.

Ứng dụng của Aluminium
- Nhôm được sử dụng rộng rãi trong các ngành công nghiệp như hàng không, xây dựng, và điện tử nhờ vào đặc tính nhẹ, bền, và dẫn điện tốt.
- Nhôm còn là vật liệu tái chế tốt, có thể tái sử dụng mà không mất đi các tính chất quan trọng.

XEM THÊM:
Tính chất hóa học của Aluminium
Nhôm là một kim loại hoạt động hóa học mạnh, có nhiều tính chất đặc trưng:
1. Phản ứng với axit
Nhôm phản ứng với axit mạnh để tạo ra khí hydro và muối tương ứng:
2. Phản ứng với dung dịch kiềm
Nhôm phản ứng với dung dịch NaOH (natri hydroxide) tạo ra aluminat và khí hydro:
3. Phản ứng với oxy
Nhôm phản ứng với oxy tạo ra lớp màng oxit bảo vệ bề mặt, ngăn chặn sự ăn mòn thêm:

Tính chất vật lý của Aluminium
- Nhôm có khối lượng riêng thấp khoảng 2.7 g/cm³, là một kim loại nhẹ.
- Độ dẫn điện và dẫn nhiệt cao, chỉ sau bạc và đồng.
- Nhiệt độ nóng chảy khoảng 660°C.
- Khả năng chống ăn mòn cao nhờ lớp oxit bảo vệ tự nhiên.
Ứng dụng của Aluminium
- Nhôm được sử dụng rộng rãi trong các ngành công nghiệp như hàng không, xây dựng, và điện tử nhờ vào đặc tính nhẹ, bền, và dẫn điện tốt.
- Nhôm còn là vật liệu tái chế tốt, có thể tái sử dụng mà không mất đi các tính chất quan trọng.
Tính chất vật lý của Aluminium
- Nhôm có khối lượng riêng thấp khoảng 2.7 g/cm³, là một kim loại nhẹ.
- Độ dẫn điện và dẫn nhiệt cao, chỉ sau bạc và đồng.
- Nhiệt độ nóng chảy khoảng 660°C.
- Khả năng chống ăn mòn cao nhờ lớp oxit bảo vệ tự nhiên.

Ứng dụng của Aluminium
- Nhôm được sử dụng rộng rãi trong các ngành công nghiệp như hàng không, xây dựng, và điện tử nhờ vào đặc tính nhẹ, bền, và dẫn điện tốt.
- Nhôm còn là vật liệu tái chế tốt, có thể tái sử dụng mà không mất đi các tính chất quan trọng.
Ứng dụng của Aluminium
- Nhôm được sử dụng rộng rãi trong các ngành công nghiệp như hàng không, xây dựng, và điện tử nhờ vào đặc tính nhẹ, bền, và dẫn điện tốt.
- Nhôm còn là vật liệu tái chế tốt, có thể tái sử dụng mà không mất đi các tính chất quan trọng.
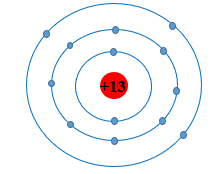
I. Giới Thiệu Chung Về Aluminium
Aluminium (nhôm) là một nguyên tố hóa học có ký hiệu Al và số hiệu nguyên tử là 13. Đây là kim loại phổ biến nhất trong lớp vỏ Trái Đất, chiếm khoảng 8,23% khối lượng. Nhôm không tồn tại ở dạng nguyên chất trong tự nhiên, mà thường được tìm thấy dưới dạng hợp chất oxit trong quặng bauxite (\(Al_2O_3\)).
Cấu trúc nguyên tử của nhôm bao gồm 13 proton, 13 electron, và số neutron có thể thay đổi theo các đồng vị của nó. Trong điều kiện bình thường, nhôm có cấu hình electron là \(1s^2 2s^2 2p^6 3s^2 3p^1\), thuộc nhóm IIIA trong bảng tuần hoàn, tức là có 3 electron lớp ngoài cùng, do đó dễ dàng tham gia phản ứng hóa học để tạo ra các hợp chất khác nhau.
Aluminium có các tính chất vật lý đặc trưng như độ dẫn điện và dẫn nhiệt tốt, tính dẻo, nhẹ nhưng bền. Đặc biệt, bề mặt của nhôm thường được bao phủ bởi một lớp màng oxit bảo vệ, giúp nó không bị ăn mòn khi tiếp xúc với không khí.
Nhôm có khả năng phản ứng với nhiều chất khác nhau, đặc biệt là phản ứng với các axit, bazơ và một số muối. Ví dụ, nhôm phản ứng với dung dịch axit clohydric (HCl) theo phương trình:
\[
2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2
\]
Trong công nghiệp, nhôm được sản xuất chủ yếu thông qua quá trình điện phân quặng bauxite nóng chảy. Quá trình này tạo ra nhôm nguyên chất, được sử dụng trong nhiều lĩnh vực như sản xuất vật liệu xây dựng, chế tạo máy móc, thiết bị điện tử, và nhiều ứng dụng trong đời sống hàng ngày.
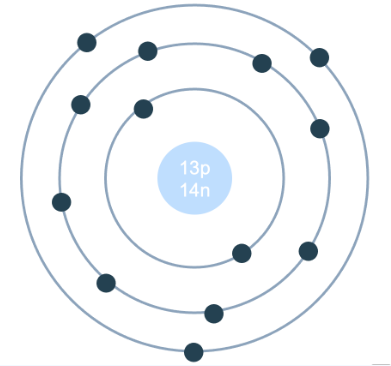
II. Cấu Tạo Nguyên Tử Aluminium
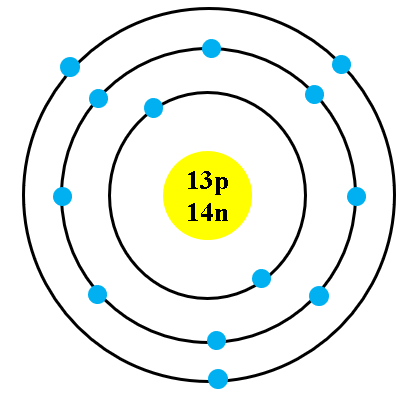
Nguyên tử Aluminium (Al) có số nguyên tử bằng 13, gồm 13 proton, 14 neutron và 13 electron. Các electron được phân bố trên ba lớp vỏ bao quanh hạt nhân. Cấu hình electron của Aluminium là \(1s^2 2s^2 2p^6 3s^2 3p^1\), nghĩa là có ba lớp electron, với lớp ngoài cùng chỉ chứa một electron. Hạt nhân của nguyên tử Aluminium chứa các hạt proton tích điện dương và các neutron không mang điện.
Do có ba lớp electron, nguyên tử Aluminium thuộc nhóm kim loại kiềm thổ, có khả năng dễ dàng cho đi electron ở lớp vỏ ngoài cùng, dẫn đến tính chất hóa học đặc trưng của kim loại này. Electron ở lớp vỏ ngoài cùng đóng vai trò quan trọng trong các phản ứng hóa học của Aluminium, đặc biệt là khả năng khử trong các phản ứng oxy hóa-khử.
Cấu trúc cơ bản của Aluminium giúp giải thích nhiều tính chất vật lý và hóa học của nó, bao gồm độ bền, tính dẫn điện và khả năng phản ứng với các axit, bazơ và các hợp chất khác. Nhờ khả năng tạo thành liên kết mạnh với các nguyên tử khác, Aluminium được sử dụng rộng rãi trong công nghiệp sản xuất hợp kim và trong các phản ứng nhiệt nhôm, đặc biệt trong việc chế tạo các kim loại có nhiệt độ nóng chảy cao.
Ví dụ điển hình về phản ứng của Aluminium là phản ứng nhiệt nhôm, trong đó nhôm đóng vai trò chất khử để khử oxit kim loại, như phản ứng:
Phản ứng này được sử dụng để hàn đường ray và trong quá trình điều chế các kim loại hiếm.
III. Tính Chất Vật Lý Của Aluminium
Aluminium (Nhôm) là một kim loại nhẹ, màu trắng bạc và có độ dẫn điện, dẫn nhiệt cao. Dưới đây là một số tính chất vật lý tiêu biểu của kim loại này:
- Khối lượng riêng: Aluminium có khối lượng riêng khoảng 2,7 g/cm³, nhẹ hơn nhiều so với các kim loại khác như sắt (7,8 g/cm³).
- Nhiệt độ nóng chảy: Aluminium nóng chảy ở khoảng 660°C, giúp dễ dàng gia công trong các quá trình chế tạo công nghiệp.
- Tính chất mềm và dẻo: Nhôm có thể dát mỏng và kéo dài, ví dụ như làm lá nhôm mỏng đến 0,01 mm dùng trong gói thực phẩm.
- Cấu trúc tinh thể: Aluminium có cấu trúc lập phương tâm diện (FCC), làm tăng độ dẻo của nó.
- Độ dẫn điện và dẫn nhiệt cao: Nhôm là chất dẫn điện tốt, thường được sử dụng trong các dây dẫn điện, đồng thời cũng có khả năng truyền nhiệt nhanh chóng.
Nhờ những tính chất này, nhôm được ứng dụng rộng rãi trong nhiều ngành công nghiệp, từ xây dựng đến sản xuất đồ gia dụng và công nghệ.
IV. Tính Chất Hóa Học Của Aluminium
Aluminium có nhiều tính chất hóa học độc đáo, giúp kim loại này phản ứng với nhiều chất khác nhau, đặc biệt trong các điều kiện nhất định:
- Phản ứng với không khí: Trong không khí, nhôm dễ dàng bị oxy hóa để tạo thành lớp oxit nhôm \(\text{Al}_2\text{O}_3\), bảo vệ bề mặt kim loại khỏi sự ăn mòn sâu hơn. Lớp oxit này rất bền và không thấm nước, giúp nhôm chống lại sự ăn mòn.
- Phản ứng với axit: Aluminium phản ứng mạnh với các axit mạnh như axit hydrochloric (\(\text{HCl}\)), tạo ra khí hydro (\(\text{H}_2\)) và muối nhôm: \[ 2\text{Al} + 6\text{HCl} \rightarrow 2\text{AlCl}_3 + 3\text{H}_2 \]
- Phản ứng với bazơ: Nhôm cũng phản ứng với các dung dịch kiềm như natri hydroxide (\(\text{NaOH}\)), tạo ra aluminat: \[ 2\text{Al} + 2\text{NaOH} + 6\text{H}_2\text{O} \rightarrow 2\text{NaAl(OH)}_4 + 3\text{H}_2 \]
- Tính chất lưỡng tính: Aluminium có tính chất lưỡng tính, nghĩa là có thể phản ứng với cả axit và bazơ để tạo ra muối nhôm.
- Không phản ứng với nước ở nhiệt độ thường: Do lớp oxit bảo vệ trên bề mặt, nhôm không phản ứng với nước ở điều kiện thường. Tuy nhiên, nhôm có thể phản ứng với hơi nước ở nhiệt độ cao để tạo ra khí hydro.
Nhờ các tính chất hóa học này, aluminium được sử dụng rộng rãi trong các ngành công nghiệp, đặc biệt trong sản xuất vật liệu chống ăn mòn và hợp kim nhẹ.
V. Quá Trình Điều Chế Aluminium
Quá trình điều chế nhôm từ quặng bauxite là một quá trình phức tạp và đòi hỏi sự can thiệp của nhiều công đoạn hóa học và điện phân. Dưới đây là các bước chính trong quá trình này:
- Chiết xuất alumina từ bauxite: Quặng bauxite chứa khoảng 30-50% oxit nhôm \(\text{Al}_2\text{O}_3\), cùng với các tạp chất như sắt và silica. Bước đầu tiên là xử lý quặng này bằng quy trình Bayer, trong đó bauxite được nghiền nhỏ và hòa tan trong dung dịch natri hydroxide (\(\text{NaOH}\)). Kết quả là alumina (\(\text{Al}_2\text{O}_3\)) được tách ra dưới dạng tinh khiết.
- Điện phân oxit nhôm: Alumina sau đó được đưa vào quá trình điện phân trong dung dịch cryolite (\(\text{Na}_3\text{AlF}_6\)) nóng chảy để giảm nhiệt độ nóng chảy của alumina từ khoảng 2000°C xuống khoảng 950°C. Trong quá trình này, dòng điện đi qua làm nhôm nguyên chất lắng đọng tại cực âm và oxy thoát ra tại cực dương.
- Thu hồi nhôm: Nhôm thu được từ quá trình điện phân có độ tinh khiết cao và được thu hồi dưới dạng kim loại nóng chảy. Nhôm lỏng sau đó có thể được đổ vào khuôn để tạo thành các sản phẩm hoặc chuyển sang bước chế biến tiếp theo.
- Chế tạo hợp kim nhôm: Một phần nhôm được sử dụng trực tiếp, phần còn lại được sử dụng để sản xuất hợp kim, giúp cải thiện độ cứng và sức bền của nhôm trong các ứng dụng công nghiệp.
Quy trình điều chế nhôm là một quá trình tiêu tốn năng lượng, nhưng nhờ các tính chất vượt trội của nhôm như độ bền, khả năng chống ăn mòn và trọng lượng nhẹ, nhôm được ứng dụng rộng rãi trong nhiều ngành công nghiệp từ hàng không, vũ trụ đến xây dựng và điện tử.
VI. Ứng Dụng Của Aluminium
Aluminium là kim loại có nhiều ứng dụng quan trọng trong đời sống và công nghiệp nhờ vào các đặc tính vật lý và hóa học đặc biệt của nó như nhẹ, bền và chống ăn mòn tốt. Dưới đây là một số ứng dụng phổ biến của aluminium:
- Ngành xây dựng: Aluminium được sử dụng rộng rãi trong sản xuất cửa sổ, cửa ra vào, mái nhà và các khung kết cấu nhờ tính bền bỉ và khả năng chống chịu với môi trường.
- Ngành hàng không và vũ trụ: Do aluminium có trọng lượng nhẹ và độ bền cao, nó được sử dụng để chế tạo thân máy bay, các bộ phận động cơ và các cấu trúc vũ trụ. Việc sử dụng aluminium giúp giảm trọng lượng tổng thể của máy bay, tăng hiệu suất và tiết kiệm nhiên liệu.
- Ngành điện tử: Aluminium được sử dụng trong sản xuất các thiết bị điện tử như vỏ điện thoại, máy tính và các linh kiện điện tử nhờ khả năng tản nhiệt tốt và trọng lượng nhẹ.
- Ngành giao thông vận tải: Xe ô tô, tàu hỏa, và xe tải đều sử dụng aluminium để giảm trọng lượng, giúp cải thiện hiệu suất và tiết kiệm nhiên liệu. Nhôm cũng giúp tăng độ an toàn nhờ tính năng chống ăn mòn.
- Đóng gói thực phẩm: Giấy nhôm được sử dụng để bảo quản thực phẩm và đồ uống nhờ khả năng giữ nguyên chất lượng thực phẩm trong thời gian dài và khả năng chịu nhiệt tốt.
- Năng lượng tái tạo: Aluminium cũng đóng vai trò trong việc chế tạo các bộ phận của pin năng lượng mặt trời và các thiết bị lưu trữ năng lượng, góp phần vào việc phát triển các nguồn năng lượng tái tạo.
Nhờ vào tính đa dụng và hiệu quả trong nhiều lĩnh vực, aluminium đã trở thành một vật liệu không thể thiếu trong các ngành công nghiệp hiện đại, đóng góp lớn vào sự phát triển bền vững và thân thiện với môi trường.
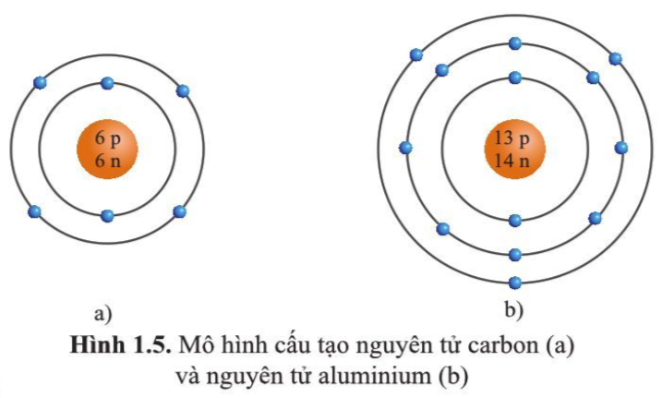
VII. Kết Luận
Nhôm (Aluminium) là một kim loại đa dụng, đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống hiện đại. Từ xây dựng, giao thông đến công nghệ cao, nhôm luôn thể hiện giá trị qua những tính chất vượt trội của nó. Với cấu trúc nguyên tử gồm 13 proton, 14 neutron và 13 electron, nhôm sở hữu các tính chất hóa học và vật lý độc đáo, như khả năng chống oxy hóa tự nhiên, tính dẫn điện và dẫn nhiệt cao, cũng như trọng lượng nhẹ.
Trong tương lai, nhôm dự kiến sẽ còn phát triển hơn nữa thông qua việc tối ưu hóa các phương pháp sản xuất và tái chế, giúp giảm thiểu tác động môi trường. Các nghiên cứu hiện tại đang tập trung vào việc cải tiến các hợp kim của nhôm để ứng dụng trong các lĩnh vực công nghệ cao như hàng không vũ trụ, y tế, và năng lượng sạch. Điều này cho thấy rằng nhôm không chỉ là vật liệu hiện tại mà còn là vật liệu của tương lai.
Nhìn chung, nhôm là một vật liệu vô cùng quan trọng, không chỉ giúp cải thiện chất lượng cuộc sống mà còn mở ra nhiều cơ hội phát triển cho các ngành công nghiệp mới. Với khả năng tái chế gần như vô hạn và sự hiện diện phổ biến trong tự nhiên, nhôm chắc chắn sẽ tiếp tục đóng góp vào sự phát triển bền vững của xã hội.

.png)