Chủ đề cách vẽ sơ đồ cấu tạo nguyên tử lớp 8: Bài viết này cung cấp hướng dẫn chi tiết về cách vẽ sơ đồ cấu tạo nguyên tử lớp 8, giúp học sinh nắm vững kiến thức cơ bản về cấu trúc nguyên tử. Từ việc xác định số lượng proton, neutron, electron đến cách sắp xếp các electron vào các lớp vỏ, tất cả đều được trình bày rõ ràng và dễ hiểu.
Mục lục
Cách Vẽ Sơ Đồ Cấu Tạo Nguyên Tử Lớp 8
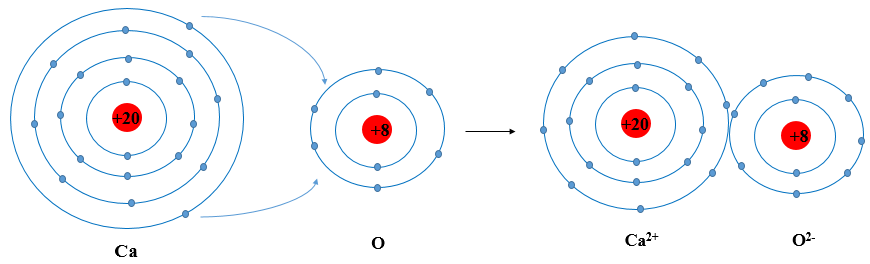
Việc vẽ sơ đồ cấu tạo nguyên tử là một phần quan trọng trong chương trình học lớp 8. Nguyên tử là đơn vị cơ bản của vật chất, và việc hiểu rõ cấu tạo của nó giúp học sinh nắm vững kiến thức cơ bản về hóa học. Sau đây là các bước và thông tin chi tiết để vẽ sơ đồ cấu tạo nguyên tử.
1. Cấu Tạo Cơ Bản Của Nguyên Tử
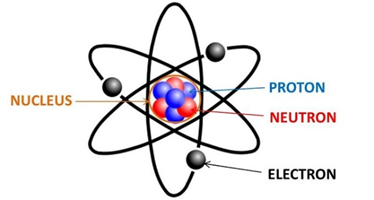
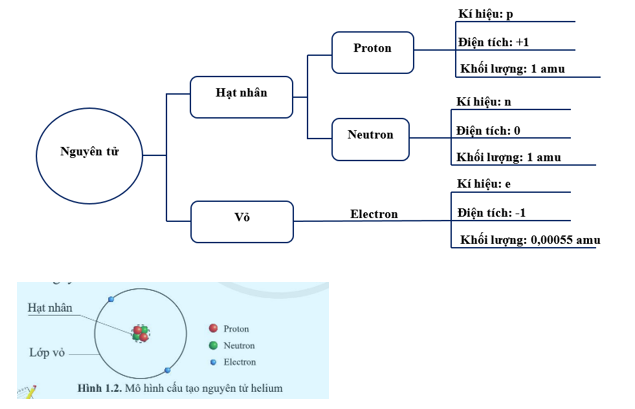
Nguyên tử bao gồm ba loại hạt cơ bản:
- Proton: Mang điện tích dương, ký hiệu là \(p\), nằm trong hạt nhân.
- Neutron: Không mang điện, ký hiệu là \(n\), cũng nằm trong hạt nhân.
- Electron: Mang điện tích âm, ký hiệu là \(e\), quay xung quanh hạt nhân trong các lớp vỏ electron.
2. Sơ Đồ Cấu Tạo Nguyên Tử
Để vẽ sơ đồ cấu tạo nguyên tử, học sinh cần tuân theo các bước sau:
- Xác định số lượng proton, neutron và electron: Số proton và electron bằng nhau trong một nguyên tử trung hòa. Số neutron có thể được tính dựa trên tổng số hạt nhân (proton + neutron).
- Vẽ hạt nhân nguyên tử: Hạt nhân chứa proton và neutron, có thể vẽ dưới dạng một hình tròn nhỏ ở giữa.
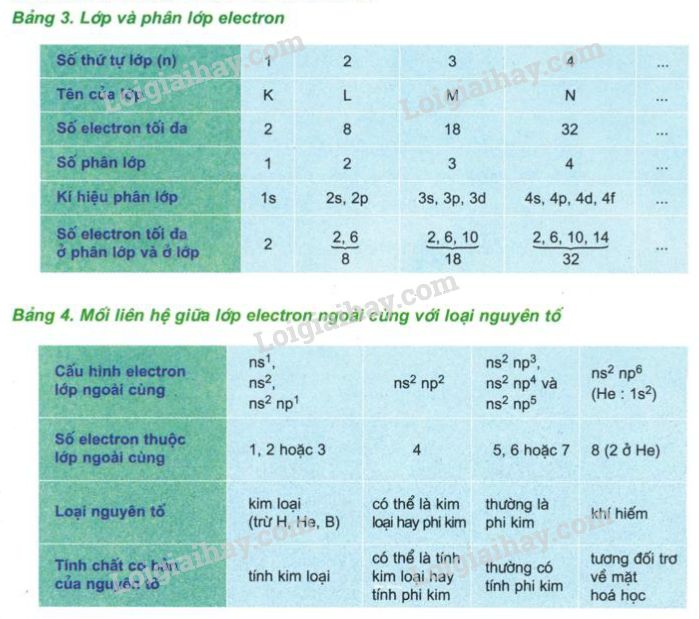
- Vẽ các lớp vỏ electron: Các electron quay xung quanh hạt nhân trong các lớp vỏ. Mỗi lớp vỏ có thể chứa một số lượng electron nhất định theo quy tắc: Lớp thứ nhất tối đa 2 electron, lớp thứ hai tối đa 8 electron, và tiếp tục theo nguyên tắc này.
- Phân bố electron vào các lớp vỏ: Sắp xếp các electron vào các lớp vỏ, bắt đầu từ lớp gần hạt nhân nhất.
3. Ví Dụ Minh Họa
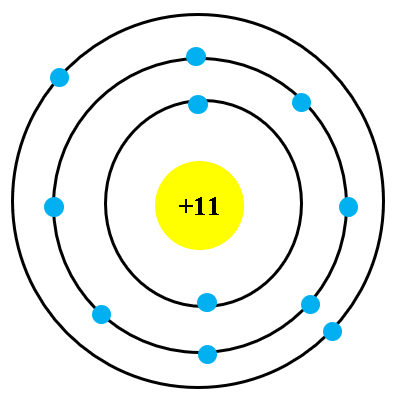
Ví dụ, vẽ sơ đồ cấu tạo của nguyên tử Natri (Na) có 11 proton, 11 electron và 12 neutron:
- Hạt nhân: Chứa 11 proton và 12 neutron.
- Lớp vỏ thứ nhất: Chứa 2 electron.
- Lớp vỏ thứ hai: Chứa 8 electron.
- Lớp vỏ thứ ba: Chứa 1 electron.
Sơ đồ vẽ sẽ có hạt nhân ở giữa và các lớp vỏ bao quanh hạt nhân, với các electron được sắp xếp theo thứ tự lớp.
4. Một Số Lưu Ý Khi Vẽ Sơ Đồ
- Chú ý phân bố chính xác số lượng electron vào các lớp vỏ.
- Lưu ý rằng số proton và electron trong nguyên tử trung hòa là bằng nhau.
- Với các nguyên tử có nhiều lớp vỏ, cần sắp xếp lớp vỏ ngoài cùng sao cho tổng số electron hợp lý với quy tắc lớp vỏ.
Việc vẽ sơ đồ cấu tạo nguyên tử không chỉ giúp học sinh nắm bắt kiến thức lý thuyết mà còn phát triển khả năng tư duy logic và trực quan.
.png)
I. Giới Thiệu Về Cấu Tạo Nguyên Tử
Cấu tạo nguyên tử là một trong những kiến thức cơ bản và quan trọng trong chương trình Hóa học lớp 8. Nguyên tử là đơn vị nhỏ nhất của vật chất, bao gồm ba thành phần chính: proton, neutron, và electron. Sự phân bố của các hạt này quyết định các tính chất vật lý và hóa học của nguyên tố.
Nguyên tử bao gồm một hạt nhân ở trung tâm, nơi tập trung hầu hết khối lượng của nguyên tử, và các electron chuyển động xung quanh trong các quỹ đạo hay lớp vỏ. Hạt nhân chứa proton, mang điện tích dương \((+)\), và neutron, không mang điện. Số lượng proton xác định nguyên tố hóa học và là số hiệu nguyên tử của nguyên tố đó.
Các electron mang điện tích âm \((-)\) và sắp xếp trong các lớp vỏ theo các mức năng lượng khác nhau. Lớp vỏ gần hạt nhân nhất chứa electron có mức năng lượng thấp nhất, trong khi các lớp vỏ xa hơn có năng lượng cao hơn. Các electron trong lớp vỏ ngoài cùng, gọi là electron hóa trị, quyết định khả năng phản ứng hóa học của nguyên tử.
Việc hiểu rõ cấu tạo của nguyên tử giúp học sinh nắm bắt dễ dàng hơn các khái niệm liên quan đến hóa trị, liên kết hóa học, và các phản ứng hóa học. Bài viết này sẽ hướng dẫn chi tiết cách vẽ sơ đồ cấu tạo nguyên tử, từ việc xác định số lượng proton, neutron, và electron, đến cách sắp xếp electron vào các lớp vỏ một cách chính xác.
II. Hướng Dẫn Vẽ Sơ Đồ Cấu Tạo Nguyên Tử
Để vẽ sơ đồ cấu tạo nguyên tử, học sinh cần thực hiện theo các bước sau đây:
- Xác định số lượng proton, neutron, và electron của nguyên tử:
- Proton: Là số hạt mang điện tích dương trong hạt nhân nguyên tử và cũng là số hiệu nguyên tử của nguyên tố đó. Ví dụ, nguyên tử của nguyên tố Hydro có 1 proton, trong khi nguyên tử của Carbon có 6 proton.
- Neutron: Là số hạt không mang điện trong hạt nhân nguyên tử. Số neutron thường xấp xỉ bằng số proton, nhưng có thể khác nhau đối với các đồng vị của nguyên tố.
- Electron: Là số hạt mang điện tích âm chuyển động quanh hạt nhân trong các lớp vỏ electron. Số electron trong một nguyên tử trung hòa sẽ bằng số proton.
- Vẽ hạt nhân nguyên tử:
- Vẽ một vòng tròn nhỏ ở trung tâm để đại diện cho hạt nhân nguyên tử.
- Ghi số lượng proton và neutron vào bên trong vòng tròn này. Ví dụ: nếu vẽ nguyên tử Carbon, bạn sẽ ghi số lượng proton là 6 và neutron là 6.
- Vẽ các lớp vỏ electron:
- Xác định số lớp vỏ electron theo số thứ tự chu kỳ của nguyên tố. Ví dụ: nguyên tử Carbon có 2 lớp vỏ electron vì nó thuộc chu kỳ 2 trong bảng tuần hoàn.
- Vẽ các vòng tròn đồng tâm xung quanh hạt nhân để đại diện cho các lớp vỏ electron.
- Sắp xếp các electron vào các lớp vỏ:
- Lớp vỏ thứ nhất chỉ chứa tối đa 2 electron.
- Lớp vỏ thứ hai và các lớp vỏ sau có thể chứa tối đa 8 electron.
- Sắp xếp electron theo đúng thứ tự năng lượng từ thấp đến cao, tức là từ lớp vỏ trong cùng ra ngoài cùng. Ví dụ: đối với nguyên tử Carbon, bạn sẽ đặt 2 electron ở lớp vỏ thứ nhất và 4 electron ở lớp vỏ thứ hai.
Với các bước trên, học sinh sẽ có thể vẽ chính xác sơ đồ cấu tạo nguyên tử cho các nguyên tố khác nhau, từ đó hiểu rõ hơn về cấu trúc của nguyên tử và tính chất hóa học của nguyên tố đó.

III. Ví Dụ Minh Họa Về Sơ Đồ Nguyên Tử
Dưới đây là một ví dụ minh họa về cách vẽ sơ đồ cấu tạo nguyên tử cho nguyên tố Carbon (C), một trong những nguyên tố phổ biến và quan trọng trong hóa học.
- Xác định số proton, neutron và electron của nguyên tử Carbon:
- Nguyên tử Carbon có 6 proton, 6 neutron và 6 electron.
- Vẽ hạt nhân nguyên tử:
- Vẽ một vòng tròn nhỏ ở trung tâm để biểu thị hạt nhân, trong đó ghi số lượng proton (6p) và neutron (6n).
- Vẽ các lớp vỏ electron:
- Carbon có 2 lớp vỏ electron. Vẽ 2 vòng tròn đồng tâm xung quanh hạt nhân để biểu thị các lớp vỏ này.
- Sắp xếp các electron vào các lớp vỏ:
- Lớp vỏ thứ nhất chứa 2 electron.
- Lớp vỏ thứ hai chứa 4 electron.
- Sơ đồ hoàn chỉnh của nguyên tử Carbon:
- Lớp vỏ thứ nhất: \(2e^-\) (2 electron).
- Lớp vỏ thứ hai: \(4e^-\) (4 electron).
- Ký hiệu tổng quát: \[ \text{C} : 1s^2 2s^2 2p^2 \]
Sơ đồ trên giúp học sinh dễ dàng hình dung cấu trúc của nguyên tử Carbon và cách sắp xếp electron trong các lớp vỏ, từ đó áp dụng cho các nguyên tố khác.

IV. Những Lưu Ý Khi Vẽ Sơ Đồ Cấu Tạo Nguyên Tử
Khi vẽ sơ đồ cấu tạo nguyên tử, cần lưu ý một số điểm quan trọng để đảm bảo tính chính xác và dễ hiểu. Dưới đây là những lưu ý mà học sinh cần ghi nhớ:
- Xác định chính xác số lượng hạt cơ bản:
- Số proton, neutron và electron cần được xác định rõ ràng dựa trên nguyên tử số và khối lượng nguyên tử của nguyên tố.
- Ví dụ, với nguyên tử Carbon (\(C\)), cần nhớ rằng nó có 6 proton, 6 neutron và 6 electron.
- Vẽ đúng thứ tự các lớp vỏ electron:
- Các lớp vỏ electron phải được vẽ theo thứ tự từ trong ra ngoài, tương ứng với mức năng lượng từ thấp đến cao.
- Ví dụ: Lớp K (gần hạt nhân nhất) chứa tối đa 2 electron, lớp L chứa tối đa 8 electron.
- Biểu diễn electron đúng cách:
- Electron thường được biểu diễn bằng dấu chấm (\(\cdot\)) hoặc vòng tròn nhỏ trên các lớp vỏ. Hãy đảm bảo rằng số electron ở mỗi lớp vỏ được thể hiện đầy đủ.
- Chú ý đến sự cân bằng giữa các hạt:
- Trong một nguyên tử trung hòa, số proton luôn bằng số electron. Hãy kiểm tra lại để đảm bảo sự cân bằng này khi vẽ sơ đồ.
- Đảm bảo tính thẩm mỹ và dễ hiểu:
- Sơ đồ cần được vẽ rõ ràng, cân đối, các ký hiệu dễ đọc và sắp xếp hợp lý để người xem dễ dàng hiểu được cấu trúc của nguyên tử.
Những lưu ý trên sẽ giúp học sinh vẽ sơ đồ cấu tạo nguyên tử một cách chính xác và khoa học, hỗ trợ tốt cho việc học tập và nghiên cứu về cấu trúc nguyên tử.

V. Ứng Dụng Của Sơ Đồ Nguyên Tử Trong Học Tập
Sơ đồ cấu tạo nguyên tử không chỉ là một công cụ trực quan giúp học sinh hiểu rõ hơn về cấu trúc của nguyên tử mà còn mang lại nhiều ứng dụng thiết thực trong quá trình học tập.
- Tăng cường khả năng ghi nhớ và hiểu bài:
- Việc vẽ và quan sát sơ đồ giúp học sinh ghi nhớ các thành phần của nguyên tử như proton, neutron, và electron một cách dễ dàng hơn.
- Học sinh có thể liên hệ trực tiếp giữa lý thuyết và hình ảnh minh họa, giúp nâng cao hiệu quả học tập.
- Giúp học sinh phát triển tư duy logic:
- Sơ đồ nguyên tử yêu cầu học sinh sắp xếp và phân tích các thành phần theo một trình tự hợp lý, từ đó rèn luyện tư duy logic và khả năng phân tích.
- Ứng dụng trong giải bài tập hóa học:
- Trong các bài tập liên quan đến cấu tạo nguyên tử, sơ đồ giúp học sinh dễ dàng xác định số lượng các hạt cơ bản, cũng như hiểu rõ cách thức mà các electron sắp xếp trên các lớp vỏ.
- Sơ đồ cũng hỗ trợ học sinh trong việc giải các bài tập liên quan đến sự thay đổi cấu trúc nguyên tử khi các nguyên tố tham gia phản ứng hóa học.
- Hỗ trợ học sinh chuẩn bị cho các kỳ thi:
- Sơ đồ cấu tạo nguyên tử là một phần quan trọng trong chương trình hóa học lớp 8 và xuất hiện thường xuyên trong các kỳ thi. Nắm vững kỹ năng vẽ và phân tích sơ đồ giúp học sinh tự tin hơn trong việc làm bài thi.
Nhờ những ứng dụng trên, sơ đồ cấu tạo nguyên tử trở thành một công cụ học tập không thể thiếu, giúp học sinh tiếp cận kiến thức một cách toàn diện và hiệu quả.
XEM THÊM:
VI. Kết Luận
Qua quá trình học tập và thực hành, vẽ sơ đồ cấu tạo nguyên tử không chỉ giúp học sinh nắm bắt được kiến thức cơ bản về hóa học mà còn rèn luyện tư duy logic và khả năng phân tích. Sơ đồ nguyên tử là một công cụ mạnh mẽ trong việc học, giúp hiểu rõ hơn về cấu trúc và sự hoạt động của các nguyên tố hóa học.
Việc thành thạo kỹ năng này không chỉ hỗ trợ học sinh trong các kỳ thi mà còn giúp xây dựng nền tảng vững chắc cho các môn học liên quan trong tương lai. Bằng cách kết hợp lý thuyết với thực hành, học sinh sẽ có cơ hội tiếp cận kiến thức một cách sâu sắc và toàn diện hơn.

.png)