Chủ đề cấu tạo nguyên tử lithium: Cấu tạo nguyên tử Lithium là một chủ đề quan trọng trong hóa học và vật lý, đặc biệt khi nghiên cứu về các kim loại kiềm. Bài viết này sẽ giúp bạn hiểu rõ về cấu hình electron, tính chất vật lý và hóa học của Lithium, đồng thời khám phá các ứng dụng thiết thực trong công nghiệp và đời sống. Hãy cùng khám phá nguyên tố đặc biệt này và những vai trò quan trọng của nó.
Mục lục
Cấu tạo nguyên tử Lithium
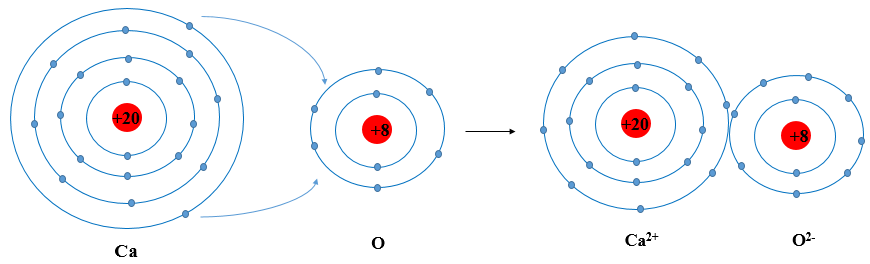
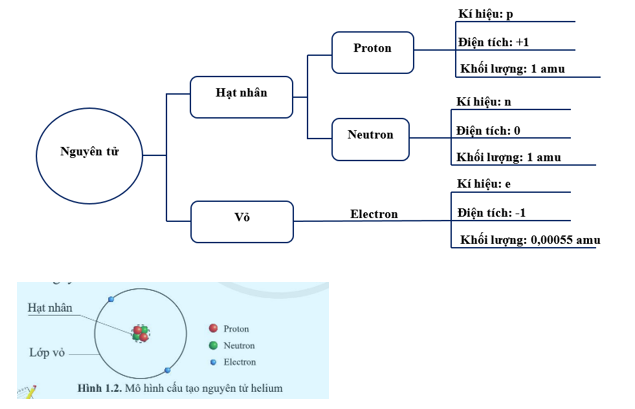
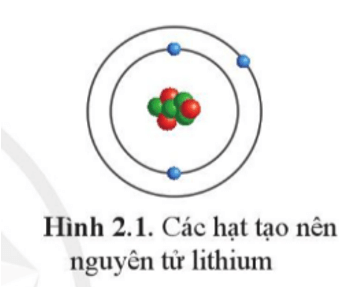
Nguyên tử Lithium (Li) là một trong những nguyên tố hóa học thuộc nhóm kim loại kiềm, có số nguyên tử là 3. Đây là kim loại nhẹ nhất và có nhiều ứng dụng quan trọng trong công nghiệp và y tế. Để hiểu rõ hơn về cấu tạo nguyên tử của Lithium, chúng ta sẽ xem xét các yếu tố như cấu hình electron, số lượng proton, neutron và các tính chất hóa học, vật lý đặc trưng.
Cấu hình electron của Lithium
Lithium có tổng cộng 3 electron. Cấu hình electron của Lithium là \(1s^2 2s^1\). Điều này có nghĩa là:
- Lớp vỏ đầu tiên chứa 2 electron.
- Lớp vỏ thứ hai chứa 1 electron, đây là lớp vỏ hóa trị.
Vì có 1 electron ở lớp ngoài cùng, Lithium có tính chất hóa học của một kim loại kiềm, dễ dàng mất đi electron này để tạo thành ion \(Li^+\).
Số lượng proton và neutron
Nguyên tử Lithium có:
- 3 proton trong hạt nhân (bằng với số nguyên tử).
- Số neutron phụ thuộc vào đồng vị. Đồng vị phổ biến nhất của Lithium là 7Li, có 4 neutron (7 - 3 = 4).
Hạt nhân của Lithium bao gồm 3 proton và thường là 4 neutron, tạo thành đồng vị Lithium-7 (7Li). Ngoài ra, còn có đồng vị Lithium-6 (6Li) với 3 neutron.
Cấu trúc tinh thể của Lithium
Lithium có cấu trúc tinh thể cubic góc cạnh, các nguyên tử được xếp chồng lên nhau theo một mạng lưới đều đặn. Điều này tạo nên các tính chất vật lý đặc trưng như độ mềm, dẻo và khả năng dẫn điện tốt.
Tính chất hóa học của Lithium
Lithium là một kim loại có tính khử rất mạnh, dễ dàng phản ứng với nước, không khí, và các phi kim khác để tạo thành các hợp chất ion. Một số phản ứng hóa học tiêu biểu của Lithium bao gồm:
- Phản ứng với nước: Lithium phản ứng với nước để tạo ra Lithium hydroxide (LiOH) và giải phóng khí hydro (H2).
- Phản ứng với oxy: Khi đốt trong không khí, Lithium cháy với ngọn lửa màu đỏ và tạo thành Lithium oxide (Li2O).
- Phản ứng với halogen: Lithium tác dụng với halogen (như Cl2, Br2) để tạo thành các muối Lithium halide (LiX).
Ứng dụng của Lithium
Lithium được ứng dụng rộng rãi trong nhiều lĩnh vực:
- Công nghiệp pin: Lithium-ion là loại pin phổ biến nhất hiện nay, được sử dụng trong điện thoại di động, máy tính xách tay, xe điện và hệ thống lưu trữ năng lượng.
- Y tế: Lithium carbonate được sử dụng trong điều trị các rối loạn tâm thần như bệnh thần kinh loạn thần, rối loạn lưỡng cực.
- Hợp kim: Lithium được dùng trong hợp kim với nhôm để tạo ra các vật liệu nhẹ, bền, sử dụng trong ngành hàng không vũ trụ.
- Điện tử: Sử dụng trong các thiết bị điện tử như mạch tích hợp, pin và các bộ xử lý nhỏ gọn.
Kết luận
Nguyên tử Lithium với cấu tạo đơn giản và các tính chất hóa học độc đáo đã trở thành một yếu tố quan trọng trong nhiều ngành công nghiệp hiện đại. Những đặc tính vật lý và hóa học của nó giúp tạo ra nhiều ứng dụng đa dạng và giá trị cho cuộc sống con người.

.png)
1. Giới thiệu về Nguyên tố Lithium
Lithium (ký hiệu hóa học: Li) là nguyên tố hóa học đứng thứ ba trong bảng tuần hoàn, thuộc nhóm kim loại kiềm. Đây là kim loại nhẹ nhất và mềm nhất, với khối lượng nguyên tử là 6,94. Nguyên tố này được phát hiện vào năm 1817 bởi nhà hóa học Johan August Arfvedson khi ông nghiên cứu khoáng chất petalite.
Trong tự nhiên, Lithium tồn tại chủ yếu dưới dạng hợp chất trong các khoáng chất như spodumene, lepidolite, và petalite. Với tính chất hóa học đặc biệt, Lithium có khả năng phản ứng mạnh với nước và các phi kim khác, giúp nó trở thành một kim loại có tính khử rất mạnh.
- Tính chất vật lý: Lithium có màu trắng bạc, độ mềm cao và có thể cắt được bằng dao. Điểm nóng chảy của Lithium là khoảng 180,5°C và điểm sôi là 1342°C.
- Tính chất hóa học: Lithium có khả năng phản ứng mạnh với nước để tạo thành hydroxide và khí hydro. Nó cũng dễ dàng phản ứng với oxy trong không khí để tạo ra Lithium oxide.
Lithium là một nguyên tố quan trọng với nhiều ứng dụng trong đời sống và công nghiệp, từ sản xuất pin Lithium-ion, vật liệu chế tạo trong ngành hàng không vũ trụ, đến các ứng dụng y tế trong điều trị bệnh tâm thần. Sự quan trọng của Lithium trong công nghệ hiện đại ngày càng được khẳng định qua các nghiên cứu và ứng dụng ngày càng đa dạng.
2. Cấu tạo Nguyên tử Lithium
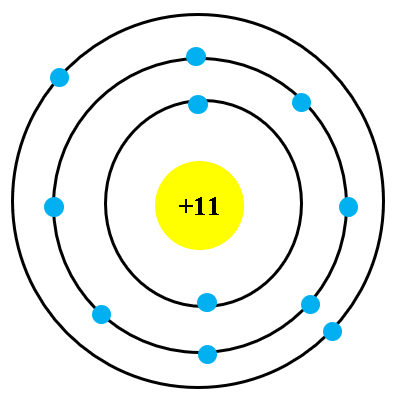
Nguyên tử lithium, ký hiệu hóa học là Li, là nguyên tố thuộc nhóm kim loại kiềm trong bảng tuần hoàn. Nguyên tử lithium có số nguyên tử là 3, nghĩa là trong hạt nhân của nó chứa 3 proton. Cấu trúc điện tử của lithium gồm 3 electron được phân bổ trong hai lớp vỏ, với cấu hình electron là \(1s^2 2s^1\).
Hạt nhân của nguyên tử lithium chứa 3 proton và thường có 3 hoặc 4 neutron, tùy thuộc vào loại đồng vị. Hai đồng vị phổ biến nhất của lithium là 6Li và 7Li, trong đó đồng vị 7Li chiếm tỉ lệ cao hơn, khoảng 92.5%. Các proton và neutron trong hạt nhân được giữ chặt với nhau nhờ lực tương tác mạnh.
- Số proton: 3
- Số neutron: 3 hoặc 4 (tùy vào đồng vị)
- Số electron: 3 (phân bổ trong hai lớp vỏ: 2 electron ở lớp \(1s\), 1 electron ở lớp \(2s\))
Các phương pháp tính toán lượng tử, như phương pháp Hartree-Fock, có thể được sử dụng để ước lượng năng lượng trạng thái cơ bản và hàm sóng của nguyên tử lithium. Do có số proton và neutron nhỏ, nguyên tử lithium có kích thước tương đối nhỏ so với các nguyên tố khác, nhưng có tính chất dẫn điện và dẫn nhiệt tốt.
Lithium là một nguyên tố hóa học có hoạt tính cao và có khả năng tác dụng mạnh với nhiều chất khác, bao gồm cả phi kim và các axit. Trong điều kiện áp suất lớn và nhiệt độ cao, lithium có thể kết hợp với hydrogen để tạo thành lithium hydride, một hợp chất quan trọng trong nhiều ứng dụng công nghiệp.

3. Tính Chất Hóa Học của Lithium
Lithium là một kim loại kiềm có hoạt tính hóa học rất cao, đặc biệt là trong các phản ứng với nước, không khí, và nhiều hợp chất khác. Nhờ vào tính chất này, lithium có nhiều ứng dụng quan trọng trong công nghiệp và khoa học. Dưới đây là một số tính chất hóa học nổi bật của lithium:
- Phản ứng với nước: Lithium phản ứng mạnh với nước ở nhiệt độ phòng để tạo thành lithium hydroxide (\(LiOH\)) và giải phóng khí hydro (\(H_2\)). Phản ứng này được biểu diễn như sau: \[2Li + 2H_2O \rightarrow 2LiOH + H_2\uparrow\] Do giải phóng khí hydro dễ cháy, phản ứng này có thể gây nổ trong điều kiện kín hoặc khi có nguồn nhiệt lớn.
- Phản ứng với không khí: Khi tiếp xúc với không khí, lithium phản ứng với oxy để tạo ra lithium oxide (\(Li_2O\)), tạo thành một lớp màng bảo vệ bề mặt kim loại khỏi sự oxy hóa tiếp theo: \[4Li + O_2 \rightarrow 2Li_2O\] Ngoài ra, lithium cũng có thể phản ứng với nitơ (\(N_2\)) trong không khí để tạo thành lithium nitride (\(Li_3N\)): \[6Li + N_2 \rightarrow 2Li_3N\]
- Phản ứng với halogen: Lithium dễ dàng phản ứng với các halogen (F, Cl, Br, I) để tạo ra muối lithium halide (\(LiX\)). Ví dụ, phản ứng với chlorine: \[2Li + Cl_2 \rightarrow 2LiCl\] Lithium chloride (\(LiCl\)) là một muối ion có độ tan tốt trong nước và được sử dụng trong sản xuất lithium kim loại và các hợp chất lithium khác.
- Tác dụng với axit: Lithium phản ứng mạnh với các axit, như axit hydrochloric (\(HCl\)), để tạo ra khí hydro và muối lithium: \[2Li + 2HCl \rightarrow 2LiCl + H_2\uparrow\]
- Khả năng khử mạnh: Lithium là một chất khử mạnh, có thể phản ứng với nhiều chất oxy hóa để tạo thành các hợp chất khác nhau. Do tính chất này, lithium được sử dụng trong pin lithium-ion và nhiều ứng dụng công nghệ cao khác.
Tính chất hóa học của lithium đã làm cho nó trở thành một nguyên tố quan trọng trong nhiều lĩnh vực công nghiệp và công nghệ, từ sản xuất pin, gốm sứ, thủy tinh cho đến các ứng dụng y tế.
XEM THÊM:
4. Ứng Dụng của Lithium trong Công Nghiệp và Đời Sống
Lithium (Li) là một nguyên tố hóa học với nhiều ứng dụng quan trọng trong đời sống và công nghiệp. Dưới đây là một số ứng dụng tiêu biểu của lithium:
- Ứng dụng trong sản xuất pin: Lithium là thành phần chính trong pin lithium-ion, được sử dụng rộng rãi trong các thiết bị điện tử như điện thoại di động, máy tính xách tay, và đặc biệt là xe điện. Nhờ khả năng lưu trữ năng lượng cao, pin lithium-ion có độ bền và hiệu suất vượt trội.
- Ứng dụng trong y học: Các hợp chất lithium được sử dụng để điều trị rối loạn tâm thần, đặc biệt là chứng rối loạn lưỡng cực. Lithium giúp ổn định tâm trạng và giảm triệu chứng bệnh, góp phần cải thiện chất lượng cuộc sống của người bệnh.
- Ứng dụng trong hợp kim: Lithium được sử dụng trong việc sản xuất hợp kim nhôm-lithium, giúp cải thiện độ bền và giảm trọng lượng. Các hợp kim này được áp dụng nhiều trong ngành công nghiệp hàng không vũ trụ để sản xuất máy bay nhẹ hơn nhưng bền vững hơn.
- Ứng dụng trong công nghệ hạt nhân: Lithium có khả năng hấp thụ neutron, do đó nó được sử dụng trong các lò phản ứng hạt nhân. Các đồng vị lithium được ứng dụng trong các quá trình nghiên cứu và phát triển công nghệ năng lượng hạt nhân.
- Ứng dụng trong hóa học: Lithium đóng vai trò là chất xúc tác và chất khử trong nhiều phản ứng hóa học. Nó được sử dụng để tạo ra nhiều hợp chất hóa học khác nhau, từ đó giúp thúc đẩy các quy trình sản xuất trong công nghiệp hóa chất.
- Ứng dụng trong công nghiệp dược phẩm: Lithium cũng được sử dụng để sản xuất một số loại dược phẩm và hợp chất chống cháy, góp phần bảo vệ môi trường và sức khỏe cộng đồng.
Nhờ vào những tính chất vật lý và hóa học đặc biệt, lithium ngày càng trở thành một nguyên tố không thể thiếu trong nhiều lĩnh vực của đời sống và công nghiệp, đặc biệt là trong các ngành công nghệ cao và năng lượng tái tạo.

5. Các Phương Pháp Điều Chế Lithium
Lithium là một kim loại quan trọng được sử dụng rộng rãi trong nhiều lĩnh vực công nghiệp. Điều chế lithium từ các nguồn tự nhiên thường đòi hỏi các phương pháp chuyên biệt để tách nguyên tố này từ các hợp chất hoặc quặng chứa lithium. Dưới đây là một số phương pháp phổ biến nhất để điều chế lithium:
- Điện phân nóng chảy: Đây là phương pháp chính để sản xuất lithium kim loại từ lithium chloride (LiCl) hoặc hỗn hợp lithium chloride và potassium chloride (KCl). Quá trình diễn ra ở nhiệt độ cao (450-500°C) trong buồng điện phân với điện cực graphite.
- Chuẩn bị nguyên liệu: Lithium chloride tinh khiết được hòa tan và làm nóng chảy.
- Điện phân: Sử dụng dòng điện một chiều, ion \(Li^+\) tại cực âm (cathode) bị khử thành lithium kim loại.
Phương trình tại cathode: \[ \text{Li}^+ + e^- \rightarrow \text{Li} \]
Phương trình tại anode: \[ 2\text{Cl}^- \rightarrow \text{Cl}_2 + 2e^- \] - Thu hồi: Lithium kim loại được tách ra và làm sạch.
- Khai thác từ quặng: Lithium có thể được tìm thấy trong các khoáng vật như spodumene, petalite, và lepidolite. Phương pháp này bao gồm:
- Nung chảy quặng ở nhiệt độ cao để giải phóng lithium từ cấu trúc tinh thể.
- Chiết xuất và tinh chế lithium qua các phản ứng hóa học phức tạp.
- Tách từ nước muối: Nước muối là nguồn lithium phổ biến, đặc biệt tại các mỏ muối ở Nam Mỹ.
- Bốc hơi nước để tăng nồng độ lithium trong dung dịch.
- Tách lithium bằng phương pháp kết tủa hoặc trao đổi ion.
Những phương pháp này giúp thu được lithium tinh khiết, tối ưu hóa quá trình sản xuất và giảm thiểu chi phí cũng như tác động môi trường. Sản phẩm cuối cùng là lithium kim loại hoặc các hợp chất lithium dùng trong nhiều ứng dụng công nghiệp như pin lithium-ion, hợp kim và các sản phẩm hóa học khác.
6. Tác Động Môi Trường và Sức Khỏe của Lithium
Việc khai thác và sử dụng lithium mang lại nhiều lợi ích cho công nghiệp hiện đại, đặc biệt là trong sản xuất pin xe điện và các thiết bị điện tử. Tuy nhiên, quá trình này cũng gây ra một số tác động tiêu cực đến môi trường và sức khỏe con người.
Tác Động Môi Trường
- Mất Cân Bằng Hệ Sinh Thái: Khai thác lithium ở các khu vực như sa mạc Atacama, Chile đã gây ra nhiều hệ lụy nghiêm trọng. Việc tiêu thụ lượng nước lớn để chiết xuất lithium làm cạn kiệt nguồn nước tự nhiên, gây ra thiệt hại đáng kể cho hệ sinh thái địa phương, đặc biệt là các loài động vật đặc hữu như hồng hạc ở vùng núi Andes.
- Ô Nhiễm Đất và Nước: Trong quá trình khai thác, các hóa chất như axit sulfuric được sử dụng để chiết xuất lithium từ quặng, làm ô nhiễm nguồn nước ngầm và đất xung quanh khu vực khai thác. Điều này không chỉ ảnh hưởng đến môi trường mà còn đe dọa đến sức khỏe của các cộng đồng sinh sống gần đó.
- Phá Hủy Môi Trường Sống: Khai thác lithium quy mô lớn đòi hỏi phá rừng và đào xới các vùng đất rộng lớn, dẫn đến sự mất mát của các hệ sinh thái tự nhiên và giảm đa dạng sinh học.
Tác Động Đến Sức Khỏe Con Người
- Ảnh Hưởng Đến Hệ Hô Hấp: Người lao động trong các mỏ khai thác lithium có thể tiếp xúc với bụi và hóa chất gây hại, dẫn đến các vấn đề về hô hấp như viêm phổi hoặc các bệnh phổi mãn tính.
- Nguy Cơ Ngộ Độc: Lithium khi thâm nhập vào nguồn nước uống hoặc thực phẩm có thể gây ra ngộ độc, với các triệu chứng như buồn nôn, nôn, tiêu chảy và thậm chí nguy cơ tử vong khi tiếp xúc ở mức độ cao.
Biện Pháp Giảm Thiểu Tác Động
- Cải Tiến Công Nghệ Khai Thác: Sử dụng công nghệ khai thác thân thiện với môi trường hơn, giảm lượng nước và hóa chất cần thiết trong quá trình chiết xuất lithium.
- Tăng Cường Giám Sát Môi Trường: Thiết lập các tiêu chuẩn và quy định nghiêm ngặt về bảo vệ môi trường trong hoạt động khai thác, đồng thời thực hiện các biện pháp giám sát liên tục để đảm bảo tuân thủ.
- Phát Triển Nguồn Năng Lượng Thay Thế: Tìm kiếm và phát triển các loại pin thay thế, như pin natri-ion, để giảm sự phụ thuộc vào lithium và giảm tác động môi trường từ khai thác.
Nhìn chung, mặc dù lithium đóng vai trò quan trọng trong việc phát triển công nghệ và bảo vệ môi trường thông qua việc giảm thiểu phát thải CO2, việc khai thác và sử dụng nó cần phải được quản lý chặt chẽ để giảm thiểu những tác động tiêu cực đến môi trường và sức khỏe con người.
7. Kết Luận
Nguyên tố Lithium, với những đặc điểm độc đáo trong cấu tạo nguyên tử và tính chất hóa học, đã chứng tỏ tầm quan trọng vượt trội trong nhiều lĩnh vực khác nhau của khoa học và công nghệ. Sự hiện diện của Lithium không chỉ đơn thuần là một nguyên tố hóa học mà còn là chìa khóa để mở ra nhiều ứng dụng tiên tiến, từ sản xuất pin Lithium-ion đến các lĩnh vực y tế và công nghiệp hàng không.
Trong tương lai, với sự phát triển không ngừng của công nghệ, Lithium hứa hẹn sẽ tiếp tục đóng vai trò quan trọng trong việc thúc đẩy những đột phá mới. Các phương pháp điều chế và tái chế Lithium cũng sẽ được tối ưu hóa để giảm thiểu tác động đến môi trường, đồng thời đảm bảo sự bền vững cho nguồn tài nguyên quý giá này.
Tóm lại, Lithium không chỉ là một nguyên tố quan trọng trong bảng tuần hoàn, mà còn là một yếu tố không thể thiếu trong sự phát triển của nền công nghiệp hiện đại. Sự kết hợp giữa tính chất độc đáo của nó với các ứng dụng rộng rãi trong đời sống và khoa học đã khẳng định vị trí của Lithium như một nguyên tố có giá trị chiến lược trong thế kỷ 21.


.png)