Chủ đề nh3 electron geometry: Khám phá chi tiết về NH3 electron geometry - từ cấu trúc phân tử đến hình học electron của amoniac. Bài viết này cung cấp một cái nhìn toàn diện về cách NH3 hình thành, lai hóa, và ảnh hưởng đến tính chất hóa học, giúp bạn nắm vững các kiến thức cần thiết trong lĩnh vực hóa học.
Mục lục
- Cấu trúc và Hình học electron của NH3
- 1. Giới thiệu về Cấu trúc Electron của NH3
- 2. Cấu trúc Lewis của NH3
- 3. Hình học Phân tử của NH3
- 4. Lai hóa của Nguyên tử Nitơ trong NH3
- 5. Độ Phân cực của Phân tử NH3
- 6. Ứng dụng và Tầm quan trọng của NH3 trong Hóa học
- 7. Tổng kết về Cấu trúc và Hình học Electron của NH3
Cấu trúc và Hình học electron của NH3
Cấu trúc electron của phân tử NH3 (amoniac) là một chủ đề quan trọng trong hóa học, đặc biệt khi nghiên cứu về liên kết hóa học và hình học phân tử. Dưới đây là một số thông tin chi tiết về cấu trúc và hình học electron của NH3.
1. Cấu trúc Lewis của NH3
Công thức Lewis của NH3 được biểu diễn như sau:
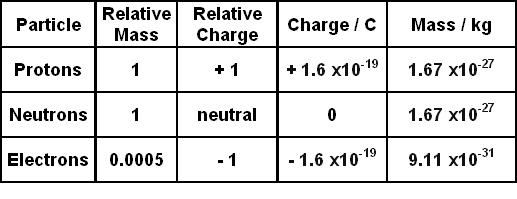
- Nitơ (N) là nguyên tử trung tâm với 5 electron hóa trị.
- Ba nguyên tử Hydro (H) mỗi cái có 1 electron hóa trị.
- Trong phân tử NH3, Nitơ tạo ba liên kết đơn với ba nguyên tử Hydro.
- Còn lại một cặp electron tự do (lone pair) trên nguyên tử Nitơ.
Công thức Lewis của NH3 có thể được biểu diễn như sau:
\[ \text{H-N-H} \] với một cặp electron tự do nằm ở trên cùng của nguyên tử Nitơ.
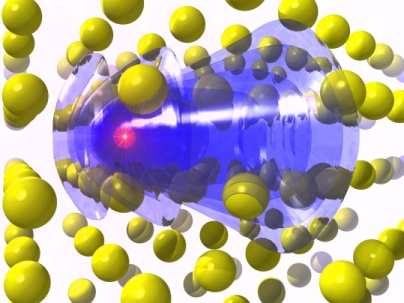
2. Hình học phân tử của NH3
Theo lý thuyết VSEPR, cấu trúc hình học của NH3 là hình chóp tam giác (trigonal pyramidal). Nguyên nhân là do:
- Cặp electron tự do trên nguyên tử Nitơ tạo ra lực đẩy mạnh hơn so với các cặp electron liên kết, làm giảm góc liên kết giữa các nguyên tử Hydro.
- Góc liên kết H-N-H trong NH3 là khoảng 107° thay vì góc lý tưởng 109.5° của một tứ diện hoàn hảo.
Hình học electron của NH3 là hình tứ diện (tetrahedral), với một cặp electron tự do và ba cặp liên kết.
3. Lai hóa và Độ phân cực của NH3
Nitơ trong NH3 có sự lai hóa sp3:
- Số lượng electron xung quanh Nitơ: 1 cặp electron tự do và 3 liên kết đơn với Hydro, tổng cộng là 4 vùng mật độ electron.
- Lai hóa sp3 xảy ra khi một orbital s và ba orbital p kết hợp với nhau, tạo ra bốn orbital lai hóa có cùng mức năng lượng.
Về độ phân cực, NH3 là một phân tử phân cực do sự phân bố không đối xứng của các electron, tạo ra một mômen lưỡng cực dương trên Nitơ và âm trên các nguyên tử Hydro.
4. Tóm tắt về Hình học và Cấu trúc electron của NH3
- Cấu trúc Lewis: N có một cặp electron tự do và ba liên kết đơn với H.
- Hình học phân tử: Hình chóp tam giác (trigonal pyramidal).
- Hình học electron: Hình tứ diện (tetrahedral).
- Lai hóa: sp3.
- Độ phân cực: NH3 là một phân tử phân cực.
 3" style="object-fit:cover; margin-right: 20px;" width="760px" height="428">
3" style="object-fit:cover; margin-right: 20px;" width="760px" height="428">.png)
1. Giới thiệu về Cấu trúc Electron của NH3
Ammoniac (NH3) là một hợp chất vô cơ phổ biến, được sử dụng rộng rãi trong các ngành công nghiệp như sản xuất phân bón và hóa chất. Cấu trúc electron của phân tử này đóng vai trò quan trọng trong việc xác định các tính chất hóa học và vật lý của nó.
Phân tử NH3 gồm một nguyên tử nitơ (N) ở trung tâm liên kết với ba nguyên tử hydro (H) thông qua ba liên kết đơn. Nitơ có năm electron ở lớp vỏ ngoài cùng, trong đó ba electron được chia sẻ với các nguyên tử hydro để tạo thành liên kết cộng hóa trị. Cặp electron còn lại không tham gia vào liên kết được gọi là cặp electron không chia (lone pair).
Theo lý thuyết đẩy cặp electron vỏ hóa trị (VSEPR), các cặp electron này cố gắng xa nhau nhất có thể để giảm thiểu lực đẩy giữa chúng. Trong NH3, điều này dẫn đến cấu trúc hình học phân tử là hình chóp tam giác (trigonal pyramidal), với góc liên kết giữa các nguyên tử H-N-H khoảng 107 độ. Góc này nhỏ hơn góc lý thuyết của một tứ diện lý tưởng (109,5 độ) do ảnh hưởng của cặp electron không chia đẩy các cặp liên kết mạnh hơn.
Việc hiểu rõ cấu trúc electron của NH3 không chỉ giúp giải thích hình học phân tử mà còn quan trọng để hiểu về độ phân cực và các tính chất hóa học khác của nó. Nitơ trong NH3 trải qua quá trình lai hóa sp3, kết hợp một orbital s và ba orbital p để tạo ra bốn orbital lai hóa, giúp tạo thành ba liên kết N-H và một cặp electron không chia.
2. Cấu trúc Lewis của NH3
Cấu trúc Lewis của NH3 (amoniac) thể hiện cách mà các electron được phân bố trong phân tử này, qua đó giúp chúng ta hiểu rõ hơn về hình dạng và tính chất của nó.
- Xác định số electron hóa trị:
Trong phân tử NH3, nguyên tử Nitơ (N) có 5 electron hóa trị, còn mỗi nguyên tử Hydro (H) có 1 electron hóa trị. Do đó, tổng số electron hóa trị trong phân tử NH3 là 8.
- Đặt nguyên tử trung tâm:
Nitơ (N) sẽ là nguyên tử trung tâm vì nó có nhiều khả năng tạo liên kết nhất. Các nguyên tử Hydro (H) được đặt xung quanh nguyên tử Nitơ.
- Hình thành liên kết:
Ba liên kết đơn được hình thành giữa nguyên tử N và ba nguyên tử H, sử dụng tổng cộng 6 electron. Mỗi liên kết N-H sử dụng 2 electron, tạo ra ba cặp electron dùng chung.
- Cặp electron không liên kết:
Sau khi tạo các liên kết N-H, còn lại 2 electron không liên kết trên nguyên tử Nitơ. Cặp electron này nằm ở phía trên cùng của cấu trúc, góp phần tạo nên hình dạng chóp tam giác của phân tử.
- Cấu trúc Lewis:
Công thức Lewis của NH3 có thể được biểu diễn như sau:
H
|
H-N-H
|
H
(Dấu chấm đại diện cho cặp electron không liên kết)
Cấu trúc Lewis này giúp giải thích tại sao NH3 có dạng hình học là chóp tam giác và có tính chất phân cực rõ rệt, điều này quan trọng trong nhiều phản ứng hóa học của NH3.

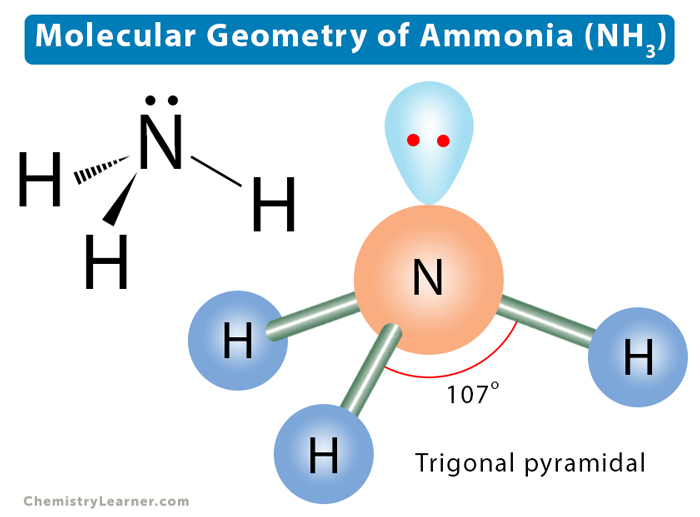
3. Hình học Phân tử của NH3
Phân tử NH3 (amoniac) có hình học phân tử dạng tháp tam giác, với nguyên tử nitơ (N) ở đỉnh và ba nguyên tử hydro (H) tạo thành đế tam giác. Hình dạng này được xác định dựa trên lý thuyết VSEPR (Valence Shell Electron Pair Repulsion), tức lý thuyết đẩy cặp electron hóa trị.
Trong cấu trúc của NH3, nguyên tử nitơ có 5 electron hóa trị, trong đó 3 electron được sử dụng để tạo liên kết với ba nguyên tử hydro, còn lại một cặp electron không liên kết (cặp đơn). Cặp đơn này làm cho các cặp electron liên kết với các nguyên tử hydro bị đẩy xuống dưới, tạo ra hình dạng tháp tam giác.
Góc liên kết H-N-H trong NH3 là khoảng 107 độ, nhỏ hơn so với góc 109.5 độ của hình tứ diện đều. Sự chênh lệch này là do lực đẩy lớn hơn giữa cặp electron không liên kết và các cặp electron liên kết.
Nhờ vào hình học tháp tam giác, phân tử NH3 có tính phân cực cao, với nguyên tử nitơ mang điện tích âm một phần và các nguyên tử hydro mang điện tích dương một phần. Điều này dẫn đến các tính chất hóa học đặc trưng của NH3, như khả năng hòa tan tốt trong nước và tạo liên kết hydro với các phân tử khác.
XEM THÊM:
4. Lai hóa của Nguyên tử Nitơ trong NH3
Trong phân tử NH3 (amoniac), nguyên tử nitơ trải qua quá trình lai hóa sp3. Điều này có nghĩa là một orbital 2s và ba orbital 2p của nitơ đã kết hợp với nhau để tạo thành bốn orbital lai hóa sp3 có cùng mức năng lượng. Ba trong số bốn orbital này chứa các cặp electron liên kết với ba nguyên tử hydro, trong khi orbital thứ tư chứa cặp electron chưa liên kết (cặp electron tự do).
Do cặp electron tự do này chiếm nhiều không gian hơn so với các cặp electron liên kết, hình dạng phân tử NH3 không phải là hình tứ diện đều mà bị biến dạng thành hình tháp tam giác (trigonal pyramidal). Góc liên kết H-N-H trong NH3 đo được là khoảng 107°, nhỏ hơn so với góc 109,5° của một tứ diện lý tưởng. Sự giảm góc này là do sự đẩy mạnh hơn giữa cặp electron tự do và các cặp electron liên kết.
Quá trình lai hóa sp3 trong NH3 không chỉ xác định hình dạng phân tử mà còn ảnh hưởng đến các tính chất hóa học của nó, bao gồm khả năng liên kết và tính phân cực. Việc hiểu rõ về lai hóa sp3 trong NH3 giúp giải thích tại sao phân tử này có thể tham gia vào các phản ứng hóa học với tư cách là một base Lewis, nhờ vào cặp electron tự do dễ dàng tấn công các chất nhận electron.

5. Độ Phân cực của Phân tử NH3
Phân tử NH3 là một phân tử có độ phân cực, điều này xuất phát từ hình học không đối xứng và sự khác biệt trong độ âm điện giữa nguyên tử nitơ và các nguyên tử hydro. Nitơ có độ âm điện là 3.04, trong khi đó, hydro có độ âm điện là 2.2. Sự khác biệt này tạo ra các liên kết N-H có tính phân cực.
Do cấu trúc hình học của NH3 là hình chóp tam giác, với cặp electron đơn lẻ trên nguyên tử nitơ, các liên kết N-H không phân bố đồng đều trong không gian. Điều này dẫn đến việc các moment lưỡng cực không tự triệt tiêu lẫn nhau, kết quả là tạo ra một moment lưỡng cực ròng trong phân tử.
Một điểm quan trọng cần lưu ý là moment lưỡng cực tổng hợp của NH3 hướng từ các nguyên tử hydro về phía nguyên tử nitơ, làm cho NH3 trở thành một phân tử có cực. Sự phân cực này ảnh hưởng đến tính chất vật lý và hóa học của NH3, chẳng hạn như độ tan trong nước và khả năng tham gia các phản ứng hóa học.
Tính phân cực của NH3 cũng là lý do tại sao nó có độ hòa tan cao trong nước, do nước cũng là một dung môi phân cực. Các phân tử NH3 tương tác mạnh mẽ với các phân tử nước thông qua liên kết hydro, làm cho NH3 dễ dàng hòa tan và tham gia các phản ứng trong dung dịch nước.
6. Ứng dụng và Tầm quan trọng của NH3 trong Hóa học
NH3 (amoniac) là một hợp chất hóa học có vai trò vô cùng quan trọng trong nhiều lĩnh vực, đặc biệt là trong nông nghiệp và công nghiệp hóa chất. Dưới đây là một số ứng dụng chính của NH3:
- Sản xuất phân bón: NH3 được sử dụng rộng rãi để sản xuất các loại phân bón như amoni nitrat (NH4NO3), amoni sunfat ((NH4)2SO4), và urê (CO(NH2)2). Những loại phân bón này cung cấp nitơ, một dưỡng chất cần thiết cho sự phát triển của cây trồng.
- Làm chất tẩy rửa: NH3 được sử dụng như một chất tẩy rửa hiệu quả trong đời sống hàng ngày, có khả năng loại bỏ các vết bẩn cứng đầu mà không làm hỏng bề mặt vật liệu.
- Sử dụng trong công nghiệp làm lạnh: NH3 là chất làm lạnh hiệu quả, chi phí thấp và thân thiện với môi trường, được sử dụng rộng rãi trong các hệ thống làm lạnh và cấp đông thực phẩm.
- Xử lý khí thải công nghiệp: NH3 được sử dụng để trung hòa các khí axit trong quá trình xử lý khí thải, giúp giảm thiểu ô nhiễm môi trường.
- Sản xuất hóa chất: NH3 là nguyên liệu cơ bản để sản xuất nhiều loại hóa chất quan trọng như axit nitric (HNO3), hydrazin (N2H4), và nhiều hợp chất hữu cơ khác.
Với những ứng dụng đa dạng và quan trọng như vậy, NH3 đóng một vai trò không thể thiếu trong nền công nghiệp hiện đại, đồng thời góp phần cải thiện chất lượng cuộc sống và bảo vệ môi trường.

7. Tổng kết về Cấu trúc và Hình học Electron của NH3
Trong quá trình nghiên cứu về NH3, chúng ta đã thấy rằng phân tử này có nhiều đặc điểm cấu trúc và hình học đặc biệt. Phân tử NH3 có cấu trúc hình chóp với nguyên tử nitơ ở đỉnh, liên kết cộng hóa trị với ba nguyên tử hydro tạo nên một đáy tam giác. Sự có mặt của cặp electron tự do trên nguyên tử nitơ là nguyên nhân chính dẫn đến hình học phân tử này bị méo và không phải là hình tứ diện hoàn chỉnh.
Sự phân cực của NH3 xuất phát từ sự chênh lệch về độ âm điện giữa nguyên tử nitơ và hydro, tạo nên các liên kết N-H có độ phân cực. Điều này làm cho NH3 có những tính chất vật lý và hóa học đặc biệt, chẳng hạn như tính tan trong nước và tính bazơ yếu.
Trong công nghiệp và đời sống, NH3 đóng vai trò vô cùng quan trọng, không chỉ là nguyên liệu sản xuất phân bón mà còn là chất làm lạnh và dung môi trong nhiều quá trình hóa học khác nhau. Sự hiểu biết về cấu trúc và hình học electron của NH3 không chỉ giúp chúng ta nắm rõ hơn về tính chất của nó mà còn tạo nền tảng cho việc ứng dụng hiệu quả NH3 trong thực tiễn.
Tóm lại, NH3 là một phân tử có hình học phân tử độc đáo, sự phân cực rõ rệt và các tính chất hóa học phong phú. Cấu trúc và hình học electron của nó là cơ sở để giải thích những tính chất đặc biệt này, từ đó mở ra nhiều ứng dụng trong công nghiệp và đời sống.