Chủ đề lithium electron configuration: Cấu hình electron của lithium (Li) là một chủ đề quan trọng trong hóa học, giúp chúng ta hiểu rõ về tính chất hóa học và vị trí của nguyên tố này trong bảng tuần hoàn. Bài viết này sẽ cung cấp hướng dẫn chi tiết về cấu hình electron của lithium theo chương trình sách giáo khoa mới, mối liên hệ với tính chất nguyên tố và vị trí của nó trong bảng tuần hoàn, cùng với các bài tập ví dụ để củng cố kiến thức.
Mục lục
Cấu hình electron của nguyên tử Lithium (Li)
Lithium (Li) là nguyên tố hóa học với số hiệu nguyên tử \(Z = 3\). Nó có cấu hình electron cơ bản và là một nguyên tố thuộc nhóm IA trong bảng tuần hoàn, thuộc chu kỳ 2 và là một kim loại kiềm.
1. Cấu hình electron của nguyên tử Lithium
Nguyên tử lithium có tổng cộng 3 electron, và cấu hình electron của nó được viết như sau:
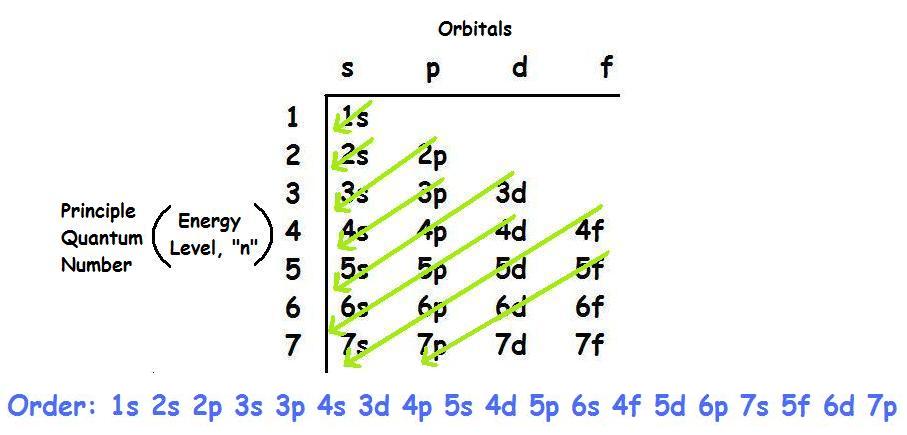
- Cấu hình đầy đủ: \(1s^2 2s^1\)
- Cấu hình rút gọn: \([He] 2s^1\)
2. Cấu hình electron theo ô orbital
Theo cách biểu diễn ô orbital, cấu hình electron của lithium được thể hiện như sau:
- Electron thuộc lớp \(1s\): 2 electron, điền đầy AO (ô orbital) \(1s\)
- Electron thuộc lớp \(2s\): 1 electron, điền một nửa AO \(2s\)
Nguyên tử lithium có 1 electron độc thân nằm ở AO \(2s\).
3. Mối liên hệ giữa cấu hình electron với vị trí trong bảng tuần hoàn và tính chất nguyên tố
- Vị trí trong bảng tuần hoàn:
- Ô thứ 3 (vì \(Z = 3\))
- Chu kỳ 2 (vì có 2 lớp electron)
- Nhóm IA (vì có 1 electron hóa trị và là nguyên tố s)
- Tính chất hóa học:
- Lithium thuộc nhóm IA, là một kim loại kiềm.
- Có xu hướng nhường 1 electron ở lớp ngoài cùng để đạt cấu hình bền vững như khí hiếm He, vì vậy lithium có tính khử mạnh.
- Hóa trị cao nhất với oxy là I.
- Công thức oxide cao nhất: \(Li_2O\) (oxide bazơ mạnh)
- Công thức base tương ứng: \(LiOH\) (là base mạnh)
4. Ví dụ bài tập
-
Câu hỏi: Nguyên tử nguyên tố X có 1 electron duy nhất ở lớp thứ 2. Vị trí của X trong bảng tuần hoàn là:
- Ô 1, chu kỳ 2, nhóm IVA.
- Ô 2, chu kỳ 2, nhóm IA.
- Ô 3, chu kỳ 2, nhóm IA.
- Ô 3, chu kỳ 3, nhóm VIIIA.
Lời giải: Đáp án đúng là C. Nguyên tử X có cấu hình electron: \(1s^2 2s^1\), nằm ở ô thứ 3, chu kỳ 2, nhóm IA.
-
Câu hỏi: M là nguyên tố s. Tổng số hạt mang điện trong nguyên tử của nguyên tố M là 6. Số electron độc thân trong nguyên tử nguyên tố M là:
Lời giải: Đáp án đúng là A. Tổng số hạt mang điện là 6 (3 proton và 3 electron), do đó, cấu hình electron của M là \(1s^2 2s^1\), với 1 electron độc thân ở AO 2s.

.png)
1. Giới thiệu về Lithium (Li)
Lithium (Li) là một nguyên tố hóa học có số hiệu nguyên tử là 3, thuộc nhóm kim loại kiềm trong bảng tuần hoàn. Đây là kim loại nhẹ nhất và có mật độ thấp nhất trong tất cả các kim loại. Lithium có kí hiệu hóa học là Li và có cấu hình electron là \(1s^2 2s^1\). Cấu hình electron này cho thấy Li có một electron độc thân ở lớp 2s, điều này quyết định nhiều tính chất hóa học đặc trưng của nguyên tố.
Với cấu hình electron là \(1s^2 2s^1\), lithium thuộc nhóm IA trong bảng tuần hoàn, đứng ở ô thứ 3 và thuộc chu kỳ 2. Điều này có nghĩa là lithium có 2 lớp electron và 1 electron hóa trị duy nhất. Đặc điểm này giúp lithium dễ dàng nhường 1 electron để tạo liên kết hóa học, dẫn đến tính chất của một kim loại kiềm mạnh.
Lithium có nhiều ứng dụng quan trọng trong đời sống và công nghiệp, đặc biệt là trong sản xuất pin lithium-ion, được sử dụng rộng rãi trong các thiết bị điện tử như điện thoại di động và xe điện. Ngoài ra, lithium còn được dùng trong y học để điều trị rối loạn tâm thần, cụ thể là các rối loạn lưỡng cực.
2. Cấu hình electron của Lithium
Lithium, với kí hiệu hóa học là Li và số hiệu nguyên tử Z = 3, là một nguyên tố thuộc nhóm IA, chu kỳ 2 trong bảng tuần hoàn. Cấu hình electron của lithium giúp chúng ta hiểu rõ hơn về đặc tính hóa học và vị trí của nó trong bảng tuần hoàn.
- **Cấu hình electron nguyên tử của lithium**: Lithium có tổng cộng 3 electron. Cấu hình electron đầy đủ được viết là \(1s^{2}2s^{1}\), có nghĩa là có 2 electron trong lớp vỏ 1s và 1 electron trong lớp vỏ 2s.
- **Cấu hình electron dạng rút gọn**: Để biểu diễn dạng rút gọn, ta có thể viết cấu hình electron của lithium dưới dạng [He]2s1, trong đó [He] đại diện cho cấu hình electron của nguyên tử helium (1s2).
- **Cấu hình electron theo ô orbital**: Cấu hình electron của lithium cũng có thể được biểu diễn theo ô orbital như sau:
Nguyên tử lithium có 1 electron độc thân nằm trong orbital 2s.1s 2s ↑↓ ↑
Từ cấu hình electron này, ta có thể suy ra rằng lithium có một electron hóa trị, khiến nó dễ dàng nhường đi electron này để đạt được cấu hình bền vững giống như khí hiếm helium. Điều này lý giải cho tính chất kim loại kiềm của lithium và khả năng phản ứng mạnh với các nguyên tố khác.

3. Tính chất hóa học của Lithium
Lithium (Li) là một kim loại kiềm có tính chất hóa học rất đặc trưng và mạnh mẽ. Đây là một kim loại có tính khử mạnh, dễ dàng tham gia vào các phản ứng hóa học với phi kim, acid, nước, và hydrogen. Dưới đây là một số tính chất hóa học nổi bật của lithium:
- Phản ứng với phi kim: Lithium phản ứng mãnh liệt với các phi kim như oxygen, tạo thành các oxide, peroxide, hoặc superoxide. Khi đốt cháy, lithium cho ngọn lửa màu đỏ đặc trưng.
- Phản ứng với axit: Lithium tác dụng với các dung dịch acid loãng, khử các ion trong dung dịch và giải phóng khí hydrogen (H₂).
- Phản ứng với nước: Lithium phản ứng với nước, tuy nhiên chậm hơn các kim loại kiềm khác, tạo thành dung dịch kiềm và giải phóng khí hydrogen (H₂).
- Phản ứng với hydrogen: Ở điều kiện áp suất lớn và nhiệt độ cao, lithium phản ứng với hydrogen tạo thành lithium hydride (LiH), một hợp chất rắn ion.
Những tính chất này khiến lithium trở thành một nguyên tố rất hữu ích và đa dạng trong các ứng dụng công nghiệp, đặc biệt trong sản xuất pin lithium-ion, hợp kim nhẹ và các ứng dụng hóa học đặc biệt khác.

4. Ứng dụng và điều chế Lithium
Lithium (Li) là một kim loại kiềm có nhiều ứng dụng trong đời sống và công nghiệp hiện đại. Được biết đến với tính dẫn điện và dẫn nhiệt tốt, Lithium đóng vai trò quan trọng trong nhiều lĩnh vực.
- Ứng dụng trong công nghiệp:
- Pin Lithium-ion: Đây là ứng dụng quan trọng nhất của Lithium trong công nghiệp. Pin Lithium-ion được sử dụng rộng rãi trong các thiết bị điện tử như điện thoại di động, máy tính xách tay và các thiết bị lưu trữ năng lượng khác, cũng như trong các phương tiện chạy điện.
- Hợp kim Aluminium-Lithium: Được sử dụng trong ngành hàng không và công nghiệp vũ trụ nhờ tính chất nhẹ và độ cứng cao, giúp giảm trọng lượng và tăng độ bền của các vật liệu.
- Ứng dụng trong y tế:
- Điều trị rối loạn tâm thần: Lithium carbonate được sử dụng trong y học để điều trị các bệnh lý như rối loạn lưỡng cực, trầm cảm và các rối loạn tâm thần khác, nhờ khả năng ổn định tâm trạng và giảm triệu chứng bệnh.
Điều chế Lithium: Lithium được điều chế chủ yếu bằng phương pháp điện phân. Quá trình này sử dụng muối Lithium chloride (LiCl) và Potassium chloride (KCl) nóng chảy. Phản ứng điện phân giúp tách nguyên tố Lithium ra khỏi hợp chất của nó để thu được Lithium nguyên chất.
Nhờ vào các tính chất hóa học độc đáo và các ứng dụng đa dạng, Lithium ngày càng khẳng định vai trò của mình trong các ngành công nghiệp và đời sống con người hiện đại.

5. Bài tập và ví dụ liên quan đến cấu hình electron của Lithium
Việc hiểu rõ cấu hình electron của Lithium giúp chúng ta nắm vững hơn về vị trí và tính chất hóa học của nguyên tố này trong bảng tuần hoàn. Dưới đây là một số bài tập và ví dụ để củng cố kiến thức về cấu hình electron của Lithium (Li).
Ví dụ 1: Xác định vị trí của Lithium trong bảng tuần hoàn
Cho biết nguyên tử của nguyên tố X có một electron duy nhất ở lớp thứ 2. Xác định vị trí của X trong bảng tuần hoàn.
- Ô số 1, chu kỳ 2, nhóm IVA
- Ô số 2, chu kỳ 2, nhóm IA
- Ô số 3, chu kỳ 2, nhóm IA
- Ô số 3, chu kỳ 3, nhóm VIIIA
Lời giải: Đáp án đúng là C. Nguyên tử nguyên tố X có một electron duy nhất ở lớp thứ 2, do đó cấu hình electron của X là \(1s^2 2s^1\). Vì vậy, X thuộc ô số 3, chu kỳ 2 và nhóm IA.
Ví dụ 2: Tính toán số electron độc thân trong nguyên tử
Nguyên tố M thuộc nhóm s với tổng số hạt mang điện trong nguyên tử là 6. Xác định số electron độc thân trong nguyên tử của M.
- 1 electron
- 2 electron
- 3 electron
- 4 electron
Lời giải: Đáp án đúng là A. Tổng số hạt mang điện của M là 6, nghĩa là số proton và electron đều bằng 3. Vậy cấu hình electron của M là \(1s^2 2s^1\). Do đó, M có 1 electron độc thân ở orbital 2s.
Bài tập thực hành
- Xác định cấu hình electron của các ion được tạo thành từ Lithium như \(Li^+\) và so sánh với cấu hình electron của khí hiếm gần nhất.
- Tìm hiểu mối quan hệ giữa cấu hình electron và tính chất hóa học của Lithium. Vì sao Lithium dễ dàng nhường một electron để tạo thành ion \(Li^+\)?
Các bài tập này giúp bạn làm quen với cách viết cấu hình electron, hiểu được vị trí của Lithium trong bảng tuần hoàn, cũng như nắm vững tính chất hóa học của nó.
XEM THÊM:
6. Tài liệu tham khảo và học tập thêm
Để hiểu rõ hơn về cấu hình electron của Lithium (Li) và các chủ đề liên quan trong hóa học, bạn có thể tham khảo các tài liệu và nguồn học tập sau:
-
Sách giáo khoa và tài liệu học tập:
- Kết nối tri thức với cuộc sống, Cánh Diều, và Chân Trời Sáng Tạo: Ba bộ sách giáo khoa này cung cấp kiến thức cơ bản và nâng cao về cấu hình electron, bao gồm các ví dụ minh họa cụ thể về nguyên tố Lithium.
- Sách Hóa học cơ bản và nâng cao: Tài liệu này giúp học sinh nắm bắt cấu hình electron của các nguyên tố, phân tích cấu hình electron của Lithium, và cách nó ảnh hưởng đến tính chất hóa học.
-
Trang web và nguồn trực tuyến:
- : Trang web này cung cấp nhiều bài viết liên quan đến cấu hình electron của Lithium và các nguyên tố khác, giải thích chi tiết các khái niệm cơ bản và ví dụ cụ thể.
- : Trang web này tập hợp các tài liệu học tập mới nhất, bao gồm hướng dẫn cấu hình electron của Lithium theo chương trình mới, cùng với các bài tập thực hành và lời giải.
-
Ứng dụng học tập:
- Periodic Table Apps: Các ứng dụng như Periodic Table trên điện thoại di động cung cấp thông tin chi tiết về cấu hình electron, bao gồm cả cấu hình electron của Lithium và các nguyên tố khác.
- Khan Academy: Nền tảng học tập này có các video hướng dẫn và bài giảng trực tuyến về hóa học, bao gồm các nguyên lý cơ bản về cấu hình electron.
-
Thư viện và tài liệu học tập trực tiếp:
- Thư viện trường học: Hầu hết các trường học đều có các tài liệu tham khảo về hóa học, bao gồm sách giáo khoa, sách tham khảo và bài giảng về cấu hình electron của các nguyên tố như Lithium.
- Thư viện công cộng: Địa chỉ lý tưởng để tìm các sách tham khảo chuyên sâu về hóa học, các nghiên cứu khoa học và các tạp chí hóa học.
Việc tham khảo và nghiên cứu từ nhiều nguồn khác nhau sẽ giúp bạn hiểu rõ hơn về cấu hình electron của Lithium và các nguyên tố khác, cũng như các ứng dụng thực tiễn của chúng trong cuộc sống.