Chủ đề kr electron configuration: Cấu hình electron của nguyên tố Krypton (Kr) là một chủ đề quan trọng trong hóa học, giúp giải thích tính chất hóa học và cấu trúc của nguyên tố này. Bài viết này sẽ cung cấp cho bạn những kiến thức cần thiết về cấu hình electron của Kr, từ lý thuyết cơ bản đến ứng dụng trong công nghiệp và đời sống.
Mục lục
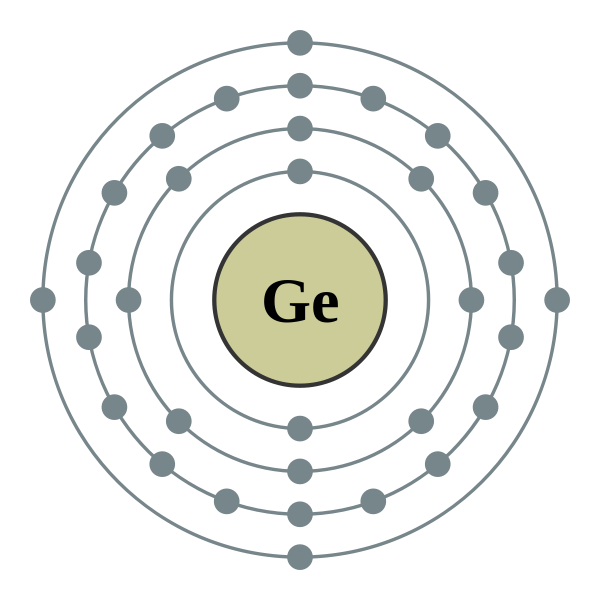
Cấu hình electron của nguyên tố Kr (Krypton)
Krypton (Kr) là một nguyên tố khí hiếm trong bảng tuần hoàn với số hiệu nguyên tử là 36. Dưới đây là cấu hình electron chi tiết của nguyên tố này:
Cấu hình electron cơ bản
Cấu hình electron đầy đủ của nguyên tố Krypton (Kr) có thể được viết như sau:
\[ 1s^2 \, 2s^2 \, 2p^6 \, 3s^2 \, 3p^6 \, 3d^{10} \, 4s^2 \, 4p^6 \]
Cấu hình electron này cho thấy rằng Krypton có tổng cộng 36 electron được sắp xếp trong các lớp và phân lớp như trên.
Cấu hình electron rút gọn (Sử dụng khí hiếm gần nhất)
Để đơn giản hóa việc viết cấu hình electron, ta có thể sử dụng cấu hình của khí hiếm gần nhất trước đó là Argon (Ar). Khi đó, cấu hình electron của Kr được viết như sau:
\[ [Ar] \, 3d^{10} \, 4s^2 \, 4p^6 \]
Điều này có nghĩa là Krypton có cấu hình electron giống với Argon, nhưng thêm các electron trong phân lớp \(3d\) và \(4p\).
Đặc điểm của cấu hình electron Krypton
- Số lớp electron: Krypton có 4 lớp electron.
- Số electron ở lớp ngoài cùng: Lớp ngoài cùng của Kr có 8 electron (\(4s^2 4p^6\)), đây là đặc điểm của các nguyên tố khí hiếm, khiến chúng rất bền vững và ít tham gia vào các phản ứng hóa học.
- Phân lớp d: Sự xuất hiện của phân lớp \(3d^{10}\) cho thấy Kr có sự hoàn thiện của phân lớp d, đặc điểm thường gặp ở các nguyên tố thuộc nhóm giữa bảng tuần hoàn.
Ứng dụng và ý nghĩa
Krypton là một trong những khí hiếm, có ứng dụng quan trọng trong các lĩnh vực như chiếu sáng (đèn neon), nghiên cứu khoa học, và trong các thiết bị đo lường. Cấu hình electron của Kr giúp giải thích tính chất trơ về hóa học của nó, đồng thời cũng là cơ sở để ứng dụng trong các công nghệ hiện đại.
.png)
Tổng quan về Cấu hình Electron
Cấu hình electron là cách mà các electron được phân bố xung quanh hạt nhân nguyên tử trong các lớp vỏ electron. Mỗi nguyên tử có số electron tương ứng với số hiệu nguyên tử (Z), và các electron này được sắp xếp vào các lớp và phân lớp theo nguyên tắc xác định.
Một ví dụ điển hình về cấu hình electron là nguyên tử krypton (Kr) với số hiệu nguyên tử 36. Cấu hình electron của krypton có thể được viết dưới dạng đầy đủ là:
\[ 1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^2 4p^6 \]
Hoặc dưới dạng rút gọn sử dụng cấu hình electron của nguyên tố khí hiếm đứng trước nó (argon):
\[ [Ar] 3d^{10} 4s^2 4p^6 \]
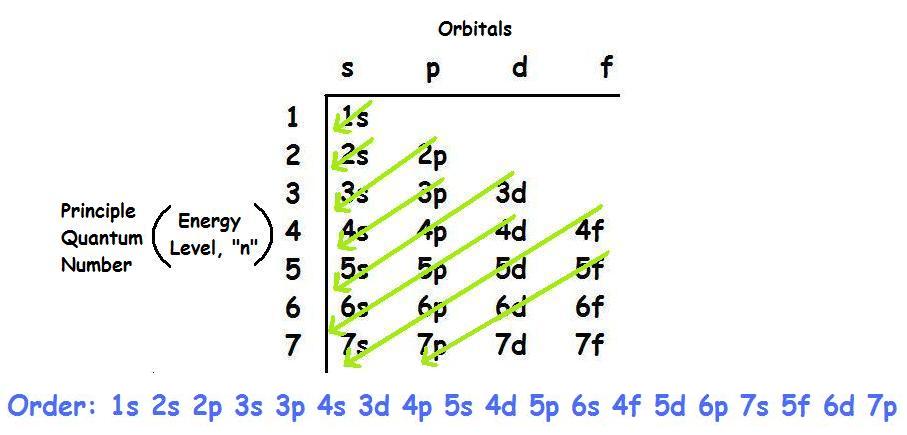
Quy tắc Aufbau và Nguyên lý Pauli
Các electron được sắp xếp theo quy tắc Aufbau, theo đó electron sẽ điền vào các obitan có mức năng lượng thấp trước khi điền vào các mức năng lượng cao hơn. Nguyên lý Pauli thì quy định rằng mỗi obitan chỉ chứa tối đa 2 electron và chúng phải có spin ngược chiều nhau.
Ứng dụng của Cấu hình Electron
- Xác định vị trí trong bảng tuần hoàn: Từ cấu hình electron, ta có thể xác định được vị trí của nguyên tố trong bảng tuần hoàn, như số chu kỳ, nhóm và tính chất hóa học.
- Dự đoán tính chất hóa học: Cấu hình electron quyết định tính chất hóa học của nguyên tố, chẳng hạn như tính kim loại, phi kim, hoặc khả năng phản ứng với các nguyên tố khác.
- Giải thích hiện tượng vật lý: Cấu hình electron cũng có thể giải thích các hiện tượng vật lý như quang phổ, từ tính, và dẫn điện.
Tầm quan trọng của Cấu hình Electron
Cấu hình electron không chỉ giúp chúng ta hiểu rõ hơn về bản chất của nguyên tố mà còn là công cụ quan trọng trong việc nghiên cứu và phát triển các vật liệu mới, như chất bán dẫn, vật liệu siêu dẫn, và các hợp chất hóa học có ứng dụng rộng rãi trong công nghiệp và đời sống.
Cấu hình Electron của Nguyên tố Kr (Krypton)
Krypton (ký hiệu hóa học: Kr) là nguyên tố thuộc nhóm khí hiếm trong bảng tuần hoàn, có số hiệu nguyên tử là 36 và khối lượng nguyên tử là 83,798 u. Dưới đây là chi tiết cấu hình electron của nguyên tố này.
1. Cấu hình Electron đầy đủ của Krypton
Cấu hình electron đầy đủ của Krypton được viết như sau:
\[
1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^2 4p^6
\]
Điều này có nghĩa là các electron của nguyên tử Krypton được phân bố vào các lớp vỏ theo thứ tự từ lớp vỏ gần hạt nhân nhất đến lớp vỏ ngoài cùng.
2. Cấu hình Electron rút gọn của Krypton
Để rút gọn, cấu hình electron của Krypton thường được viết dưới dạng:
\[
[Ar] 3d^{10} 4s^2 4p^6
\]
Trong đó [Ar] đại diện cho cấu hình electron của nguyên tố Argon, nguyên tố đứng ngay trước Krypton trong bảng tuần hoàn.
3. Phân bố Electron trên các lớp vỏ của Krypton
Các electron của Krypton được phân bố trên các lớp vỏ electron như sau:
- Lớp K: 2 electron
- Lớp L: 8 electron
- Lớp M: 18 electron
- Lớp N: 8 electron
4. Đặc điểm của Krypton dựa trên cấu hình Electron
Krypton là một khí hiếm, có tính trơ cao và rất ít tham gia vào các phản ứng hóa học. Điều này là do lớp vỏ ngoài cùng của nó đã được lấp đầy với 8 electron, làm cho Krypton có cấu hình electron bền vững.
Với các thông tin trên, có thể thấy rằng Krypton là một nguyên tố đặc biệt, không chỉ bởi tính chất hóa học mà còn bởi cấu hình electron độc đáo của nó.

Ứng dụng của Cấu hình Electron trong Hóa học
Cấu hình electron của một nguyên tử không chỉ giúp chúng ta hiểu rõ về tính chất hóa học của nguyên tố mà còn đóng vai trò quan trọng trong nhiều ứng dụng khác nhau trong hóa học.
- Dự đoán tính chất hóa học:
Cấu hình electron giúp dự đoán được khả năng phản ứng và đặc điểm hóa học của nguyên tố. Ví dụ, các nguyên tố có cấu hình electron tương tự thường có tính chất hóa học gần giống nhau. Nhờ đó, việc dự đoán khả năng tạo thành liên kết và phản ứng hóa học của nguyên tố trở nên dễ dàng hơn.
- Giải thích sự hình thành liên kết:
Liên kết giữa các nguyên tử được hình thành dựa trên sự tương tác giữa các electron hóa trị. Cấu hình electron giúp xác định vị trí của các electron này, từ đó hiểu rõ hơn về cách các nguyên tử kết hợp với nhau để tạo thành phân tử hoặc tinh thể.
- Phân loại nguyên tố:
Các nguyên tố trong bảng tuần hoàn được phân loại dựa trên cấu hình electron của chúng. Ví dụ, các nguyên tố trong cùng một nhóm thường có cấu hình electron tương tự ở lớp ngoài cùng, dẫn đến tính chất hóa học tương đồng.
- Ứng dụng trong phân tích quang phổ:
Cấu hình electron cũng đóng vai trò quan trọng trong việc giải thích các dải quang phổ của nguyên tử. Khi một nguyên tử hấp thụ năng lượng, các electron sẽ chuyển sang mức năng lượng cao hơn. Khi chúng quay trở lại mức năng lượng ban đầu, năng lượng sẽ được giải phóng dưới dạng ánh sáng, tạo ra các dải quang phổ đặc trưng cho từng nguyên tố.
- Tính toán năng lượng ion hóa và ái lực electron:
Cấu hình electron cho phép chúng ta tính toán và so sánh năng lượng ion hóa và ái lực electron của các nguyên tố khác nhau, từ đó hiểu rõ hơn về độ bền của liên kết trong các hợp chất.

Mẹo và phương pháp học thuộc cấu hình electron
Việc học thuộc cấu hình electron có thể trở nên dễ dàng hơn nếu bạn áp dụng một số mẹo và phương pháp hiệu quả dưới đây:
- Hiểu rõ nguyên tắc điền electron:
Đầu tiên, hãy nắm vững nguyên tắc Aufbau, quy tắc Hund và nguyên lý Pauli. Những nguyên tắc này sẽ giúp bạn xác định đúng cách điền electron vào các lớp và phân lớp. Ví dụ, electron sẽ được điền vào phân lớp có mức năng lượng thấp nhất trước, và mỗi orbital sẽ được điền một electron trước khi chúng bắt đầu ghép đôi.
- Sử dụng bảng tuần hoàn:
Bảng tuần hoàn không chỉ là công cụ hỗ trợ mà còn giúp bạn nhớ cấu hình electron của nguyên tố dễ dàng hơn. Các nhóm nguyên tố thường có cấu hình electron tương tự nhau, điều này có thể giúp bạn dự đoán được cấu hình của các nguyên tố cùng nhóm.
- Phương pháp "nấc thang":
Hãy tưởng tượng cấu hình electron như việc đi lên một chiếc thang. Mỗi bậc thang đại diện cho một phân lớp (s, p, d, f). Ví dụ, với nguyên tố Kr (Krypton), bạn có thể hình dung quá trình điền electron từ bậc thấp nhất (\(1s^2\)) lên đến bậc cao nhất \([Ar]3d^{10}4s^{2}4p^{6}\).
- Sử dụng kỹ thuật gợi nhớ (Mnemonics):
Kỹ thuật này giúp bạn ghi nhớ thứ tự điền electron bằng cách tạo ra các câu hoặc cụm từ dễ nhớ. Ví dụ, câu "Silly People Don't Find Gold" có thể giúp bạn nhớ thứ tự các phân lớp s, p, d, f, g.
- Luyện tập thường xuyên:
Không có gì thay thế được việc luyện tập. Bạn có thể viết đi viết lại cấu hình electron của các nguyên tố, hoặc làm các bài tập trắc nghiệm để củng cố kiến thức.
Việc kết hợp các phương pháp này sẽ giúp bạn học thuộc cấu hình electron một cách hiệu quả và dễ dàng hơn.

Những câu hỏi thường gặp về cấu hình electron của Kr
Làm thế nào để viết cấu hình electron đúng?
Để viết cấu hình electron của Kr (Krypton) một cách chính xác, bạn cần tuân thủ nguyên tắc Aufbau, quy tắc Hund, và nguyên tắc loại trừ Pauli. Cấu hình electron của Kr là:
\[ 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^{10} 4p^6 \]
Bạn cũng có thể viết cấu hình electron rút gọn của Kr như sau:
\[ [Ar] 3d^{10} 4s^2 4p^6 \]
Việc ghi nhớ các nguyên tắc này sẽ giúp bạn viết cấu hình electron đúng cho bất kỳ nguyên tố nào.
Cấu hình electron có thể thay đổi không?
Cấu hình electron của một nguyên tố thường không thay đổi trong các điều kiện thông thường. Tuy nhiên, trong các trường hợp đặc biệt như khi nguyên tử bị ion hóa (mất hoặc nhận electron), cấu hình electron có thể thay đổi. Ví dụ, khi Kr bị ion hóa, nó sẽ mất electron ở mức năng lượng cao nhất (4p), dẫn đến cấu hình electron mới.
Tại sao cấu hình electron lại quan trọng?
Cấu hình electron đóng vai trò quan trọng trong việc xác định tính chất hóa học của nguyên tố. Nó ảnh hưởng đến cách nguyên tử tương tác với các nguyên tử khác, từ đó quyết định tính chất hóa học và vật lý của nguyên tố. Ví dụ, cấu hình electron của Kr là một lý do tại sao nó là một khí hiếm, ít phản ứng trong hầu hết các điều kiện.