Chủ đề gd electron configuration: Cấu hình electron (GD Electron Configuration) là chìa khóa để hiểu rõ về các tính chất hóa học và vật lý của nguyên tố. Bài viết này sẽ hướng dẫn chi tiết về cấu hình electron, các nguyên lý cơ bản, và những ứng dụng thực tiễn trong công nghệ và nghiên cứu khoa học.
Mục lục
Cấu hình electron của nguyên tử
Cấu hình electron mô tả cách mà các electron được sắp xếp xung quanh hạt nhân của nguyên tử. Đây là một phần quan trọng trong việc hiểu rõ tính chất hóa học của các nguyên tố và sự tương tác của chúng trong các phản ứng hóa học.
Nguyên lý cơ bản
Cấu hình electron của một nguyên tử được xác định dựa trên ba nguyên lý cơ bản:
- Nguyên lý Pauli: Không có hai electron nào trong cùng một nguyên tử có thể có cùng một bộ bốn số lượng tử.
- Nguyên lý Aufbau: Các electron sẽ lấp đầy các orbital từ mức năng lượng thấp đến cao.
- Quy tắc Hund: Trong một tập hợp các orbital có cùng mức năng lượng, electron sẽ lấp đầy các orbital đơn lẻ trước khi ghép đôi.
Ví dụ về cấu hình electron của một số nguyên tố
Dưới đây là cấu hình electron của một số nguyên tố điển hình:
- Hydro (H): \(1s^1\)
- Heli (He): \(1s^2\)
- Liti (Li): \(1s^2 2s^1\)
- Cacbon (C): \(1s^2 2s^2 2p^2\)
- Oxy (O): \(1s^2 2s^2 2p^4\)
- Sắt (Fe): \(1s^2 2s^2 2p^6 3s^2 3p^6 3d^6 4s^2\)
Tầm quan trọng của cấu hình electron
Cấu hình electron giúp xác định tính chất hóa học của nguyên tố, bao gồm khả năng hình thành liên kết, mức năng lượng ion hóa, và độ âm điện. Ví dụ, cấu hình electron của nguyên tử natri (Na) là:
\[1s^2 2s^2 2p^6 3s^1\]
Điều này cho thấy Na có một electron lẻ ở lớp ngoài cùng, làm cho nó dễ dàng mất electron này để tạo thành ion Na+, điều này giải thích cho tính chất hoạt động mạnh của Na trong các phản ứng hóa học.
Kết luận
Hiểu biết về cấu hình electron không chỉ giúp chúng ta giải thích được hành vi hóa học của các nguyên tố mà còn là cơ sở để phát triển các ứng dụng trong hóa học, vật lý, và khoa học vật liệu.

.png)
Giới thiệu về cấu hình electron
Cấu hình electron là cách sắp xếp các electron xung quanh hạt nhân của nguyên tử trong các lớp và phân lớp electron. Việc hiểu rõ cấu hình electron giúp chúng ta dự đoán được tính chất hóa học, cách thức liên kết, và phản ứng của các nguyên tố. Cấu hình electron không chỉ đơn giản là liệt kê các electron, mà còn bao gồm các nguyên lý và quy tắc cơ bản sau:
- Nguyên lý Pauli: Mỗi orbital chỉ có thể chứa tối đa hai electron và chúng phải có spin ngược nhau.
- Nguyên lý Aufbau: Electron sẽ lấp đầy các orbital có năng lượng thấp trước khi lấp đầy các orbital có năng lượng cao hơn.
- Quy tắc Hund: Khi lấp đầy các orbital có cùng mức năng lượng, electron sẽ điền vào các orbital đơn trước, sau đó mới bắt đầu ghép đôi.
Các electron được sắp xếp theo thứ tự tăng dần của số nguyên tử, và cấu hình electron được biểu diễn bằng cách sử dụng các ký hiệu số học và ký tự. Ví dụ, cấu hình electron của nguyên tử neon (Ne) được biểu diễn như sau:
\[1s^2 2s^2 2p^6\]
Trong đó, các số ở trên cùng biểu thị số lượng electron trong mỗi phân lớp. Việc nắm vững cách sắp xếp electron sẽ giúp hiểu rõ hơn về các tính chất hóa học của nguyên tố, cũng như cách chúng tương tác trong các phản ứng hóa học.
Nguyên lý cấu hình electron
Nguyên lý cấu hình electron là các quy tắc cơ bản để xác định cách mà các electron được sắp xếp trong các orbital của nguyên tử. Việc hiểu rõ những nguyên lý này giúp chúng ta xác định được cấu trúc và tính chất hóa học của các nguyên tố. Dưới đây là ba nguyên lý quan trọng trong cấu hình electron:
- Nguyên lý Pauli: Không có hai electron nào trong cùng một nguyên tử có thể có cùng một bộ bốn số lượng tử. Điều này nghĩa là mỗi orbital chỉ có thể chứa tối đa hai electron với spin ngược nhau. Ví dụ, trong orbital \(1s\), hai electron sẽ có spin khác nhau để tuân thủ nguyên lý Pauli.
- Nguyên lý Aufbau: Electron sẽ lấp đầy các orbital theo thứ tự từ mức năng lượng thấp đến cao. Nguyên lý này xác định rằng các electron sẽ điền vào các phân lớp theo thứ tự \(1s\), \(2s\), \(2p\), \(3s\), \(3p\), \(4s\), \(3d\), và tiếp tục như vậy. Ví dụ, cấu hình electron của nguyên tử natri (Na) có thứ tự lấp đầy như sau:
\[1s^2 2s^2 2p^6 3s^1\]
- Quy tắc Hund: Khi electron lấp đầy các orbital có cùng mức năng lượng (degenerate orbitals), chúng sẽ lấp đầy từng orbital một cách đơn lẻ trước khi ghép đôi. Quy tắc này giúp tối thiểu hóa năng lượng của nguyên tử. Ví dụ, trong cấu hình của nguyên tử cacbon (C), các electron sẽ lấp đầy các orbital \(2p\) như sau:
\[1s^2 2s^2 2p^2\]
Các electron sẽ điền vào hai trong số ba orbital \(2p\) một cách đơn lẻ trước khi ghép đôi.
Những nguyên lý này giúp chúng ta hiểu rõ hơn về cách mà các electron được sắp xếp trong nguyên tử và cách chúng ảnh hưởng đến tính chất hóa học của nguyên tố.

Cấu hình electron của các nguyên tố cơ bản
Cấu hình electron của một nguyên tố mô tả cách mà các electron được sắp xếp xung quanh hạt nhân nguyên tử trong các lớp vỏ electron. Dưới đây là cấu hình electron của một số nguyên tố cơ bản, được trình bày theo thứ tự tăng dần của số nguyên tử:
- Hydro (H): Cấu hình electron đơn giản nhất, với chỉ một electron trong orbital đầu tiên. Cấu hình là \(1s^1\).
- Heli (He): Là nguyên tố đứng thứ hai, có cấu hình electron đầy đủ cho lớp vỏ đầu tiên. Cấu hình là \(1s^2\).
- Liti (Li): Có ba electron, bắt đầu lấp đầy lớp vỏ thứ hai với một electron ở phân lớp \(2s\). Cấu hình là \(1s^2 2s^1\).
- Cacbon (C): Nguyên tố này có sáu electron, với hai electron trong lớp vỏ thứ hai được phân bổ trong cả hai phân lớp \(2s\) và \(2p\). Cấu hình là \(1s^2 2s^2 2p^2\).
- Oxy (O): Có tám electron, trong đó bốn electron được phân bổ trong phân lớp \(2p\), giúp nguyên tố này có tính chất rất phản ứng. Cấu hình là \(1s^2 2s^2 2p^4\).
- Sắt (Fe): Là nguyên tố chuyển tiếp, sắt có cấu hình electron phức tạp hơn với 26 electron. Các electron lấp đầy lớp vỏ từ \(1s\) đến \(3d\), với cấu hình là \(1s^2 2s^2 2p^6 3s^2 3p^6 3d^6 4s^2\).
Cấu hình electron giúp xác định tính chất hóa học và vật lý của các nguyên tố. Những nguyên tố có cấu hình electron tương tự thường có những đặc điểm và phản ứng hóa học tương tự nhau, giúp ta hiểu rõ hơn về sự phân loại và tính chất của các nguyên tố trong bảng tuần hoàn.
XEM THÊM:
Ứng dụng của cấu hình electron trong công nghệ và khoa học vật liệu
Cấu hình electron đóng vai trò then chốt trong việc phát triển các ứng dụng công nghệ và khoa học vật liệu, đặc biệt là trong các lĩnh vực liên quan đến điện tử, quang học, và y học. Hiểu rõ cấu hình electron của các nguyên tố cho phép các nhà khoa học và kỹ sư tối ưu hóa tính chất của vật liệu, từ đó cải tiến hiệu suất và mở rộng khả năng ứng dụng.
- Công nghệ bán dẫn: Trong ngành công nghiệp bán dẫn, các nguyên tố như silicon và germanium có cấu hình electron cho phép chúng tạo thành các linh kiện điện tử như transistor và diode. Hiểu cấu hình electron giúp tối ưu hóa quá trình pha tạp (doping) để điều chỉnh tính dẫn điện của các vật liệu bán dẫn.
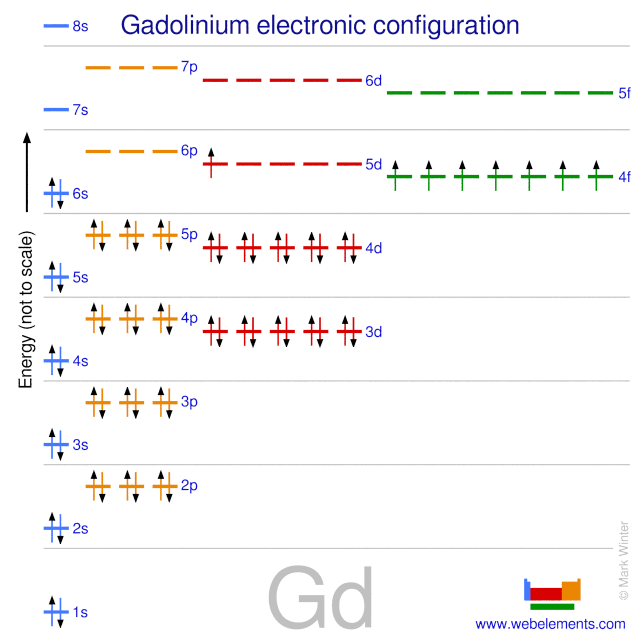
- Vật liệu từ tính: Cấu hình electron cũng quyết định tính chất từ tính của các vật liệu. Ví dụ, nguyên tố Gadolinium (Gd) có cấu hình electron đặc biệt làm cho nó trở nên quan trọng trong các ứng dụng từ tính như trong việc chế tạo nam châm mạnh và các thiết bị từ tính y học.
- Ứng dụng quang học: Cấu hình electron ảnh hưởng trực tiếp đến cách vật liệu tương tác với ánh sáng. Điều này được ứng dụng trong việc phát triển các vật liệu quang học mới như các tấm lọc, kính quang học và laser.
- Siêu dẫn và siêu cứng: Một số nguyên tố với cấu hình electron đặc biệt có thể trở thành vật liệu siêu dẫn hoặc siêu cứng khi ở nhiệt độ thấp. Điều này mở ra nhiều ứng dụng trong việc truyền tải điện không tổn thất và chế tạo các dụng cụ công nghiệp có độ bền cao.
- Y học và chẩn đoán hình ảnh: Trong lĩnh vực y học, cấu hình electron của các nguyên tố như Gadolinium được tận dụng để cải thiện chất lượng hình ảnh trong các hệ thống chẩn đoán như MRI (Cộng hưởng từ). Sự đặc biệt trong cấu hình electron của Gadolinium làm cho nó trở thành một chất tương phản lý tưởng, giúp phát hiện sớm và chính xác hơn các vấn đề y tế.
- Nghiên cứu vật liệu mới: Hiểu cấu hình electron là nền tảng để phát triển và khám phá các vật liệu mới với các tính chất ưu việt như độ bền cao, tính dẫn điện vượt trội, và khả năng chống ăn mòn. Điều này góp phần vào việc chế tạo các sản phẩm công nghệ tiên tiến hơn, từ điện thoại thông minh đến xe điện.
Tóm lại, cấu hình electron không chỉ là cơ sở lý thuyết quan trọng mà còn là yếu tố quyết định trong việc phát triển và ứng dụng các vật liệu công nghệ cao, đóng góp to lớn vào sự tiến bộ của khoa học và công nghệ.