Chủ đề electron_18: "Electron_18" là chủ đề quan trọng trong lĩnh vực hóa học và vật lý, liên quan đến cấu trúc nguyên tử và các ứng dụng của electron trong đời sống. Bài viết này sẽ giúp bạn hiểu rõ về electron, từ cơ bản đến chuyên sâu, cùng với những ví dụ và ứng dụng thực tiễn mà bạn có thể gặp trong cuộc sống hàng ngày.
Mục lục
Thông Tin Chi Tiết Về "electron_18"
Từ khóa "electron_18" liên quan đến các khái niệm và ứng dụng của electron trong hóa học và vật lý. Dưới đây là tổng hợp chi tiết các nội dung liên quan.
1. Khái Niệm Về Electron và Cấu Trúc Nguyên Tử
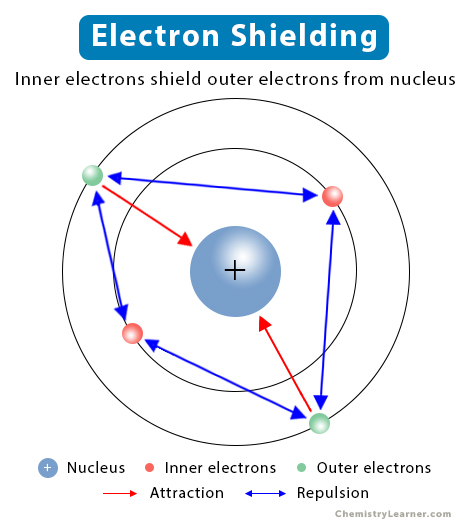
Electron là một hạt cơ bản trong nguyên tử, mang điện tích âm. Trong một nguyên tử, các electron sắp xếp theo các lớp vỏ khác nhau bao quanh hạt nhân. Cấu trúc của các lớp electron được xác định bởi số lượng electron trong mỗi lớp, được tính toán theo quy tắc Hund và nguyên lý Pauli.
- Ví dụ: Nguyên tử Ar (argon) có 18 electron phân bố như sau: \(1s^2\ 2s^2\ 2p^6\ 3s^2\ 3p^6\).
2. Ứng Dụng Trong Hóa Học
Trong hóa học, số electron quyết định tính chất hóa học của nguyên tử và cách chúng tham gia vào các phản ứng. Số electron hóa trị, tức là số electron ở lớp vỏ ngoài cùng, đóng vai trò quan trọng trong việc hình thành liên kết hóa học.
- Ví dụ: Trong phản ứng oxy hóa-khử, việc xác định số electron nhường và nhận giúp viết phương trình phản ứng chính xác.
3. Công Thức Tính Số Electron
Công thức tính số electron dựa trên điện lượng và thời gian di chuyển của electron qua một dây dẫn. Công thức được biểu thị bằng:
\[
n = \frac{Q}{e}
\]
Trong đó:
- \(n\) là số lượng electron.
- \(Q\) là điện lượng (Coulombs).
- \(e\) là điện tích của một electron (\(1.602 \times 10^{-19}\ C\)).
4. Ảnh Hưởng Đến Các Tính Chất Vật Lý
Các yếu tố như điện áp, nhiệt độ, và tính chất vật lý của kim loại ảnh hưởng đến số lượng electron di chuyển qua dây dẫn, từ đó tác động đến hiệu quả dẫn điện của kim loại.
- Ví dụ: Khi nhiệt độ tăng, sự chuyển động hỗn loạn của electron tăng, có thể làm giảm khả năng dẫn điện do sự va chạm giữa electron và mạng tinh thể kim loại.
5. Kết Luận
Thông tin về "electron_18" bao gồm các khái niệm cơ bản, ứng dụng trong hóa học và vật lý, cũng như công thức tính số electron. Những kiến thức này rất hữu ích trong việc hiểu rõ về các hiện tượng và ứng dụng trong đời sống và công nghiệp.

.png)
Mục Lục Tổng Hợp Về "Electron_18"
Trong bài viết này, chúng tôi sẽ cung cấp một cái nhìn toàn diện về "Electron_18," từ khái niệm cơ bản đến các ứng dụng thực tiễn trong hóa học và vật lý. Mục lục dưới đây giúp bạn dễ dàng theo dõi và nắm bắt thông tin một cách chi tiết.
- Giới Thiệu Về Electron Và Tầm Quan Trọng Của Nó
Định nghĩa cơ bản về electron, vai trò của electron trong cấu trúc nguyên tử.
Phân bố electron trong các lớp vỏ nguyên tử theo nguyên lý Pauli và quy tắc Hund.
- Công Thức Và Phương Pháp Tính Số Electron
Công thức tính số electron dựa trên điện lượng \(Q\) và điện tích của electron \(e\).
Ví dụ minh họa cách tính số electron trong các tình huống thực tế.
- Ứng Dụng Của Electron Trong Hóa Học Và Vật Lý
Vai trò của electron trong phản ứng hóa học, đặc biệt là phản ứng oxy hóa-khử.
Ảnh hưởng của sự chuyển động của electron đến tính chất dẫn điện của vật liệu.
- Tầm Quan Trọng Của Electron Trong Nghiên Cứu Và Công Nghệ
Ứng dụng của electron trong công nghệ bán dẫn và vi điện tử.
Những nghiên cứu tiên tiến liên quan đến electron trong lĩnh vực vật lý lượng tử.
- Kết Luận
Tổng kết các điểm chính đã đề cập về electron và "Electron_18".
Những triển vọng trong tương lai liên quan đến các nghiên cứu và ứng dụng của electron.
1. Giới Thiệu Về Electron Và Vai Trò Trong Cấu Trúc Nguyên Tử
Electron là một trong những thành phần cơ bản của nguyên tử, đóng vai trò quan trọng trong việc quyết định tính chất hóa học của nguyên tố. Electron có khối lượng rất nhỏ so với proton và neutron, và chúng được sắp xếp xung quanh hạt nhân theo các lớp và phân lớp khác nhau.
Các lớp electron được biểu diễn bằng các số lượng tử chính (n), và mỗi lớp chứa một hoặc nhiều phân lớp. Ví dụ, lớp thứ nhất (K) chỉ chứa một phân lớp s với số lượng electron tối đa là 2, lớp thứ hai (L) chứa hai phân lớp s và p với tổng cộng 8 electron, và lớp thứ ba (M) chứa ba phân lớp s, p, d với tổng số 18 electron.
Vai trò của electron trong nguyên tử là quyết định cách các nguyên tử liên kết với nhau để tạo thành phân tử, cũng như cách nguyên tử tương tác với ánh sáng và các loại bức xạ khác. Điều này làm cho electron trở thành một yếu tố then chốt trong các phản ứng hóa học và vật lý.
Thông qua việc sắp xếp electron trong các lớp và phân lớp khác nhau, chúng ta có thể dự đoán cấu trúc và tính chất của các nguyên tố cũng như cách chúng tham gia vào các phản ứng hóa học.

2. Ứng Dụng Của Electron Trong Hóa Học
Electron đóng vai trò trung tâm trong nhiều phản ứng hóa học, đặc biệt là trong quá trình hình thành và phá vỡ các liên kết hóa học giữa các nguyên tử. Dưới đây là một số ứng dụng cụ thể của electron trong hóa học:
- Phản Ứng Oxy Hóa-Khử
Phản ứng oxy hóa-khử (redox) là quá trình trao đổi electron giữa các nguyên tử hoặc ion, trong đó một chất bị oxy hóa (mất electron) và một chất khác bị khử (nhận electron). Ví dụ, trong phản ứng giữa kẽm và đồng, kẽm bị oxy hóa thành ion kẽm \( \text{Zn}^{2+} \), trong khi ion đồng \( \text{Cu}^{2+} \) bị khử thành đồng kim loại:
\[ \text{Zn} + \text{Cu}^{2+} \rightarrow \text{Zn}^{2+} + \text{Cu} \] - Cấu Trúc Phân Tử Và Liên Kết Hóa Học
Electron là yếu tố quyết định trong việc hình thành các liên kết hóa học, như liên kết ion, cộng hóa trị và kim loại. Ví dụ, trong phân tử nước \( \text{H}_2\text{O} \), các nguyên tử hydro chia sẻ electron với nguyên tử oxy để tạo thành các liên kết cộng hóa trị.
- Điện Phân
Quá trình điện phân dựa vào sự di chuyển của electron để tách các chất hóa học thành các thành phần cơ bản của chúng. Ví dụ, điện phân nước có thể tạo ra khí hydro và oxy:
\[ 2\text{H}_2\text{O} \rightarrow 2\text{H}_2 + \text{O}_2 \] - Phản Ứng Acid-Base
Trong phản ứng acid-base, việc trao đổi proton giữa các chất có liên quan mật thiết đến sự phân bố electron. Acid thường là các chất có khả năng nhận electron, trong khi base có xu hướng nhường electron.
Các ứng dụng của electron trong hóa học không chỉ dừng lại ở những phản ứng cơ bản mà còn mở rộng ra nhiều lĩnh vực khác như công nghệ vật liệu, pin năng lượng và sinh học phân tử.

XEM THÊM:
4. Ảnh Hưởng Của Electron Đến Tính Chất Vật Lý Của Chất Liệu
Electron là một trong những thành phần cơ bản quyết định tính chất vật lý của các chất liệu. Sự phân bố và tương tác của các electron trong cấu trúc nguyên tử đóng vai trò quan trọng trong việc xác định đặc tính dẫn điện, nhiệt độ, và từ tính của vật liệu. Dưới đây là các yếu tố quan trọng cần xem xét khi nghiên cứu ảnh hưởng của electron đến tính chất vật lý của chất liệu:
- Đặc tính dẫn điện: Electron tự do trong các chất liệu như kim loại là nguyên nhân chính giúp dẫn điện. Khi một điện trường được áp dụng, các electron này dễ dàng di chuyển, tạo ra dòng điện. Điều này giải thích tại sao kim loại là những chất dẫn điện tốt.
- Khả năng dẫn nhiệt: Tương tự như tính dẫn điện, electron cũng góp phần vào việc dẫn nhiệt trong các vật liệu. Khi các electron di chuyển, chúng mang theo năng lượng nhiệt, giúp truyền nhiệt từ vùng có nhiệt độ cao đến vùng có nhiệt độ thấp.
- Tính từ: Electron trong các vật liệu từ tính thường sắp xếp theo cách mà các mô-men từ của chúng có thể tương tác lẫn nhau. Ví dụ, trong các vật liệu sắt từ như sắt, sự tương tác này tạo ra các vùng gọi là "miền từ," nơi các electron có mô-men từ cùng chiều, góp phần tạo nên tính từ.
- Độ bền cơ học: Electron cũng ảnh hưởng đến cấu trúc tinh thể của các chất liệu, quyết định độ bền cơ học. Sự liên kết giữa các nguyên tử, thông qua chia sẻ electron hoặc tạo thành liên kết ion, quyết định khả năng chịu lực và độ cứng của vật liệu.
Hiểu rõ vai trò của electron trong cấu trúc và tính chất của vật liệu không chỉ giúp giải thích các hiện tượng vật lý mà còn mở ra nhiều ứng dụng thực tiễn trong khoa học vật liệu và kỹ thuật.

5. Tóm Lược Và Kết Luận
Qua các phần đã trình bày, chúng ta đã có cái nhìn toàn diện về vai trò quan trọng của electron trong các lĩnh vực khác nhau của khoa học và kỹ thuật. Từ việc đóng vai trò cốt lõi trong cấu trúc nguyên tử, ảnh hưởng đến tính chất vật lý và hóa học của chất liệu, đến ứng dụng thực tiễn trong nhiều ngành công nghiệp, electron là một yếu tố không thể thiếu.
Trong hóa học, electron quyết định cách thức các nguyên tử liên kết với nhau, từ đó tạo nên các hợp chất với tính chất khác nhau. Trong vật lý, electron chịu trách nhiệm chính trong việc dẫn điện, dẫn nhiệt, và hình thành từ tính của vật liệu. Hiểu biết sâu về electron không chỉ giúp chúng ta giải thích được nhiều hiện tượng khoa học mà còn mở ra cánh cửa cho nhiều ứng dụng công nghệ tiên tiến.
Như vậy, việc nắm vững kiến thức về electron không chỉ quan trọng trong việc học tập mà còn đóng vai trò thiết yếu trong nghiên cứu và phát triển các công nghệ mới. Kết luận lại, electron không chỉ là một hạt cơ bản mà còn là chìa khóa mở ra nhiều cơ hội phát triển trong tương lai.