Chủ đề ge electron configuration: Cấu hình electron của Germanium (Ge) không chỉ giúp hiểu rõ hơn về tính chất vật lý, hóa học của nguyên tố này mà còn đóng vai trò quan trọng trong công nghệ bán dẫn và quang học. Bài viết này sẽ đi sâu vào cấu hình electron chi tiết, ứng dụng thực tế, cũng như so sánh Germanium với các nguyên tố khác trong nhóm carbon.
Mục lục
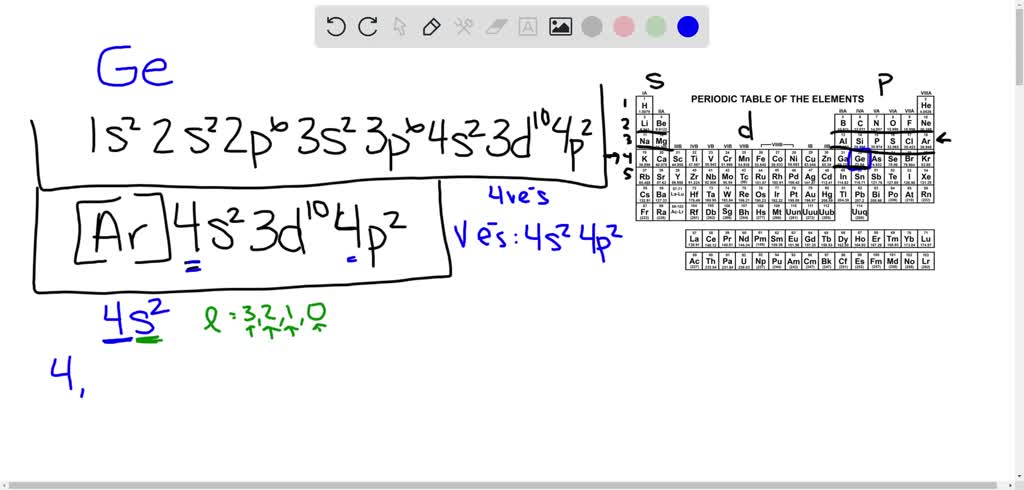
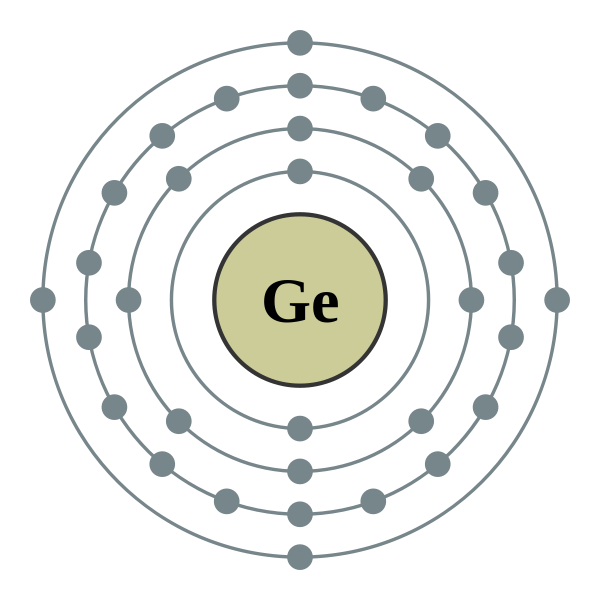
Cấu hình Electron của Germanium (Ge)
Germanium là nguyên tố hóa học có ký hiệu là Ge và số nguyên tử là 32. Trong bảng tuần hoàn, nó thuộc nhóm 14 và là một nguyên tố bán dẫn có tính chất cả kim loại và phi kim. Dưới đây là thông tin chi tiết về cấu hình electron của Germanium.
1. Cấu hình Electron
Cấu hình electron của Germanium có thể được viết như sau:
\[ 1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^2 4p^2 \]
Hoặc có thể viết gọn hơn:
\[ [Ar] 3d^{10} 4s^2 4p^2 \]
2. Giải thích Cấu hình Electron
- Lớp 1: Bao gồm 2 electron trong phân lớp \(1s\).
- Lớp 2: Có 8 electron, được phân bố vào các phân lớp \(2s\) và \(2p\).
- Lớp 3: Có tổng cộng 18 electron, phân bố trong các phân lớp \(3s\), \(3p\), và \(3d\).
- Lớp 4: Có 4 electron, bao gồm 2 electron trong phân lớp \(4s\) và 2 electron trong phân lớp \(4p\).
3. Đặc điểm và Tính chất
Germanium là một nguyên tố có khả năng bán dẫn, có nghĩa là nó có thể dẫn điện tốt hơn phi kim nhưng kém hơn kim loại. Nó được sử dụng rộng rãi trong ngành công nghiệp điện tử, đặc biệt là trong các thiết bị như điốt và transistor. Cấu hình electron của nó cho phép germanium có thể tham gia vào các liên kết hóa học, biểu hiện tính chất của cả kim loại và phi kim.
4. Ứng dụng của Germanium
- Điện tử: Germanium là vật liệu quan trọng trong sản xuất transistor, điốt và các thiết bị điện tử khác.
- Quang học: Nó được sử dụng trong sản xuất kính quang học và các thiết bị quang học cao cấp.
- Y tế: Germanium có một số ứng dụng trong y học, chủ yếu trong việc hỗ trợ hệ miễn dịch và cải thiện sức khỏe tổng thể.
.png)
1. Giới Thiệu về Germanium
Germanium (ký hiệu hóa học Ge) là một nguyên tố hóa học thuộc nhóm 14 trong bảng tuần hoàn, nằm cùng nhóm với silicon và thiếc. Được phát hiện vào cuối thế kỷ 19, germanium có số nguyên tử là 32 và thuộc loại á kim, có tính chất vật lý và hóa học tương tự silicon. Trong tự nhiên, germanium tồn tại ở dạng nguyên liệu thô và là một chất bán dẫn quan trọng trong công nghiệp điện tử, đặc biệt là trong các ứng dụng công nghệ bán dẫn, quang học và y sinh học.
2. Cấu Hình Electron Của Germanium
Germanium (Ge) là nguyên tố thuộc nhóm 14 trong bảng tuần hoàn, với số nguyên tử là 32. Cấu hình electron của nó phản ánh sự sắp xếp electron trong các lớp vỏ và phân lớp, quyết định nhiều tính chất vật lý và hóa học của nguyên tố này.
2.1. Cấu Hình Electron Chi Tiết
Cấu hình electron đầy đủ của Germanium là:
- 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2
Trong đó, các electron được phân bổ vào các lớp vỏ 1, 2, 3 và 4, theo các phân lớp s, p và d.
2.2. Cấu Hình Electron Rút Gọn
Cấu hình electron rút gọn của Germanium là:
- [Ar] 3d10 4s2 4p2
Đây là cách viết ngắn gọn hơn dựa trên cấu hình của nguyên tử Argon (Ar), có 18 electron.
2.3. Ý Nghĩa Của Cấu Hình Electron
Cấu hình electron của Germanium cho thấy nó có 4 electron hóa trị (4s2 4p2), điều này giải thích tại sao nó có thể tạo ra nhiều trạng thái oxi hóa khác nhau như +2 và +4, đồng thời giải thích tính chất bán dẫn quan trọng của nó.

3. Phương Pháp Viết Cấu Hình Electron
Viết cấu hình electron yêu cầu tuân theo một số nguyên tắc cơ bản trong hóa học, bao gồm nguyên lý Aufbau, quy tắc Hund và nguyên tắc loại trừ Pauli. Dưới đây là hướng dẫn từng bước để viết cấu hình electron:
- Xác định số electron: Số electron của nguyên tố là số nguyên tử của nó. Với Germanium (Ge), số nguyên tử là 32, do đó, ta có 32 electron để phân phối.
- Áp dụng Nguyên lý Aufbau: Các electron được sắp xếp vào các orbital từ mức năng lượng thấp đến cao. Trình tự phổ biến là \(1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p\).
- Sắp xếp electron vào các orbital: Theo nguyên lý này, ta phân phối lần lượt 32 electron của Germanium vào các orbital tương ứng:
- 1s2
- 2s2 2p6
- 3s2 3p6
- 4s2
- 3d10
- 4p2
- Quy tắc Hund: Trong mỗi phân lớp, electron phải được điền vào các orbital trống trước khi cặp với nhau. Ví dụ, trong lớp \(3p\), ba orbital sẽ lần lượt chứa 1 electron trước khi electron thứ hai vào cặp.
- Viết cấu hình electron: Từ việc sắp xếp trên, cấu hình đầy đủ của Germanium sẽ là: \[ 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^{10} 4p^2 \] hoặc dưới dạng rút gọn: \[ [Ar] 4s^2 3d^{10} 4p^2 \]
Phương pháp này không chỉ giúp viết cấu hình electron chính xác mà còn giúp hiểu rõ hơn về cách các electron quyết định tính chất hóa học của nguyên tố.

XEM THÊM:
4. Ứng Dụng Thực Tế Của Germanium
Germanium có nhiều ứng dụng thực tiễn trong công nghiệp, đặc biệt là trong lĩnh vực bán dẫn, quang học và năng lượng tái tạo. Với tính chất bán dẫn, germanium được sử dụng trong các diode, transistor và mạch tích hợp, nơi mà khả năng dẫn điện có thể được kiểm soát dễ dàng.
- Công nghệ bán dẫn: Germanium có vai trò quan trọng trong việc chế tạo diode và transistor nhờ vào khả năng di động electron cao và có thể thay đổi tính dẫn điện khi kết hợp với tạp chất. Trong quá khứ, germanium từng là vật liệu chủ yếu cho bán dẫn trước khi silicon chiếm lĩnh thị trường.
- Quang học và Hồng ngoại: Germanium oxide (GeO₂) là một chất xúc tác quan trọng trong việc sản xuất sợi quang, giúp truyền ánh sáng hiệu quả. Ngoài ra, nhờ tính trong suốt với bức xạ hồng ngoại, germanium được sử dụng để chế tạo các thấu kính trong các thiết bị nhìn đêm và camera hồng ngoại.
- Năng lượng tái tạo: Germanium được sử dụng trong các tế bào năng lượng mặt trời hiệu suất cao, đóng góp vào việc phát triển năng lượng sạch. Germanium tetrachloride (GeCl₄), một hợp chất từ germanium, thường được sử dụng để tạo ra các pin năng lượng mặt trời.
- Ứng dụng y học: Các hợp chất organogermanium có tiềm năng trong việc hỗ trợ điều trị ung thư nhờ vào khả năng ức chế sự phát triển của tế bào khối u.
Nhờ tính chất độc đáo và khả năng ứng dụng đa dạng, germanium tiếp tục đóng góp vào nhiều lĩnh vực công nghệ tiên tiến ngày nay.

5. So Sánh Germanium Với Các Nguyên Tố Khác
Germanium (Ge) nằm trong nhóm 14 của bảng tuần hoàn cùng với các nguyên tố silicon (Si), thiếc (Sn), và chì (Pb). Do đó, nó chia sẻ nhiều đặc tính hóa học và vật lý tương tự với các nguyên tố trong nhóm này. Tuy nhiên, Germanium cũng có những khác biệt quan trọng so với các nguyên tố khác.
- So với Silicon (Si):
Germanium là một chất bán dẫn giống như silicon nhưng có khối lượng riêng lớn hơn và nhiệt độ nóng chảy thấp hơn. Trong công nghệ, Germanium thường được dùng trong các ứng dụng bán dẫn yêu cầu độ nhạy cao với tia gamma do độ phân giải năng lượng tốt hơn so với silicon. Ngoài ra, Germanium có khả năng tạo cặp electron-lỗ trống với năng lượng thấp hơn (2.9 eV) so với silicon (3.6 eV), làm cho nó trở nên lý tưởng cho các bộ cảm biến phóng xạ.
- So với Thiếc (Sn) và Chì (Pb):
Cả thiếc và chì đều có tính kim loại mạnh hơn Germanium. Trong khi Germanium có tính chất bán dẫn, thiếc và chì chủ yếu thể hiện các đặc tính kim loại và dẫn điện tốt. Thiếc có hai dạng thù hình (alpha và beta), trong đó alpha thiếc là bán dẫn nhưng thiếc ở dạng beta có cấu trúc kim loại. Chì là kim loại hoàn toàn và không có tính bán dẫn.
| Thuộc tính | Germanium (Ge) | Silicon (Si) | Thiếc (Sn) | Chì (Pb) |
|---|---|---|---|---|
| Khối lượng riêng | 5.323 g/cm³ | 2.33 g/cm³ | 7.31 g/cm³ | 11.34 g/cm³ |
| Nhiệt độ nóng chảy | 938.3°C | 1410°C | 231.9°C | 327.5°C |
| Hệ số dẫn nhiệt | 59.9 W/mK | 148 W/mK | 66.6 W/mK | 35.3 W/mK |
Vì Germanium có nhiều đặc tính trung gian giữa kim loại và phi kim, nó thường được sử dụng trong các ứng dụng bán dẫn đặc biệt, trong khi Silicon, Thiếc và Chì được sử dụng chủ yếu trong công nghiệp vật liệu và công nghệ sản xuất.
6. Kết Luận
Germanium là một nguyên tố quan trọng trong nhiều lĩnh vực công nghệ hiện đại nhờ tính chất bán dẫn của nó. Với cấu hình electron \([Ar] 3d^{10} 4s^2 4p^2\), germanium có khả năng dẫn điện một cách có kiểm soát, điều này làm cho nó trở thành thành phần không thể thiếu trong các thiết bị điện tử như transistor và diode. Bên cạnh đó, khả năng chống ăn mòn và chịu nhiệt cao của germanium giúp nó được sử dụng trong các ứng dụng quang học, từ kính hiển vi đến ống kính góc rộng.
Germanium cũng thể hiện tính linh hoạt khi có thể được sử dụng làm chất xúc tác và trong các hợp kim với các kim loại khác để tăng cường tính năng vật liệu. Trong lĩnh vực y tế, nó còn được nghiên cứu để sử dụng trong điều trị bệnh ung thư, mang lại tiềm năng lớn trong tương lai.
Với những ứng dụng rộng rãi và quan trọng trong đời sống, từ công nghiệp điện tử, quang học, cho đến y tế, germanium tiếp tục khẳng định vai trò không thể thiếu của mình trong cuộc cách mạng công nghệ hiện đại.