Chủ đề list of electron configuration: List of electron configuration là một chủ đề quan trọng trong hóa học, giúp hiểu rõ cách các electron được sắp xếp trong các nguyên tử. Bài viết này cung cấp một tổng hợp đầy đủ và chi tiết về các cấu hình electron của các nguyên tố hóa học, cách viết, nguyên tắc sắp xếp và các ví dụ cụ thể để giúp người học dễ dàng nắm bắt và ứng dụng vào thực tế.
Mục lục
- Danh sách cấu hình electron của các nguyên tố
- 1. Giới thiệu về cấu hình electron
- 2. Các quy tắc cơ bản viết cấu hình electron
- 3. Cách viết cấu hình electron
- 4. Ví dụ về cấu hình electron của các nguyên tố thường gặp
- 5. Ứng dụng của cấu hình electron
- 6. Bài tập về cấu hình electron
- 7. Câu hỏi thường gặp về cấu hình electron
- 8. Tài liệu tham khảo và học thêm
Danh sách cấu hình electron của các nguyên tố
Cấu hình electron của một nguyên tố hóa học biểu thị cách các electron được phân bố trong các lớp và phân lớp xung quanh hạt nhân của nguyên tử. Việc hiểu rõ cấu hình electron giúp xác định tính chất hóa học và vật lý của nguyên tố. Dưới đây là danh sách các cấu hình electron cơ bản của một số nguyên tố thường gặp:
Cách viết cấu hình electron
Cấu hình electron được viết theo thứ tự tăng dần của mức năng lượng với các nguyên tắc:
- Quy tắc Aufbau: Các electron điền vào các phân lớp có mức năng lượng thấp trước khi điền vào các phân lớp có mức năng lượng cao.
- Quy tắc Hund: Trong các phân lớp có cùng mức năng lượng, electron sẽ được phân bố sao cho mỗi orbital chứa một electron trước khi chứa electron thứ hai.
- Nguyên lý loại trừ Pauli: Không có hai electron trong một nguyên tử có cùng bốn số lượng tử.
Cấu hình electron của một số nguyên tố
| Nguyên tố | Cấu hình electron |
|---|---|
| Hydro (H) | \(1s^1\) |
| Heli (He) | \(1s^2\) |
| Liti (Li) | \(1s^2 2s^1\) |
| Berili (Be) | \(1s^2 2s^2\) |
| Bo (B) | \(1s^2 2s^2 2p^1\) |
| Cacbon (C) | \(1s^2 2s^2 2p^2\) |
| Nitơ (N) | \(1s^2 2s^2 2p^3\) |
| Oxy (O) | \(1s^2 2s^2 2p^4\) |
| Flo (F) | \(1s^2 2s^2 2p^5\) |
| Neon (Ne) | \(1s^2 2s^2 2p^6\) |
Ví dụ chi tiết cách viết cấu hình electron
- Nguyên tử Sắt (Fe):
- Số electron: 26
- Cấu hình electron: \(1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^6\)
- Viết gọn: \([Ar] 3d^6 4s^2\)
- Nguyên tử Natri (Na):
- Số electron: 11
- Cấu hình electron: \(1s^2 2s^2 2p^6 3s^1\)
- Nguyên tử Clo (Cl):
- Số electron: 17
- Cấu hình electron: \(1s^2 2s^2 2p^6 3s^2 3p^5\)
- Viết gọn: \([Ne] 3s^2 3p^5\)
Việc viết cấu hình electron chính xác giúp chúng ta hiểu rõ hơn về cấu trúc nguyên tử và tính chất hóa học của các nguyên tố, đồng thời hỗ trợ trong việc giải các bài tập hóa học liên quan.

.png)
1. Giới thiệu về cấu hình electron
Cấu hình electron là cách mô tả sự sắp xếp của các electron trong các lớp và phân lớp xung quanh hạt nhân nguyên tử. Cấu hình electron không chỉ giúp chúng ta hiểu rõ cấu trúc của nguyên tử mà còn giúp dự đoán tính chất hóa học và vật lý của các nguyên tố. Dưới đây là một số khái niệm cơ bản về cấu hình electron:
- Nguyên tắc cơ bản: Cấu hình electron được viết dựa trên nguyên tắc sắp xếp các electron từ mức năng lượng thấp lên cao, tuân theo các quy tắc như quy tắc Aufbau, quy tắc Hund và nguyên lý loại trừ Pauli.
- Quy tắc Aufbau: Electron sẽ điền vào các orbital có mức năng lượng thấp trước khi điền vào những orbital có mức năng lượng cao hơn.
- Quy tắc Hund: Trong một phân lớp, các electron sẽ chiếm các orbital rỗng trước khi ghép đôi trong các orbital đã có electron.
- Nguyên lý loại trừ Pauli: Không có hai electron nào trong cùng một nguyên tử có thể có cùng một bộ bốn số lượng tử.
Các electron được sắp xếp vào các lớp và phân lớp theo một thứ tự nhất định, được biểu thị bằng các ký hiệu như \(s\), \(p\), \(d\), và \(f\), với số chỉ số điện tử tương ứng trong từng phân lớp.
Ví dụ về Cấu Hình Electron
Ví dụ, cấu hình electron của một số nguyên tố thông thường như sau:
- Hydro (H): \(1s^1\)
- Heli (He): \(1s^2\)
- Liti (Li): \(1s^2 2s^1\)
- Cacbon (C): \(1s^2 2s^2 2p^2\)
- Neon (Ne): \(1s^2 2s^2 2p^6\)
Cấu hình electron cung cấp một cái nhìn tổng quan về sự sắp xếp của các electron và là cơ sở để hiểu sâu hơn về cách các nguyên tử tương tác với nhau trong các phản ứng hóa học.
2. Các quy tắc cơ bản viết cấu hình electron
Cấu hình electron của một nguyên tử được viết dựa trên các quy tắc sắp xếp các electron vào các phân lớp theo mức năng lượng tăng dần. Dưới đây là các quy tắc cơ bản cần tuân thủ:
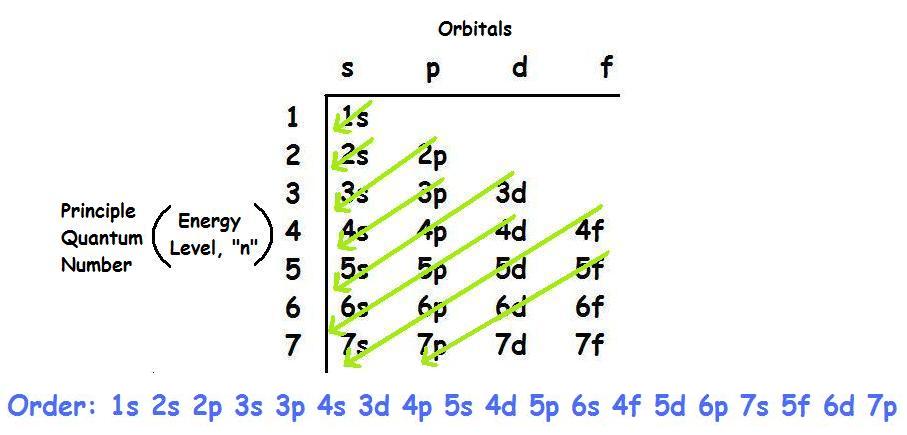
- Quy tắc Aufbau: Electron được điền vào các phân lớp có mức năng lượng thấp trước, theo thứ tự: \(1s\), \(2s\), \(2p\), \(3s\), \(3p\), \(4s\), \(3d\), \(4p\), ...
- Quy tắc Pauli: Mỗi orbital chỉ chứa tối đa 2 electron với spin ngược chiều nhau. Điều này đảm bảo không có hai electron trong cùng một nguyên tử có cùng bốn số lượng tử.
- Quy tắc Hund: Trong các orbital thuộc cùng một phân lớp, electron sẽ được điền vào các orbital riêng biệt trước khi ghép đôi để đảm bảo cấu hình ổn định nhất.
Ví dụ:
- Nguyên tử sắt (Fe) với \( Z = 26 \): Cấu hình electron là \( 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^6 \).
- Nguyên tử neon (Ne) với \( Z = 10 \): Cấu hình electron là \( 1s^2 2s^2 2p^6 \).
Việc hiểu và áp dụng các quy tắc này giúp xác định chính xác cấu hình electron của các nguyên tử, từ đó hiểu rõ hơn về tính chất hóa học của các nguyên tố.

3. Cách viết cấu hình electron
Để viết cấu hình electron của một nguyên tử, ta thực hiện theo các bước sau:
- Bước 1: Xác định số electron của nguyên tử. Số electron bằng số proton và bằng số thứ tự (Z) của nguyên tố trong bảng tuần hoàn.
- Bước 2: Sắp xếp các electron theo thứ tự mức năng lượng tăng dần. Theo thứ tự: \( 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p \)...
- Bước 3: Điền electron vào các phân lớp theo quy tắc Hund và Pauli. Mỗi orbital chứa tối đa 2 electron với spin ngược nhau, và trong cùng một phân lớp, electron sẽ điền vào các orbital rỗng trước khi ghép đôi.
Ví dụ, để viết cấu hình electron của nguyên tử Natri (Na) với \( Z = 11 \):
- Bước 1: Xác định số electron: \( Z = 11 \).
- Bước 2: Sắp xếp theo thứ tự: \( 1s^2, 2s^2, 2p^6, 3s^1 \).
- Bước 3: Viết cấu hình electron: \( 1s^2 2s^2 2p^6 3s^1 \).
Cách viết cấu hình electron giúp xác định vị trí của các electron và dự đoán tính chất hóa học của nguyên tử.

4. Ví dụ về cấu hình electron của các nguyên tố thường gặp
Dưới đây là một số ví dụ về cấu hình electron của các nguyên tố hóa học thường gặp, giúp hiểu rõ hơn về cách sắp xếp electron trong nguyên tử:
| Nguyên tố | Số proton (Z) | Cấu hình electron | Cấu hình viết gọn |
|---|---|---|---|
| Hydro (H) | 1 | \( 1s^1 \) | N/A |
| Heli (He) | 2 | \( 1s^2 \) | N/A |
| Liti (Li) | 3 | \( 1s^2 2s^1 \) | N/A |
| Neon (Ne) | 10 | \( 1s^2 2s^2 2p^6 \) | N/A |
| Natri (Na) | 11 | \( 1s^2 2s^2 2p^6 3s^1 \) | \([Ne] 3s^1\) |
| Magie (Mg) | 12 | \( 1s^2 2s^2 2p^6 3s^2 \) | \([Ne] 3s^2\) |
| Sắt (Fe) | 26 | \( 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^6 \) | \([Ar] 3d^6 4s^2\) |
Các ví dụ trên giúp minh họa cách viết cấu hình electron từ những nguyên tố đơn giản đến phức tạp, góp phần vào việc hiểu rõ tính chất hóa học của chúng.

5. Ứng dụng của cấu hình electron
Cấu hình electron đóng vai trò quan trọng trong nhiều lĩnh vực của hóa học và vật lý. Dưới đây là một số ứng dụng chính:
5.1. Dự đoán tính chất hóa học và vật lý của nguyên tố
Cấu hình electron giúp xác định tính chất hóa học và vật lý của các nguyên tố. Các electron hóa trị, tức là các electron ở lớp ngoài cùng, quyết định khả năng phản ứng và liên kết hóa học của nguyên tố đó. Ví dụ, các nguyên tố nhóm 1 (như Na và K) có xu hướng mất một electron để đạt cấu hình ổn định, tạo ra các ion dương (+1).
5.2. Xác định trạng thái oxy hóa và đặc điểm phản ứng
Dựa vào cấu hình electron, có thể dự đoán trạng thái oxy hóa của nguyên tố trong các phản ứng hóa học. Ví dụ, sắt (Fe) có thể có các trạng thái oxy hóa +2 hoặc +3, phụ thuộc vào việc mất đi 2 hoặc 3 electron từ các phân lớp ngoài cùng (4s và 3d).
5.3. Sử dụng trong phân tích phổ và dự đoán cấu trúc phân tử
Cấu hình electron cũng rất hữu ích trong phân tích phổ và dự đoán cấu trúc phân tử. Sự phân bố của các electron ảnh hưởng đến sự hấp thụ và phát xạ năng lượng trong các phép đo quang phổ. Điều này giúp xác định cấu trúc và đặc điểm của các phân tử và hợp chất.
Một số ứng dụng khác của cấu hình electron bao gồm việc xác định mức độ bền vững của phân tử, dự đoán khả năng dẫn điện, và giải thích các tính chất từ tính của các nguyên tố chuyển tiếp.
XEM THÊM:
6. Bài tập về cấu hình electron
Bài tập về cấu hình electron giúp người học nắm vững kiến thức về cách xác định, viết và ứng dụng cấu hình electron của các nguyên tố. Dưới đây là một số dạng bài tập phổ biến cùng với các hướng dẫn giải chi tiết.
6.1. Bài tập xác định cấu hình electron từ số nguyên tử
Cho biết số nguyên tử của các nguyên tố sau, hãy viết cấu hình electron:
- Oxy (Z = 8): Xác định cấu hình electron.
- Natri (Z = 11): Xác định cấu hình electron.
- Sắt (Z = 26): Xác định cấu hình electron.
Gợi ý giải:
- Viết cấu hình electron theo thứ tự các lớp và phân lớp: \(1s, 2s, 2p, 3s, 3p, 4s, 3d, ...\)
- Điền electron theo quy tắc Aufbau: lớp nào có mức năng lượng thấp hơn được điền trước.
6.2. Bài tập viết cấu hình electron theo phương pháp đầy đủ và rút gọn
Viết cấu hình electron của các nguyên tố sau bằng phương pháp đầy đủ và rút gọn:
- Nhôm (Z = 13): Viết cấu hình đầy đủ và rút gọn.
- Canxi (Z = 20): Viết cấu hình đầy đủ và rút gọn.
- Kẽm (Z = 30): Viết cấu hình đầy đủ và rút gọn.
Gợi ý giải:
- Phương pháp đầy đủ: Liệt kê tất cả các lớp và phân lớp electron.
- Phương pháp rút gọn: Sử dụng cấu hình electron của khí hiếm gần nhất làm cơ sở. Ví dụ, [Ne] cho cấu hình của Nhôm.
6.3. Bài tập dự đoán tính chất từ cấu hình electron
Dựa vào cấu hình electron, hãy dự đoán tính chất hóa học và vật lý của các nguyên tố sau:
- Phốt pho (Z = 15): Dự đoán tính chất và đặc điểm phản ứng.
- Đồng (Z = 29): Dự đoán trạng thái oxy hóa thông dụng và ứng dụng.
- Brom (Z = 35): Dự đoán tính chất oxy hóa khử và khả năng liên kết.
Gợi ý giải:
- Xác định nhóm và chu kỳ của nguyên tố trong bảng tuần hoàn.
- Đánh giá tính kim loại/phi kim, tính chất hóa học và trạng thái oxy hóa dựa trên cấu hình electron lớp ngoài cùng.
Thực hành các bài tập trên sẽ giúp bạn hiểu rõ hơn về cấu hình electron và các ứng dụng của nó trong việc dự đoán tính chất nguyên tố cũng như các đặc điểm phản ứng hóa học.

7. Câu hỏi thường gặp về cấu hình electron
7.1. Cách xác định số electron hóa trị từ cấu hình electron
Electron hóa trị là các electron nằm ở lớp vỏ ngoài cùng của một nguyên tử, đóng vai trò quan trọng trong việc xác định tính chất hóa học. Để xác định số electron hóa trị, bạn cần biết cấu hình electron của nguyên tử và đếm số electron ở lớp vỏ ngoài cùng. Ví dụ, cấu hình electron của natri (Na) là 1s2 2s2 2p6 3s1, cho thấy natri có 1 electron hóa trị.
7.2. Tại sao cấu hình electron lại quan trọng trong hóa học?
Cấu hình electron quyết định cách mà nguyên tử sẽ tương tác với nguyên tử khác trong các phản ứng hóa học. Nó giúp xác định tính chất hóa học của nguyên tố như khả năng tạo liên kết, độ âm điện, và trạng thái oxy hóa. Các nguyên tố có cấu hình electron tương tự thường có tính chất hóa học giống nhau và được xếp vào cùng một nhóm trong bảng tuần hoàn.
7.3. Sự khác biệt giữa các phân lớp s, p, d, và f là gì?
Các phân lớp s, p, d, và f khác nhau ở hình dạng và số lượng electron tối đa có thể chứa:
- Phân lớp s: Hình cầu, chứa tối đa 2 electron.
- Phân lớp p: Hình dạng số tám nằm ngang, chứa tối đa 6 electron.
- Phân lớp d: Hình cỏ ba lá hoặc hình số tám đôi, chứa tối đa 10 electron.
- Phân lớp f: Hình phức tạp hơn, chứa tối đa 14 electron.
7.4. Các quy tắc chính khi viết cấu hình electron là gì?
Việc viết cấu hình electron tuân theo ba quy tắc chính:
- Quy tắc Aufbau: Electron điền vào các orbital có mức năng lượng thấp trước khi điền vào các orbital có mức năng lượng cao hơn.
- Quy tắc Hund: Trong các orbital có cùng năng lượng, mỗi orbital phải được điền ít nhất một electron trước khi thêm electron thứ hai.
- Nguyên lý loại trừ Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và chúng phải có spin ngược nhau.
7.5. Làm thế nào để viết cấu hình electron theo phương pháp rút gọn?
Phương pháp rút gọn sử dụng các khí hiếm làm "dấu mốc". Ví dụ, cấu hình electron của bromine (Br) có thể viết là [Ar] 4s2 3d10 4p5, trong đó [Ar] đại diện cho cấu hình electron của argon.

8. Tài liệu tham khảo và học thêm
Để hiểu rõ hơn về cấu hình electron, bạn có thể tham khảo các nguồn tài liệu sau đây:
- Sách giáo khoa hóa học:
- "Hóa học đại cương" - Một cuốn sách cung cấp kiến thức cơ bản về cấu hình electron và các nguyên lý hóa học cơ bản.
- "Nguyên tử và phân tử học" - Tập trung vào cấu trúc của nguyên tử, cách viết cấu hình electron, và các ứng dụng thực tiễn.
- Các trang web học tập:
- - Cung cấp các khóa học miễn phí về hóa học, bao gồm cả cấu hình electron.
- - Trang web chuyên sâu về hóa học, giải thích chi tiết cấu hình electron và các quy tắc liên quan.
- Video hướng dẫn và bài giảng trực tuyến:
- - Nhiều kênh giáo dục cung cấp các bài giảng video về cách viết cấu hình electron, ví dụ như "CrashCourse Chemistry" hay "Tyler DeWitt".
- - Nền tảng học trực tuyến với các khóa học từ các trường đại học danh tiếng về hóa học.
Hy vọng các nguồn tài liệu trên sẽ giúp bạn nắm vững kiến thức về cấu hình electron và áp dụng vào học tập cũng như thực tế!