Chủ đề mass of electron and proton: Mass of electron and proton là một chủ đề quan trọng trong vật lý hạt cơ bản. Bài viết này sẽ khám phá chi tiết về khối lượng của electron và proton, sự khác biệt giữa chúng và tầm quan trọng của những hạt này trong cấu trúc nguyên tử và các phản ứng hóa học.
Mục lục
Khối Lượng của Electron và Proton
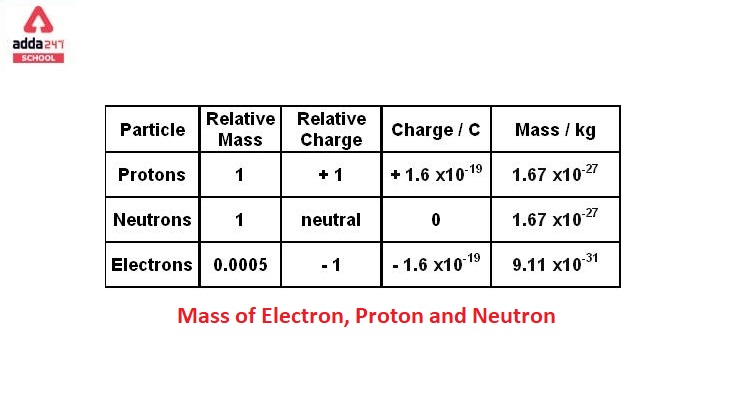
Electron và proton là hai trong số các hạt cơ bản cấu thành nên nguyên tử. Dưới đây là các thông tin chi tiết về khối lượng của electron và proton:
Khối Lượng Electron
Electron là một hạt hạ nguyên tử mang điện tích âm và có khối lượng rất nhỏ so với proton. Công thức tính khối lượng của electron như sau:
\[ m_e = 9.10938356 \times 10^{-31} \text{ kg} \]
\[ m_e = 0.00054858 \text{ u} \]
Trong đó, \( u \) là đơn vị khối lượng nguyên tử (atomic mass unit).
Khối Lượng Proton
Proton là một hạt hạ nguyên tử mang điện tích dương và có khối lượng lớn hơn electron nhiều lần. Công thức tính khối lượng của proton như sau:
\[ m_p = 1.67262192 \times 10^{-27} \text{ kg} \]
\[ m_p = 1.007276 \text{ u} \]
So Sánh Khối Lượng Giữa Electron và Proton
Khối lượng của proton lớn hơn khối lượng của electron khoảng 1836 lần. Điều này có thể biểu thị qua tỷ lệ khối lượng của hai hạt:
\[ \frac{m_p}{m_e} \approx 1836 \]
Tầm Quan Trọng Của Khối Lượng Các Hạt
- Khối lượng của các hạt cơ bản quyết định đến tính chất hóa học và vật lý của nguyên tử.
- Proton và neutron, với khối lượng lớn, chủ yếu đóng góp vào khối lượng của nguyên tử.
- Electron, dù có khối lượng nhỏ, lại đóng vai trò quan trọng trong các phản ứng hóa học và sự hình thành liên kết hóa học.
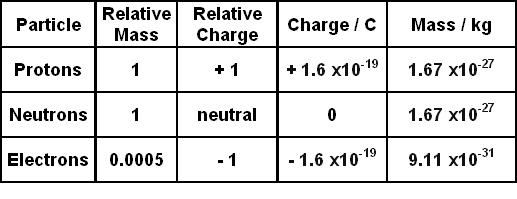
Bảng Khối Lượng Các Hạt
| Hạt | Khối lượng (kg) | Khối lượng (u) |
|---|---|---|
| Electron | 9.10938356 × 10-31 | 0.00054858 |
| Proton | 1.67262192 × 10-27 | 1.007276 |
.png)
1. Giới thiệu về khối lượng hạt cơ bản
Khối lượng của các hạt cơ bản như electron và proton đóng vai trò quan trọng trong cấu trúc và tính chất của nguyên tử. Dưới đây là thông tin chi tiết về khối lượng của hai hạt này:
- Electron là hạt mang điện tích âm với khối lượng rất nhỏ so với proton. Khối lượng của electron được tính bằng công thức: \[ m_e = 9.10938356 \times 10^{-31} \text{ kg} \] hoặc \[ m_e = 0.00054858 \text{ u} \]
- Proton là hạt mang điện tích dương với khối lượng lớn hơn electron nhiều lần. Khối lượng của proton được tính bằng công thức: \[ m_p = 1.67262192 \times 10^{-27} \text{ kg} \] hoặc \[ m_p = 1.007276 \text{ u} \]
So sánh khối lượng giữa electron và proton cho thấy proton có khối lượng lớn hơn electron khoảng 1836 lần, thể hiện qua tỷ lệ:
\[ \frac{m_p}{m_e} \approx 1836 \]
Khối lượng của các hạt cơ bản không chỉ ảnh hưởng đến tính chất hóa học và vật lý của nguyên tử mà còn là cơ sở cho nhiều nghiên cứu và ứng dụng trong vật lý và hóa học.
2. Cách tính khối lượng nguyên tử
Khối lượng nguyên tử là tổng khối lượng của các hạt cơ bản trong nguyên tử, bao gồm proton, neutron và electron. Tuy nhiên, khối lượng của electron rất nhỏ so với proton và neutron nên thường không được tính vào khối lượng nguyên tử.
Để tính khối lượng nguyên tử, chúng ta sử dụng công thức:
\[ A = Z + N \]
Trong đó:
- A: Số khối (tổng số proton và neutron trong hạt nhân).
- Z: Số proton trong nguyên tử.
- N: Số neutron trong nguyên tử.
Ví dụ: Để tính khối lượng nguyên tử của carbon-12 (C-12):
- Số proton (Z) của carbon là 6.
- Số neutron (N) của carbon-12 là 6.
- Số khối (A) = 6 + 6 = 12.
Như vậy, khối lượng nguyên tử của carbon-12 là 12 đơn vị khối lượng nguyên tử (amu).
Khối lượng nguyên tử được biểu diễn bằng đơn vị khối lượng nguyên tử (amu) hoặc kilogram (kg) trong các phép tính hóa học và vật lý. Đơn vị khối lượng nguyên tử (amu) được định nghĩa bằng 1/12 khối lượng của một nguyên tử carbon-12.
Các bước tính khối lượng nguyên tử:
- Xác định số proton (Z) trong nguyên tử.
- Xác định số neutron (N) trong nguyên tử.
- Tính tổng số proton và neutron để có số khối (A).
- Sử dụng công thức \[ A = Z + N \] để tìm khối lượng nguyên tử.
Lưu ý rằng, khối lượng của một nguyên tử thường nhỏ hơn tổng khối lượng các hạt cấu tạo của nó do hiện tượng giảm khối lượng do năng lượng liên kết, được tính theo công thức Einstein \[ E = mc^2 \]. Tuy nhiên, sự giảm khối lượng này thường rất nhỏ và không ảnh hưởng lớn đến khối lượng nguyên tử tổng thể.

3. Các yếu tố ảnh hưởng đến khối lượng nguyên tử
Khối lượng nguyên tử của một nguyên tố phụ thuộc vào nhiều yếu tố khác nhau. Dưới đây là những yếu tố chính ảnh hưởng đến khối lượng nguyên tử:
- Số lượng proton và neutron: Khối lượng của nguyên tử được xác định chủ yếu bởi tổng số proton và neutron trong hạt nhân. Proton và neutron có khối lượng xấp xỉ nhau và nặng hơn electron rất nhiều.
- Khối lượng của electron: Mặc dù electron có khối lượng rất nhỏ so với proton và neutron, chúng vẫn góp phần vào khối lượng tổng thể của nguyên tử, đặc biệt là trong các nguyên tử nhẹ.
- Đồng vị: Các nguyên tử của cùng một nguyên tố có thể có số lượng neutron khác nhau, dẫn đến các đồng vị khác nhau với khối lượng khác nhau. Ví dụ, carbon-12 và carbon-14 là hai đồng vị của carbon với số neutron khác nhau.
- Năng lượng liên kết hạt nhân: Khi các proton và neutron kết hợp lại để tạo thành hạt nhân, một phần khối lượng của chúng được chuyển thành năng lượng liên kết hạt nhân. Điều này có nghĩa là khối lượng của hạt nhân nhỏ hơn tổng khối lượng của các proton và neutron riêng lẻ.
- Môi trường hóa học: Trong một số trường hợp, khối lượng nguyên tử có thể bị ảnh hưởng bởi môi trường hóa học xung quanh, chẳng hạn như khi các electron tương tác với các hạt khác trong một hợp chất hóa học.
Việc hiểu rõ các yếu tố này không chỉ giúp chúng ta có cái nhìn sâu sắc hơn về cấu trúc nguyên tử mà còn có thể ứng dụng trong nhiều lĩnh vực khoa học và công nghệ khác nhau.
4. Bảng khối lượng nguyên tử của các nguyên tố phổ biến
Khối lượng nguyên tử là một trong những thông số quan trọng nhất trong hóa học và vật lý. Dưới đây là bảng khối lượng nguyên tử của một số nguyên tố phổ biến, giúp bạn hiểu rõ hơn về đặc tính của chúng và tầm quan trọng của chúng trong các phản ứng hóa học và ứng dụng thực tế.
| Nguyên tố | Ký hiệu | Khối lượng nguyên tử (u) |
|---|---|---|
| Hydro | H | 1.008 |
| Heli | He | 4.0026 |
| Carbon | C | 12.01 |
| Nitơ | N | 14.01 |
| Oxy | O | 16.00 |
| Flo | F | 19.00 |
| Neon | Ne | 20.18 |
| Natri | Na | 22.99 |
| Magie | Mg | 24.31 |
| Nhôm | Al | 26.98 |
| Silic | Si | 28.09 |
| Lưu huỳnh | S | 32.07 |
| Clor | Cl | 35.45 |
| Argon | Ar | 39.95 |
| Kali | K | 39.10 |
| Canxi | Ca | 40.08 |
Khối lượng nguyên tử của mỗi nguyên tố được đo lường chính xác và có thể thay đổi dựa trên đồng vị của nguyên tố đó. Hiểu rõ về khối lượng nguyên tử giúp chúng ta dự đoán được các tính chất hóa học và vật lý của nguyên tố cũng như cách chúng phản ứng trong các quá trình hóa học.

5. Ứng dụng của khối lượng nguyên tử trong hóa học
Khối lượng nguyên tử đóng vai trò quan trọng trong nhiều ứng dụng hóa học. Hiểu rõ về khối lượng nguyên tử giúp các nhà khoa học dự đoán tính chất của các nguyên tố và phản ứng hóa học. Một số ứng dụng chính bao gồm:
- Tính toán tỷ lệ phản ứng: Khối lượng nguyên tử giúp xác định tỷ lệ mol giữa các chất phản ứng và sản phẩm trong phản ứng hóa học.
- Phân tích định lượng: Sử dụng khối lượng nguyên tử, các nhà hóa học có thể xác định khối lượng của các nguyên tố trong hợp chất và từ đó xác định công thức phân tử.
- Phát triển vật liệu mới: Hiểu rõ khối lượng nguyên tử giúp trong việc thiết kế và tổng hợp các vật liệu mới với các tính chất cụ thể.
- Xác định cấu trúc phân tử: Khối lượng nguyên tử được sử dụng trong các phương pháp như phổ khối để xác định cấu trúc phân tử của các hợp chất.
- Ứng dụng trong y học: Khối lượng nguyên tử của các nguyên tố phóng xạ được sử dụng trong điều trị và chẩn đoán y học, như trong xạ trị và PET scan.
Như vậy, khối lượng nguyên tử không chỉ là một khái niệm cơ bản trong hóa học mà còn là một công cụ quan trọng trong nhiều lĩnh vực nghiên cứu và ứng dụng thực tiễn.
XEM THÊM:
6. Kết luận
Khối lượng của electron và proton đóng vai trò quan trọng trong việc xác định các đặc tính và hành vi của nguyên tử. Electron là các hạt mang điện tích âm, có khối lượng rất nhỏ so với proton, vốn mang điện tích dương và nằm trong hạt nhân nguyên tử.
Proton góp phần vào sự ổn định và xác định danh tính của một nguyên tử, trong khi electron tham gia vào các phản ứng hóa học và sự hình thành liên kết hóa học. Sự chênh lệch về khối lượng và điện tích giữa electron và proton là yếu tố cơ bản quyết định cấu trúc và tính chất của nguyên tử.
Hiểu rõ về khối lượng của các hạt này giúp chúng ta nắm vững các nguyên lý cơ bản trong hóa học và vật lý, đồng thời ứng dụng vào các lĩnh vực khoa học và công nghệ như phát triển các thiết bị điện tử, y học hạt nhân, và sản xuất năng lượng.
Nhìn chung, khối lượng của electron và proton không chỉ ảnh hưởng đến cấu trúc vi mô của nguyên tử mà còn có những ứng dụng rộng rãi trong cuộc sống hàng ngày và các ngành công nghiệp khác nhau.