Chủ đề youtube electron: YouTube Electron là nền tảng phát triển mạnh mẽ, giúp tạo ra những ứng dụng desktop đột phá bằng cách kết hợp công nghệ web và Electron. Hãy cùng khám phá cách Electron mang lại sự tiện ích và cải tiến cho việc phát triển ứng dụng, từ giải trí đến công việc, trên mọi hệ điều hành.
Mục lục
Youtube Electron: Khái Niệm và Ứng Dụng Công Nghệ
YouTube Electron là một thuật ngữ phổ biến trong lĩnh vực phát triển phần mềm ứng dụng desktop với Electron, một framework mã nguồn mở được tạo ra bởi GitHub. Electron cho phép nhà phát triển xây dựng ứng dụng desktop đa nền tảng bằng cách sử dụng công nghệ web như HTML, CSS và JavaScript, kết hợp với Node.js và trình duyệt Chromium.
Ứng dụng của YouTube Electron
Nhờ khả năng tích hợp cao, Electron được sử dụng để xây dựng các ứng dụng phức tạp như YouTube Music Desktop App, một phần mềm cho phép người dùng nghe nhạc trên YouTube với giao diện tối ưu cho máy tính để bàn, hoặc một số tiện ích hỗ trợ quá trình phát triển phần mềm và sáng tạo nội dung video YouTube.
Lợi ích khi sử dụng Electron
- Chạy trên đa nền tảng (Windows, Mac, Linux).
- Dễ dàng tích hợp với các dịch vụ và công cụ phát triển web.
- Hỗ trợ xây dựng ứng dụng nhanh chóng với thư viện phong phú và cộng đồng phát triển lớn.
Các ví dụ về dự án Electron nổi bật
- Slack: Ứng dụng nhắn tin nhóm phổ biến được xây dựng trên Electron.
- Visual Studio Code: Trình biên tập mã nguồn được phát triển bởi Microsoft.
- Discord: Nền tảng giao tiếp và trò chuyện cho cộng đồng game thủ.
Toán học về Electron trong Vật lý
Trong vật lý học, electron là một hạt hạ nguyên tử với điện tích âm. Cấu hình electron trong các nguyên tử được quyết định theo các quy tắc như nguyên tắc Hund và nguyên lý loại trừ Pauli. Ví dụ:
- Theo nguyên tắc Hund, electron sẽ chiếm các orbital đơn lẻ trước khi ghép đôi.
- Nguyên lý loại trừ Pauli quy định rằng không có hai electron trong cùng một nguyên tử có thể có cùng một tập hợp bốn số lượng tử \((n, l, m, s)\).
Phân bố electron trong các lớp vỏ nguyên tử tuân theo công thức:
\[2n^2\]
Ví dụ:
- Lớp K (n=1): chứa tối đa 2 electron.
- Lớp L (n=2): chứa tối đa 8 electron.
Cấu hình electron đóng vai trò quan trọng trong việc xác định các tính chất hóa học của nguyên tố.
Kết luận
YouTube Electron không chỉ là một công cụ phát triển hữu ích mà còn là một phần quan trọng của nhiều ứng dụng phổ biến hiện nay. Từ khía cạnh công nghệ đến vật lý, electron có vai trò đa dạng và ứng dụng trong nhiều lĩnh vực khác nhau.

.png)
1. Giới thiệu về Electron
Electron là một hạt cơ bản mang điện tích âm, tồn tại trong mọi nguyên tử. Trong cấu trúc nguyên tử, electron quay quanh hạt nhân và đóng vai trò quan trọng trong nhiều hiện tượng vật lý và hóa học. Các electron trong lớp vỏ nguyên tử quyết định tính chất hóa học của nguyên tố và là cơ sở cho các phản ứng hóa học, cũng như tính dẫn điện của vật liệu.
Theo thuyết electron, các electron có thể dịch chuyển từ nguyên tử này sang nguyên tử khác, tạo nên các hiện tượng điện như nhiễm điện do tiếp xúc, hưởng ứng, và cọ xát. Khi một vật nhiễm điện âm, số lượng electron của nó lớn hơn số proton, trong khi đó nếu vật nhiễm điện dương, số lượng proton sẽ nhiều hơn electron.
Electron không chỉ có vai trò quan trọng trong hóa học và vật lý mà còn là nền tảng cho công nghệ hiện đại. Trong lĩnh vực phát triển ứng dụng, Electron (một framework) là công cụ hỗ trợ lập trình viên xây dựng ứng dụng đa nền tảng bằng cách sử dụng công nghệ web như HTML, CSS, và JavaScript. Electron giúp tạo ra các ứng dụng với hiệu suất cao, đồng thời có khả năng tương thích với nhiều hệ điều hành khác nhau.
2. Cấu hình Electron
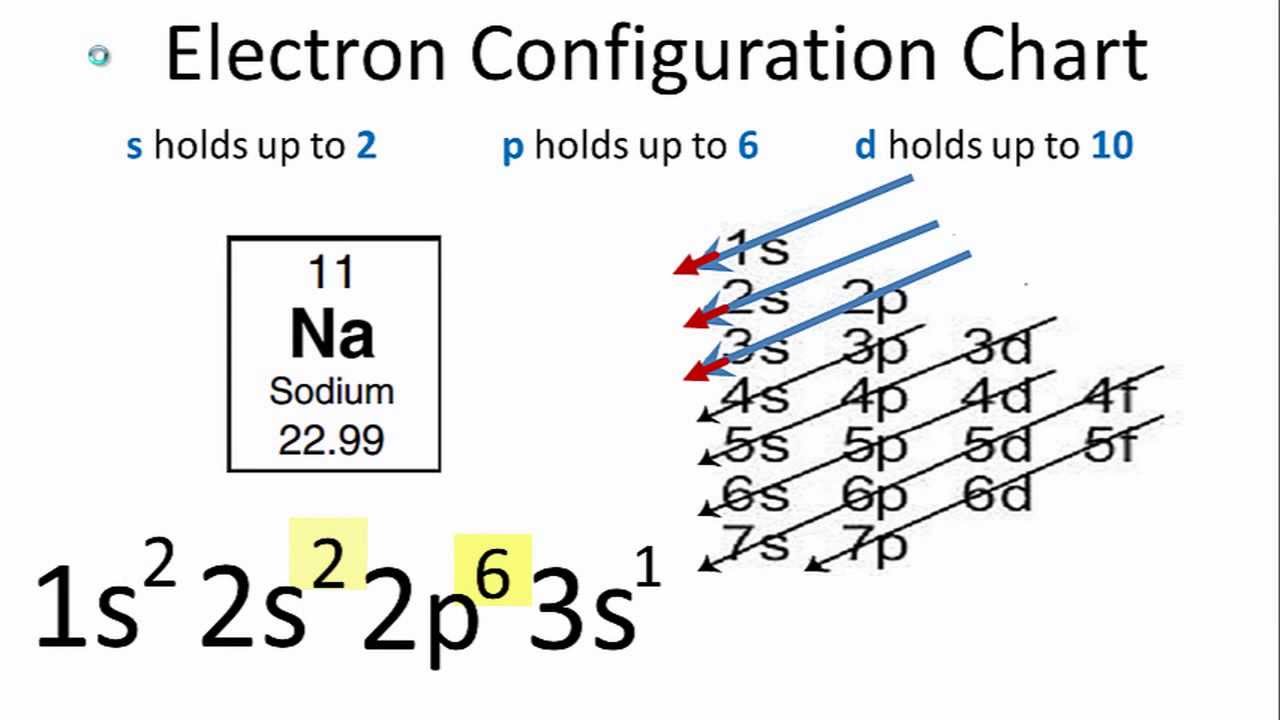
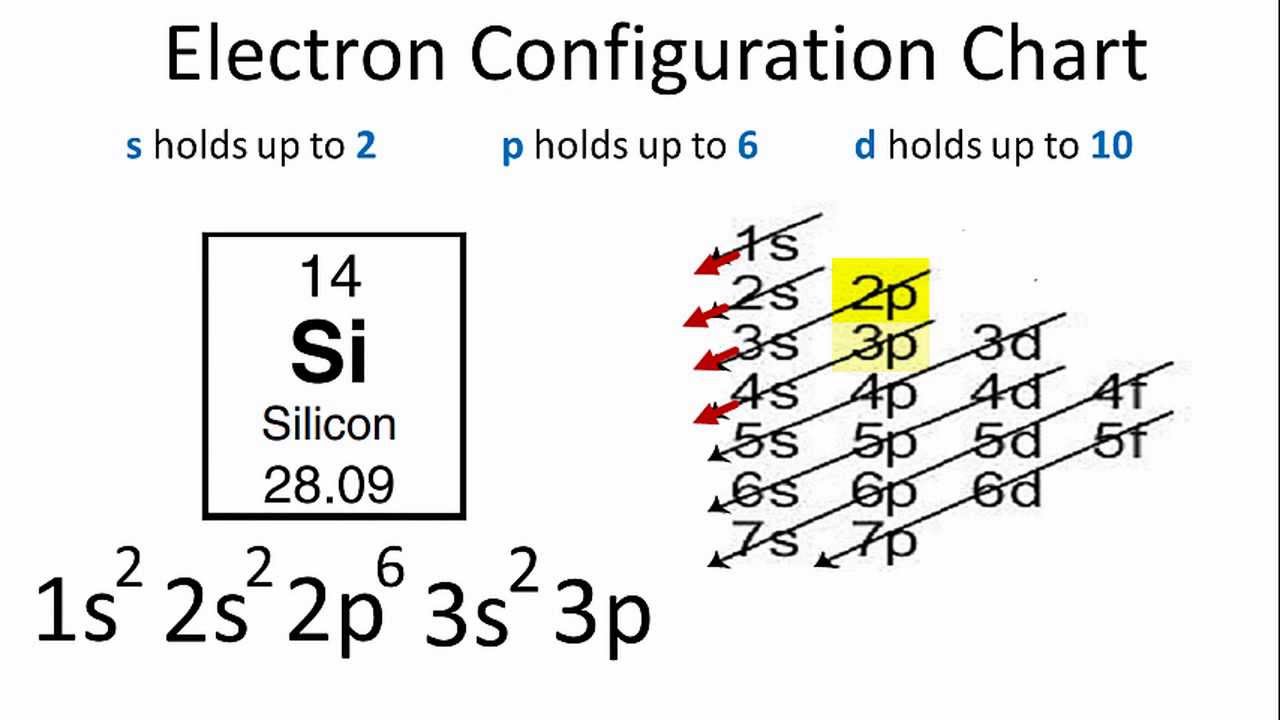
Cấu hình electron là cách sắp xếp các electron trong các lớp và phân lớp của nguyên tử. Việc hiểu rõ cấu hình electron giúp ta hiểu sâu hơn về tính chất hóa học và vật lý của các nguyên tố.
Để viết cấu hình electron, ta cần thực hiện theo các bước:
- Xác định số electron của nguyên tử hoặc ion, được ký hiệu là Z.
- Sắp xếp các electron theo thứ tự tăng dần mức năng lượng, tuân theo các nguyên lý Aufbau, Pauli, và Hund.
- Điền các electron vào các phân lớp (s, p, d, f) theo thứ tự năng lượng và quy tắc bão hòa, bán bão hòa đối với các phân lớp d và f.
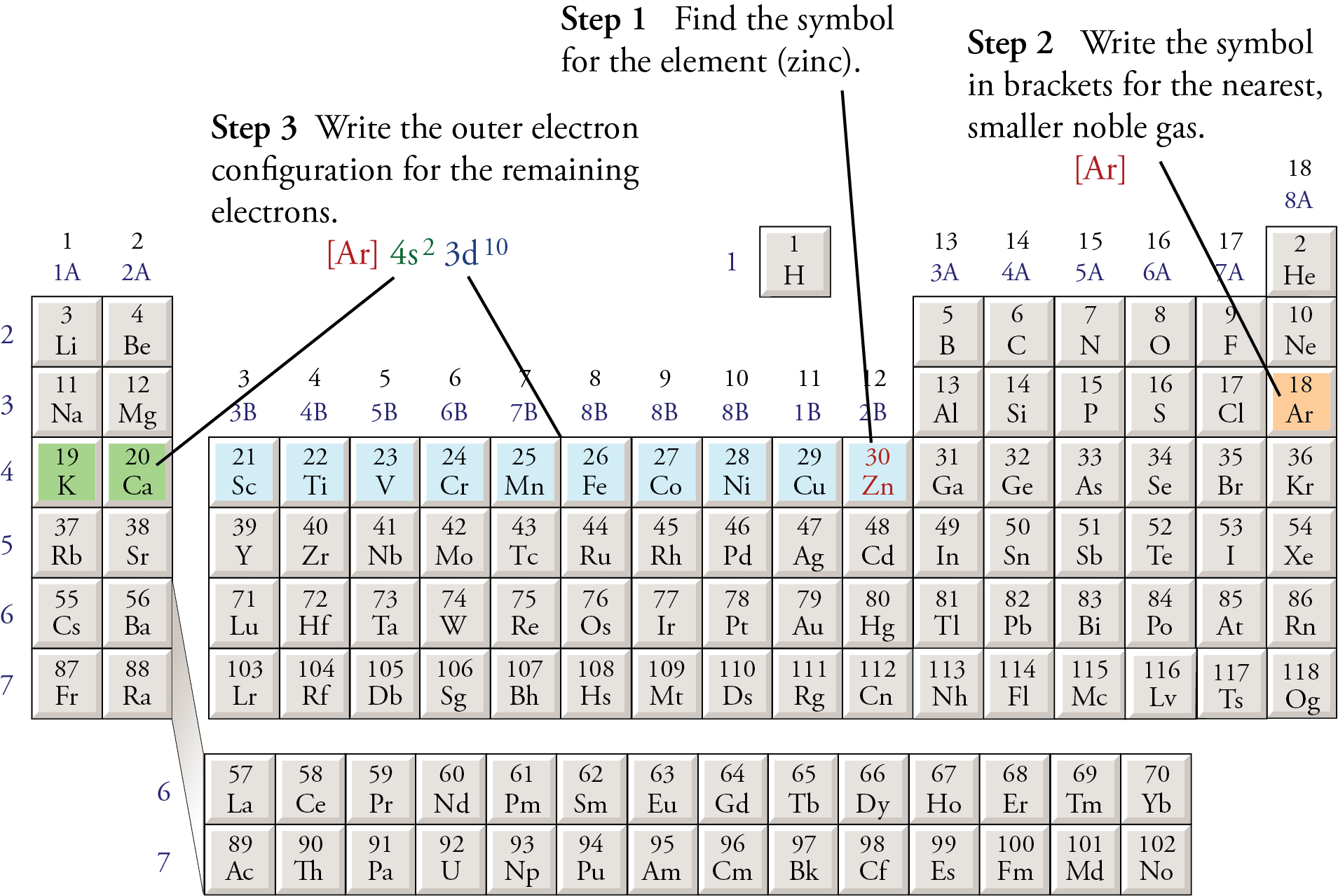
Ví dụ, cấu hình electron của nguyên tử sắt (Fe) với Z = 26 là:
- Cấu hình đầy đủ: 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁶ 4s².
- Cấu hình rút gọn: [Ar] 3d⁶ 4s² (trong đó [Ar] là cấu hình của khí hiếm argon).
Cấu hình electron không chỉ mô tả sự phân bố electron mà còn giúp dự đoán tính chất hóa học của các nguyên tố. Lớp electron ngoài cùng quyết định khả năng tương tác hóa học của nguyên tố đó.

3. Công thức và ứng dụng của Electron
Electron đóng vai trò quan trọng trong cấu tạo nguyên tử và các phản ứng hóa học. Cấu trúc của electron xung quanh hạt nhân ảnh hưởng đến tính chất vật lý và hóa học của nguyên tố. Để hiểu rõ hơn về cấu tạo và vai trò của electron, chúng ta cần tìm hiểu các công thức liên quan đến phân bố electron và cách chúng ảnh hưởng đến phản ứng hóa học.
Trong hóa học, các công thức liên quan đến electron thường bao gồm công thức cấu hình electron, công thức Lewis, và các phương trình bảo toàn electron trong các phản ứng oxi hóa - khử. Các ứng dụng của electron rất phong phú, từ việc giải các bài toán hóa học phức tạp đến các ứng dụng công nghệ hiện đại như điện tử và vật liệu siêu dẫn.
Ví dụ, định luật bảo toàn electron giúp chúng ta cân bằng các phương trình hóa học một cách hiệu quả, đảm bảo rằng số electron nhường và nhận trong phản ứng luôn bằng nhau. Một trong những ứng dụng tiêu biểu của công thức bảo toàn electron là giải quyết bài toán liên quan đến phản ứng oxi hóa - khử, chẳng hạn như phản ứng giữa kim loại và axit, được sử dụng phổ biến trong công nghiệp hóa học.
- Ví dụ về phản ứng oxi hóa - khử: \( Zn + H_2SO_4 \rightarrow ZnSO_4 + H_2 \)
- Phương pháp giải bằng công thức bảo toàn electron: Sử dụng định luật bảo toàn electron để cân bằng các phản ứng phức tạp.
- Các ứng dụng công nghiệp: Electron đóng vai trò quan trọng trong các thiết bị điện tử và các ngành công nghệ cao.
Nhìn chung, electron không chỉ là hạt cơ bản trong vật lý mà còn có nhiều ứng dụng trong thực tiễn, từ giáo dục đến công nghiệp.
XEM THÊM:
4. Các yếu tố ảnh hưởng đến số Electron
Số electron trong một nguyên tử hoặc phân tử bị ảnh hưởng bởi nhiều yếu tố khác nhau. Trong đó, số lượng proton trong hạt nhân quyết định trực tiếp đến số electron thông qua quy luật điện tích cân bằng. Dưới đây là một số yếu tố chính ảnh hưởng đến số electron:
- Điện tích hạt nhân: Proton mang điện tích dương, do đó số lượng proton trong hạt nhân càng lớn thì số electron xung quanh càng nhiều để cân bằng điện tích.
- Mức năng lượng của electron: Electron tồn tại trong các lớp vỏ năng lượng khác nhau xung quanh hạt nhân. Các electron ở lớp vỏ ngoài dễ bị tác động và tham gia vào các phản ứng hóa học hơn.
- Điện trường ngoài: Khi nguyên tử hoặc phân tử nằm trong một điện trường mạnh, số electron có thể thay đổi do tác động của lực điện trường, làm electron di chuyển hoặc bị tách ra khỏi nguyên tử.
- Phản ứng hóa học: Các phản ứng hóa học có thể làm thay đổi số electron của các nguyên tử, ví dụ như trong quá trình oxy hóa, nguyên tử mất electron hoặc trong quá trình khử, nguyên tử nhận thêm electron.
- Điều kiện môi trường: Nhiệt độ, áp suất và các điều kiện khác cũng ảnh hưởng đến sự phân bố và số lượng electron trong các nguyên tử hoặc phân tử.

5. Phân tích chuyên sâu về Electron trong Hóa học
Trong hóa học, electron đóng vai trò quan trọng trong cấu trúc nguyên tử và sự tương tác giữa các nguyên tử. Electron di chuyển quanh hạt nhân theo các quỹ đạo xác định, được tổ chức theo lớp và phân lớp. Theo mô hình Bohr, electron chỉ tồn tại ở các quỹ đạo có năng lượng cụ thể và phát ra photon khi chuyển giữa các quỹ đạo này.
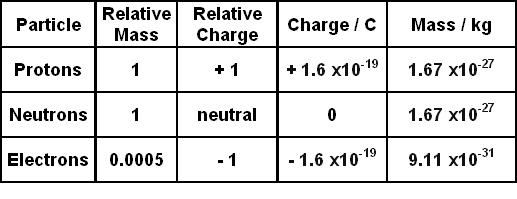
Electron có điện tích âm và khối lượng rất nhỏ, khoảng 9.109 × 10^{-31} kg. Điện tích của electron là -1.602 × 10^{-19} coulomb, là đơn vị cơ bản của điện tích âm. Chúng di chuyển quanh hạt nhân theo các lớp vỏ được ký hiệu bằng chữ cái K, L, M,..., với số electron tối đa tuân theo công thức \(2n^2\), trong đó \(n\) là số thứ tự của lớp vỏ.
Một trong những nguyên lý quan trọng liên quan đến electron là nguyên lý Pauli, phát biểu rằng không có hai electron trong cùng một nguyên tử có cùng bốn số lượng tử giống nhau. Điều này quyết định sự sắp xếp của các electron trong các lớp và phân lớp khác nhau, ảnh hưởng đến tính chất hóa học của nguyên tố.
Quỹ đạo của electron cũng được xác định bằng bán kính, tính theo công thức:
với \(n\) là số nguyên đại diện cho mức năng lượng của quỹ đạo. Các electron ở mức năng lượng khác nhau có năng lượng được tính bằng công thức:
trong đó \(Z\) là điện tích hạt nhân và \(n\) là số lượng tử chính. Đây là những yếu tố giúp xác định vị trí và năng lượng của electron trong nguyên tử.