Chủ đề v3+ electron configuration: V3+ electron configuration là một chủ đề quan trọng trong hóa học, đặc biệt khi nghiên cứu về cấu trúc nguyên tử và tính chất hóa học của các nguyên tố. Bài viết này sẽ cung cấp thông tin chi tiết về cách viết cấu hình electron của ion V3+, cùng với những lưu ý quan trọng và ứng dụng thực tế trong các phản ứng hóa học. Hãy cùng khám phá để hiểu rõ hơn về vai trò của cấu hình electron trong việc xác định tính chất hóa học của các nguyên tố.
Mục lục
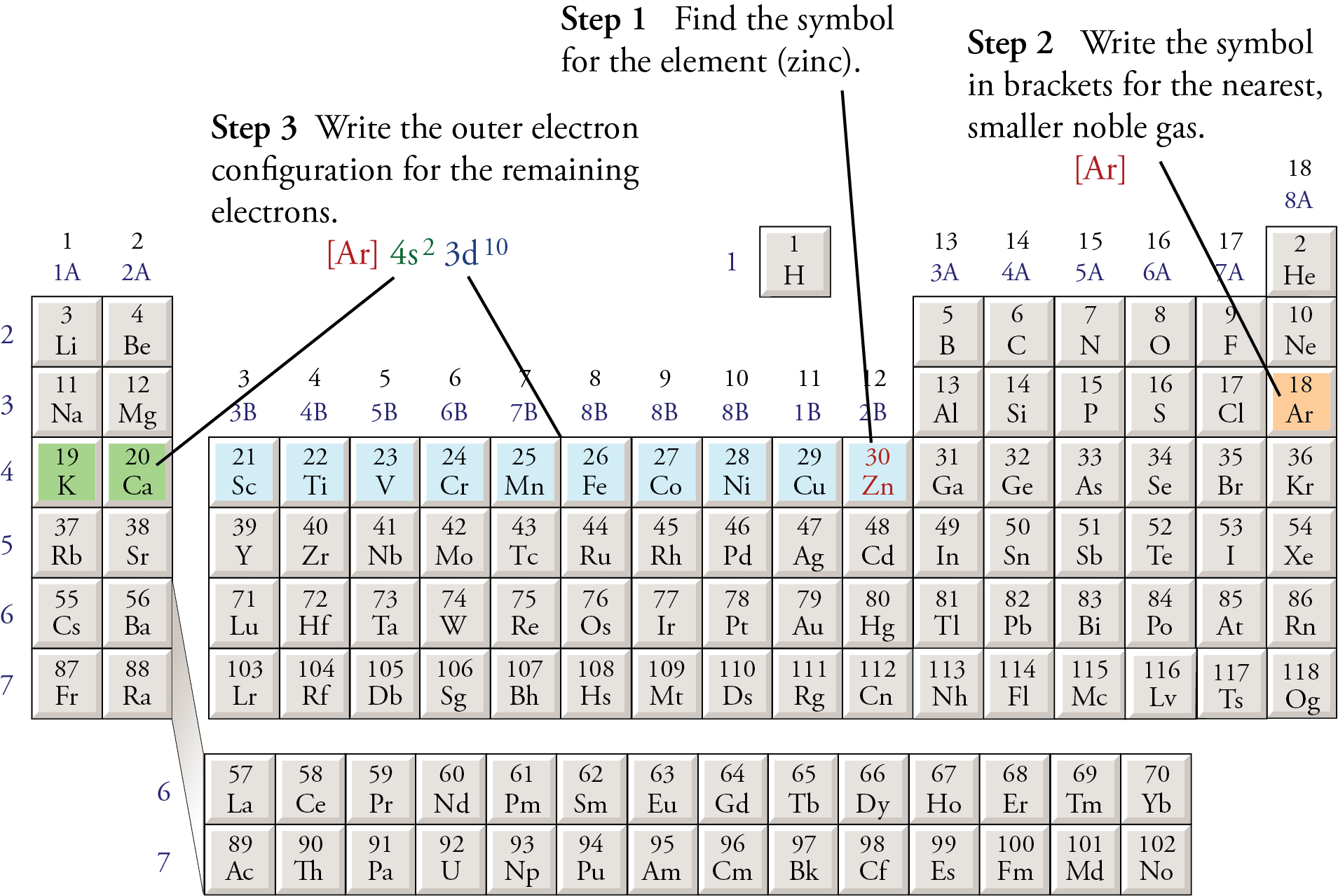
Cấu hình electron của V3+ (Vanadi ion)
Ion V3+ được hình thành khi nguyên tử Vanadi (Z = 23) mất đi ba electron. Để xác định cấu hình electron của V3+, trước tiên ta cần biết cấu hình electron của nguyên tử Vanadi ở trạng thái cơ bản.
Cấu hình electron của Vanadi (V)
Vanadi có số hiệu nguyên tử là 23, nghĩa là có 23 electron. Cấu hình electron của Vanadi ở trạng thái cơ bản là:
\[
1s^2 \ 2s^2 \ 2p^6 \ 3s^2 \ 3p^6 \ 4s^2 \ 3d^3
\]
Hoặc viết gọn hơn, dựa trên cấu hình của Argon (Ar):
\[
[Ar] \ 3d^3 \ 4s^2
\]
Quá trình ion hóa và cấu hình của V3+
Để tạo thành ion V3+, Vanadi mất ba electron. Các electron mất đi theo thứ tự từ phân lớp có năng lượng cao hơn đến thấp hơn. Do đó, cấu hình của V3+ sẽ là:
\[
[Ar] \ 3d^2
\]
Trong đó, hai electron đầu tiên bị mất từ phân lớp 4s và electron thứ ba bị mất từ phân lớp 3d.
Tóm tắt quá trình
- Cấu hình electron của Vanadi (V): \[1s^2 \ 2s^2 \ 2p^6 \ 3s^2 \ 3p^6 \ 4s^2 \ 3d^3\]
- Cấu hình electron rút gọn của Vanadi (V): \[[Ar] \ 3d^3 \ 4s^2\]
- Cấu hình electron của ion V3+: \[[Ar] \ 3d^2\]
Việc xác định đúng cấu hình electron của các ion rất quan trọng trong việc hiểu các tính chất hóa học và vật lý của chúng. Đối với V3+, sự mất mát electron dẫn đến một cấu hình bền vững hơn và ảnh hưởng đến các đặc tính như màu sắc, từ tính, và phản ứng hóa học của ion.
 3+ (Vanadi ion)" style="object-fit:cover; margin-right: 20px;" width="760px" height="428">
3+ (Vanadi ion)" style="object-fit:cover; margin-right: 20px;" width="760px" height="428">.png)
1. Giới Thiệu về Cấu Hình Electron
Cấu hình electron là cách phân bố các electron trong nguyên tử vào các mức năng lượng và các phân lớp tương ứng. Cấu hình electron giúp chúng ta hiểu rõ hơn về tính chất hóa học và vật lý của các nguyên tố, cũng như vị trí của chúng trong bảng tuần hoàn. Việc viết cấu hình electron cần tuân theo một số quy tắc cơ bản như nguyên lý Pauli, quy tắc Hund, và quy tắc Aufbau, để đảm bảo electron được phân bố một cách chính xác và tối ưu.
Để viết cấu hình electron cho một nguyên tố, chúng ta cần thực hiện các bước sau:
- Xác định số electron của nguyên tử: Số electron được xác định bằng số proton (Z) của nguyên tử. Ví dụ, vanadi (V) có số nguyên tử Z = 23, do đó có 23 electron.
- Phân bố các electron vào các mức năng lượng theo thứ tự tăng dần: Electron được phân bố vào các mức năng lượng theo thứ tự 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s,... Ví dụ, cấu hình electron của vanadi (Z = 23) sẽ là 1s2 2s2 2p6 3s2 3p6 4s2 3d3.
- Sắp xếp cấu hình electron theo quy tắc của bảng tuần hoàn: Các phân lớp electron được sắp xếp lại để phù hợp với từng lớp và phân lớp. Điều này giúp chúng ta dễ dàng nhận ra vị trí của nguyên tố trong bảng tuần hoàn và dự đoán tính chất hóa học của nó. Ví dụ, cấu hình electron của vanadi (V) viết gọn là [Ar]3d34s2.
Việc hiểu rõ và viết đúng cấu hình electron không chỉ giúp ta xác định được tính chất của nguyên tố mà còn là nền tảng để giải quyết các vấn đề phức tạp hơn trong hóa học như liên kết hóa học, tính chất từ tính và tính chất quang học của vật liệu.
2. Cấu Hình Electron Của Nguyên Tố Vanadi (V)
Vanadi (V) là một nguyên tố hóa học thuộc nhóm 5, chu kỳ 4 trong bảng tuần hoàn, với số hiệu nguyên tử là 23. Việc xác định cấu hình electron của Vanadi giúp ta hiểu rõ hơn về các tính chất hóa học và vật lý của nguyên tố này, đặc biệt là trong các phản ứng hóa học và ứng dụng công nghiệp.
Cấu hình electron của Vanadi ở trạng thái cơ bản được xác định dựa trên số lượng electron có trong nguyên tử. Với Vanadi, có tổng cộng 23 electron được phân bố vào các lớp và phân lớp năng lượng theo thứ tự tăng dần.
- Xác định số electron: Vanadi có số hiệu nguyên tử là 23, do đó, nguyên tử Vanadi có 23 electron.
- Phân bố electron vào các mức năng lượng:
Electron được phân bố vào các phân lớp theo thứ tự mức năng lượng từ thấp đến cao: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p,... Cấu hình electron của Vanadi có thể được viết như sau:
- 1s2 2s2 2p6 3s2 3p6 4s2 3d3
Viết gọn lại, cấu hình electron của Vanadi được biểu diễn dưới dạng:
- \[ \text{[Ar]} 3d^3 4s^2 \]
Ở trạng thái ion hóa +3, Vanadi mất đi 3 electron, thường từ phân lớp 4s và 3d. Cấu hình electron của ion V3+ là:
- \[ \text{[Ar]} 3d^2 \]
Điều này cho thấy, Vanadi ở trạng thái V3+ có cấu hình electron ổn định với phân lớp 3d có 2 electron. Cấu hình này ảnh hưởng đến tính chất hóa học của V3+, khiến nó hoạt động như một ion có tính chất hóa học đặc trưng của các kim loại chuyển tiếp.

3. Cấu Hình Electron Của Ion V3+
Ion V3+ được hình thành khi nguyên tử Vanadi (V) mất đi ba electron. Quá trình ion hóa này làm thay đổi cấu hình electron của nguyên tử, ảnh hưởng đến tính chất hóa học và vật lý của ion. Để xác định cấu hình electron của ion V3+, chúng ta cần tuân theo các bước sau:
- Xác định cấu hình electron của Vanadi (V): Trước tiên, ta cần biết cấu hình electron của nguyên tử Vanadi ở trạng thái cơ bản. Vanadi có số hiệu nguyên tử là 23, do đó cấu hình electron của nó là:
- \[1s^2 \ 2s^2 \ 2p^6 \ 3s^2 \ 3p^6 \ 4s^2 \ 3d^3\]
- Quá trình mất electron để tạo ion V3+: Khi Vanadi trở thành ion V3+, nó mất đi ba electron. Các electron này sẽ bị loại bỏ từ các phân lớp có mức năng lượng cao nhất trước tiên. Do đó, thứ tự mất electron sẽ là:
- Hai electron từ phân lớp 4s.
- Một electron từ phân lớp 3d.
- Xác định cấu hình electron của V3+: Sau khi mất đi ba electron, cấu hình electron còn lại của V3+ sẽ là:
- \[1s^2 \ 2s^2 \ 2p^6 \ 3s^2 \ 3p^6 \ 3d^2\]
- \[[Ar] \ 3d^2\]
Viết gọn lại dựa trên cấu hình của khí hiếm Argon (Ar):
Cấu hình electron của ion V3+ là \[[Ar] \ 3d^2\], cho thấy rằng nó có 18 electron sắp xếp theo cách giống như khí hiếm Argon, nhưng thêm 2 electron trong phân lớp 3d. Cấu hình này làm cho V3+ trở thành một ion có độ bền hóa học cao và ảnh hưởng đến các tính chất như từ tính và khả năng phản ứng trong các hợp chất hóa học.

4. Tính Chất Hóa Học của Ion V3+
Ion \(V^{3+}\) là một trong những trạng thái oxy hóa phổ biến của vanadi trong các hợp chất hóa học. Ion này có những tính chất hóa học đặc trưng ảnh hưởng bởi cấu hình electron và vị trí trong bảng tuần hoàn. Vanadi là kim loại chuyển tiếp thuộc nhóm VB và chu kỳ 4, do đó, ion \(V^{3+}\) có thể tham gia vào nhiều phản ứng hóa học khác nhau.
- Phản ứng với nước: Ion \(V^{3+}\) có thể thủy phân trong nước tạo thành các sản phẩm phức tạp hơn, đặc biệt trong môi trường kiềm hoặc axit.
- Phản ứng oxi hóa - khử: Vanadi có nhiều trạng thái oxi hóa khác nhau (từ +2 đến +5), trong đó ion \(V^{3+}\) có thể đóng vai trò như một chất khử mạnh, dễ dàng bị oxi hóa lên trạng thái cao hơn như \(V^{4+}\) hoặc \(V^{5+}\).
- Phản ứng với axit: Ion \(V^{3+}\) có thể phản ứng với các axit mạnh để tạo thành các hợp chất phức hoặc muối vanadi.
Tính chất hóa học của ion \(V^{3+}\) được quyết định bởi cấu hình electron còn lại sau khi mất đi 3 electron: \([Ar]3d^2\). Do đó, ion \(V^{3+}\) có tính chất từ hóa đặc biệt và có khả năng tạo phức với nhiều phối tử khác nhau, điều này làm cho nó trở nên quan trọng trong lĩnh vực hóa học phức chất.

5. Bài Tập và Ứng Dụng Cấu Hình Electron
Cấu hình electron là một phần quan trọng trong việc hiểu các tính chất hóa học của nguyên tố và ion. Để củng cố kiến thức về cấu hình electron của ion \(V^{3+}\) và cách nó ảnh hưởng đến tính chất hóa học, dưới đây là một số bài tập và ứng dụng thực tế.
Bài Tập Cơ Bản
- Viết cấu hình electron của ion \(V^{3+}\).
- Xác định số electron không ghép đôi trong ion \(V^{3+}\).
- Dự đoán tính chất từ của ion \(V^{3+}\).
Sử dụng cấu hình electron của nguyên tử Vanadi và loại bỏ ba electron từ các phân lớp có mức năng lượng cao nhất.
Với cấu hình electron là \([Ar]3d^2\), hãy xác định số electron không ghép đôi.
Ion \(V^{3+}\) có phải là chất thuận từ (paramagnetic) hay nghịch từ (diamagnetic)? Giải thích dựa trên cấu hình electron.
Bài Tập Nâng Cao
- So sánh tính chất hóa học của ion \(V^{3+}\) với các ion khác của vanadi như \(V^{2+}\) và \(V^{5+}\).
- Thiết kế một thí nghiệm để xác định cấu hình electron của ion \(V^{3+}\) trong phòng thí nghiệm.
- Tính toán năng lượng ion hóa thứ nhất, thứ hai và thứ ba của Vanadi.
Phân tích sự khác biệt về cấu hình electron và ảnh hưởng của chúng đến tính chất hóa học.
Mô tả các bước tiến hành và dụng cụ cần thiết để thực hiện thí nghiệm này.
Sử dụng dữ liệu năng lượng ion hóa, tính toán các giá trị tương ứng và so sánh với các nguyên tố trong cùng nhóm.
Ứng Dụng Thực Tế
- Trong công nghiệp: Ion \(V^{3+}\) được sử dụng trong sản xuất các hợp chất vanadi có tính chất xúc tác trong các phản ứng hóa học như phản ứng oxi hóa khử.
- Trong y học: Các hợp chất chứa ion \(V^{3+}\) đang được nghiên cứu để sử dụng trong các phương pháp điều trị bệnh như tiểu đường nhờ tính chất tăng cường độ nhạy insulin.
- Trong nghiên cứu khoa học: Ion \(V^{3+}\) được sử dụng để nghiên cứu cấu trúc electron của các hợp chất chuyển tiếp và sự hình thành phức chất.
Bằng cách giải các bài tập và nghiên cứu các ứng dụng trên, học sinh sẽ hiểu rõ hơn về vai trò của cấu hình electron trong hóa học và các ngành công nghiệp liên quan. Điều này không chỉ giúp củng cố kiến thức lý thuyết mà còn mở rộng khả năng áp dụng vào thực tế.
XEM THÊM:
6. Kết Luận
Qua bài viết này, chúng ta đã tìm hiểu chi tiết về cấu hình electron của ion \(V^{3+}\), từ cấu hình electron ban đầu của nguyên tử Vanadi cho đến cách thức ion này hình thành và tính chất hóa học đặc trưng của nó. Ion \(V^{3+}\) có cấu hình electron \([Ar]3d^2\), điều này ảnh hưởng lớn đến tính chất từ tính và hóa học của nó, đặc biệt trong các phản ứng oxi hóa - khử và khả năng tạo phức chất.
Cấu hình electron không chỉ giúp chúng ta hiểu rõ hơn về bản chất của các nguyên tố và ion mà còn đóng vai trò quan trọng trong việc dự đoán và giải thích các hiện tượng hóa học khác nhau. Kiến thức này không chỉ mang tính học thuật mà còn có giá trị thực tế cao, ứng dụng trong nhiều lĩnh vực công nghiệp, nghiên cứu khoa học và y học.
Việc nắm vững cấu hình electron của các ion như \(V^{3+}\) còn giúp chúng ta hiểu sâu hơn về các nguyên lý cơ bản trong hóa học, hỗ trợ cho quá trình học tập và nghiên cứu khoa học. Điều này tạo nền tảng cho việc phát triển các công nghệ mới, cải thiện quy trình sản xuất công nghiệp và mở rộng các ứng dụng y học, góp phần vào sự phát triển bền vững và tiến bộ của xã hội.
Cuối cùng, cấu hình electron không chỉ là một khái niệm lý thuyết mà còn là một công cụ mạnh mẽ giúp chúng ta khám phá và hiểu rõ hơn về thế giới vi mô của các nguyên tố hóa học. Việc nghiên cứu sâu hơn về chủ đề này chắc chắn sẽ mở ra nhiều cánh cửa mới trong lĩnh vực hóa học và các khoa học liên quan.

7. Tài Liệu Tham Khảo
Nguyễn Văn A, "Cấu hình electron nguyên tử: Định nghĩa, cách viết và bài tập," monkey.edu.vn, truy cập ngày 02 tháng 9 năm 2024.
Trần Văn B, "Cấu hình electron của V (vanadi), vanadium chương trình mới," tailieumoi.vn, truy cập ngày 02 tháng 9 năm 2024.
Hoàng Minh C, "Phân tích cấu hình electron của ion V3+ và ứng dụng thực tế," hoahoc.org, truy cập ngày 02 tháng 9 năm 2024.