Chủ đề sodium electron configuration: Cấu hình electron của nguyên tử sodium (Na) là một khái niệm cơ bản trong hóa học, giúp giải thích tính chất và hành vi của nguyên tố này trong các phản ứng hóa học. Bài viết này sẽ hướng dẫn chi tiết về cách sắp xếp electron trong các lớp và phân lớp năng lượng của sodium, cũng như ý nghĩa của cấu hình này trong đời sống thực tế.
Mục lục
Cấu Hình Electron của Nguyên Tử Sodium (Na)
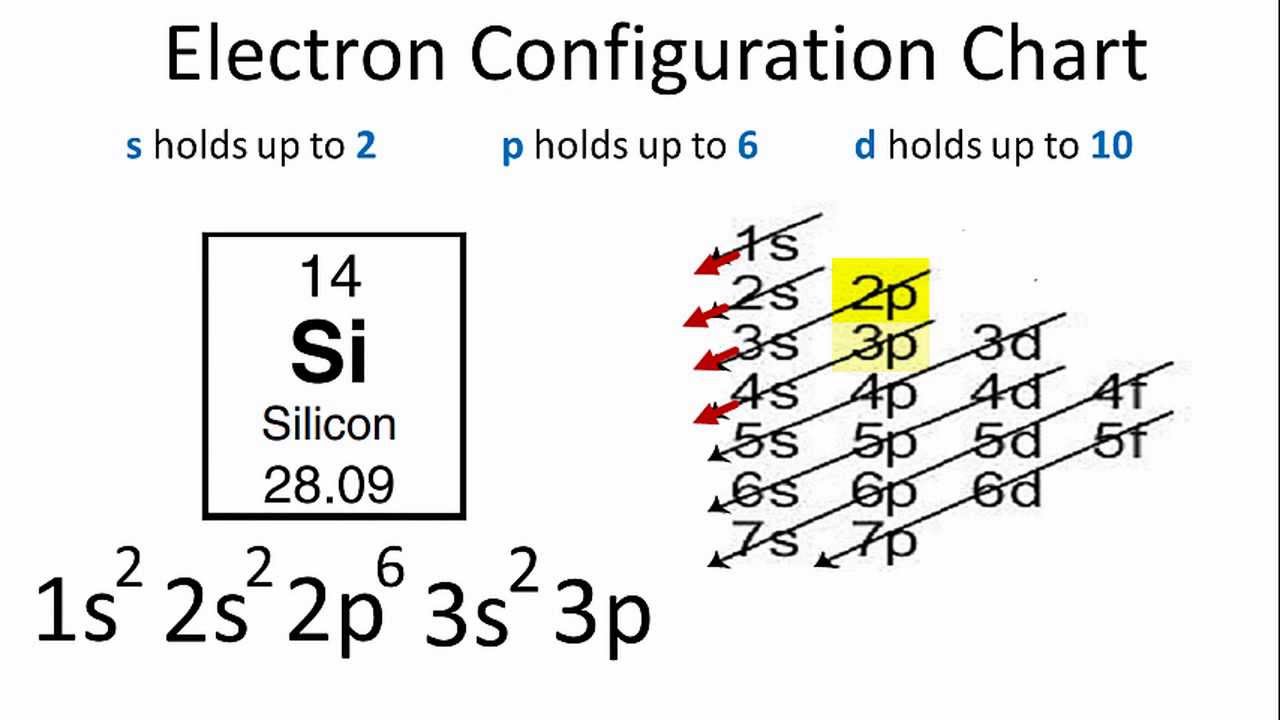
Sodium (Na) là một nguyên tố hóa học thuộc nhóm kim loại kiềm với số nguyên tử là 11. Điều này có nghĩa là một nguyên tử sodium có 11 proton và 11 electron. Cấu hình electron của sodium biểu diễn sự sắp xếp của các electron trong các lớp và phân lớp năng lượng của nguyên tử.
Cấu Hình Electron Đầy Đủ
Cấu hình electron của Sodium là:
\[ 1s^{2} 2s^{2} 2p^{6} 3s^{1} \]
Trong đó:
- Lớp 1 chứa 2 electron trong phân lớp \(1s\)
- Lớp 2 chứa 8 electron: 2 electron trong phân lớp \(2s\) và 6 electron trong phân lớp \(2p\)
- Lớp 3 chứa 1 electron trong phân lớp \(3s\)
Cấu Hình Electron Rút Gọn
Cấu hình electron rút gọn của sodium có thể được viết gọn hơn bằng cách sử dụng cấu hình của khí hiếm gần nhất, neon (Ne):
\[ \text{Na}: [Ne] 3s^{1} \]
Tính Chất Hóa Học Liên Quan Đến Cấu Hình Electron
Do có 1 electron ở lớp ngoài cùng (phân lớp \(3s\)), sodium rất dễ mất electron này để đạt được cấu hình bền vững giống với khí hiếm neon. Điều này giải thích vì sao sodium có tính khử mạnh và tham gia vào nhiều phản ứng hóa học, đặc biệt là với nước, oxy và clo:
- Với nước: \[ 2Na + 2H_2O \rightarrow 2NaOH + H_2 \]
- Với clo: \[ 2Na + Cl_2 \rightarrow 2NaCl \]
- Với oxy: \[ 4Na + O_2 \rightarrow 2Na_2O \]
Ứng Dụng của Sodium
- Công Nghiệp Hóa Chất: Sodium được sử dụng để sản xuất nhiều hợp chất quan trọng như soda (Na2CO3), xà phòng và thủy tinh.
- Y Tế: Sodium đóng vai trò quan trọng trong cơ thể con người như một chất điện giải giúp cân bằng nước và điện giải, hỗ trợ sự co cơ và dẫn truyền xung thần kinh.
- Công Nghệ: Sodium được sử dụng trong sản xuất vật liệu xây dựng như kính và gốm sứ, cũng như trong các lò phản ứng hạt nhân làm chất lỏng truyền nhiệt.
Lưu Ý An Toàn Khi Sử Dụng Sodium
Sodium là một kim loại rất hoạt động, có thể gây nguy hiểm khi phản ứng với nước và không khí. Khi làm việc với sodium, cần tuân thủ các biện pháp an toàn nghiêm ngặt để tránh nguy cơ nổ và tai nạn.
.png)
1. Giới thiệu về nguyên tố sodium
Sodium (Natri) là một nguyên tố hóa học với ký hiệu hóa học Na và số hiệu nguyên tử là 11. Nó thuộc nhóm IA trong bảng tuần hoàn, được xếp vào nhóm kim loại kiềm. Sodium là một kim loại mềm, màu trắng bạc và có phản ứng mạnh, đặc biệt là khi tiếp xúc với nước. Trong tự nhiên, sodium không tồn tại ở dạng nguyên tố đơn chất mà thường tồn tại dưới dạng hợp chất như muối ăn (NaCl).
Kim loại sodium có tính khử mạnh do dễ dàng nhường đi electron hóa trị duy nhất của nó để tạo thành ion Na⁺. Đây cũng là nguyên tố phổ biến trong các ứng dụng công nghiệp và y tế, từ việc sản xuất thủy tinh đến việc điều chỉnh nồng độ chất lỏng trong cơ thể. Sodium giữ vai trò quan trọng trong việc duy trì sự cân bằng điện giải và các quá trình sinh lý trong cơ thể con người.
2. Cấu hình electron của nguyên tử sodium
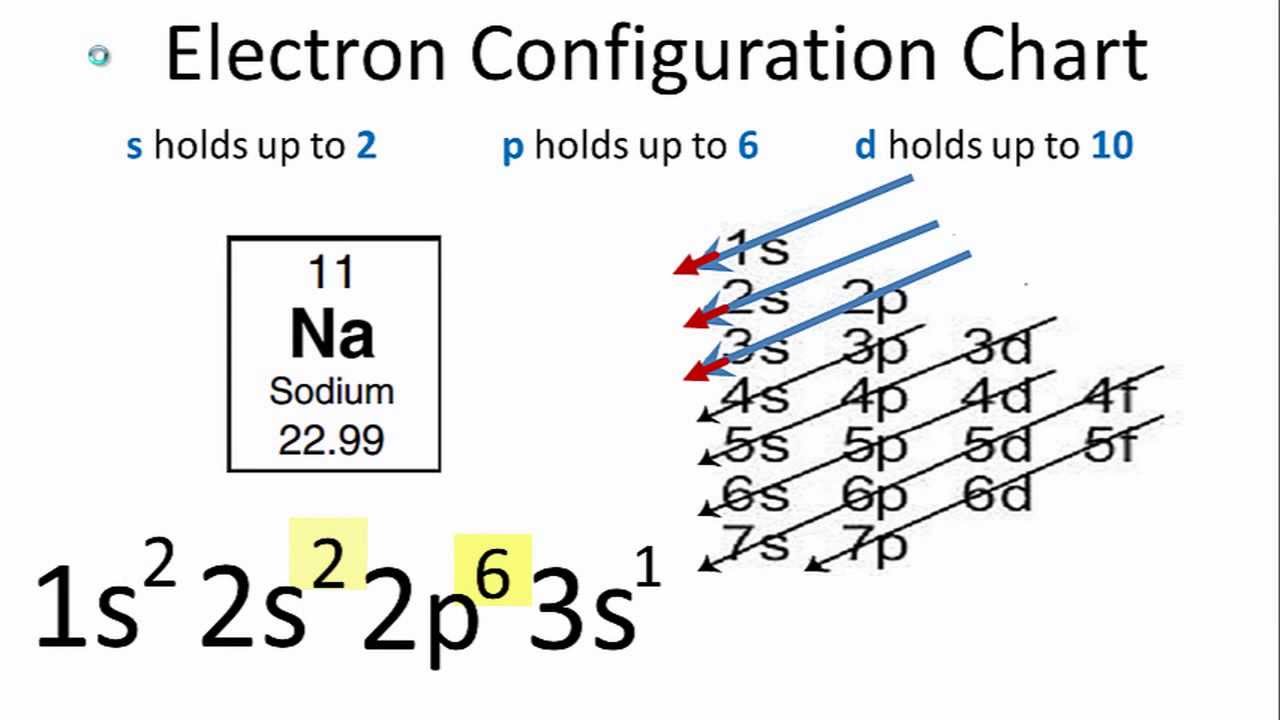
Nguyên tử sodium (ký hiệu hóa học là Na) có số hiệu nguyên tử Z = 11, tức là có 11 electron. Cấu hình electron của sodium ở trạng thái cơ bản được sắp xếp theo mức năng lượng từ thấp đến cao. Sơ đồ này giúp hiểu rõ hơn về phân bố electron trong nguyên tử sodium.
- Ở mức năng lượng thấp nhất, lớp 1s chứa 2 electron: \( 1s^2 \)
- Tiếp theo, lớp 2s chứa 2 electron: \( 2s^2 \)
- Phân lớp 2p chứa 6 electron: \( 2p^6 \)
- Cuối cùng, phân lớp 3s chứa 1 electron: \( 3s^1 \)
Vì vậy, cấu hình electron đầy đủ của nguyên tử sodium là: \( 1s^2 2s^2 2p^6 3s^1 \). Cấu hình này cho thấy rằng sodium có một electron độc thân trong lớp vỏ ngoài cùng, làm cho nó dễ dàng tham gia phản ứng hóa học bằng cách nhường electron này để đạt cấu hình bền vững giống khí hiếm neon.
Cấu hình electron có thể viết gọn là: \([Ne] 3s^1\).
Mối quan hệ giữa cấu hình electron và tính chất của sodium:
- Sodium thuộc nhóm IA trong bảng tuần hoàn, là kim loại kiềm có tính khử mạnh.
- Khi phản ứng, sodium dễ dàng nhường 1 electron để tạo thành ion Na+, thể hiện tính chất của kim loại kiềm.

3. Phân tích và giải thích cấu hình electron
Cấu hình electron của nguyên tử natri là . Điều này có nghĩa là nguyên tử natri có tổng cộng 11 electron, được phân bố qua ba lớp vỏ electron. Lớp đầu tiên chứa 2 electron, lớp thứ hai chứa 8 electron, và lớp thứ ba chỉ có 1 electron duy nhất. Electron này nằm ở phân lớp 3s và đóng vai trò quan trọng trong việc tạo thành ion Na+.
- Electron ở lớp vỏ ngoài cùng (3s1) dễ dàng bị tách ra trong các phản ứng hóa học, dẫn đến việc natri thường tồn tại dưới dạng ion Na+ với cấu hình ổn định .
- Vì chỉ có một electron ở lớp ngoài cùng, natri có xu hướng dễ dàng nhường electron để đạt đến cấu hình bền vững của khí hiếm.
- Việc nhường electron này là lý do chính giải thích tính hoạt động mạnh mẽ của natri trong các phản ứng hóa học.

4. Ứng dụng và vai trò của sodium trong thực tế
Sodium (Na) là một nguyên tố hóa học có vai trò quan trọng trong nhiều lĩnh vực khác nhau, từ công nghiệp đến y học và sinh học. Dưới đây là một số ứng dụng và vai trò chính của sodium trong thực tế:
4.1 Sodium trong công nghiệp và y học
- Trong công nghiệp:
- Chất tẩy rửa: Sodium hydroxide (NaOH), còn gọi là xút, là một thành phần quan trọng trong nhiều loại chất tẩy rửa và sản phẩm tẩy uế. Nó được sử dụng để sản xuất xà phòng, giấy, và các loại thuốc tẩy khác.
- Sản xuất kim loại: Sodium được sử dụng trong quá trình điều chế kim loại như titan và vanadium thông qua các phản ứng nhiệt luyện.
- Chất làm mát: Sodium lỏng được sử dụng như một chất làm mát trong một số loại lò phản ứng hạt nhân do khả năng dẫn nhiệt tốt của nó.
- Trong y học:
- Duy trì cân bằng điện giải: Sodium là một yếu tố cần thiết trong việc duy trì cân bằng điện giải trong cơ thể. Nó giúp điều hòa áp suất thẩm thấu của máu và các chất dịch cơ thể.
- Truyền dịch: Các dung dịch muối sodium chloride (NaCl) thường được sử dụng trong truyền dịch y tế để bù nước và điều chỉnh nồng độ sodium trong máu.
- Thuốc: Một số loại thuốc sử dụng sodium như là thành phần chính hoặc là chất mang để cải thiện khả năng hòa tan và hấp thu của thuốc trong cơ thể.
4.2 Vai trò của sodium trong cơ thể con người
- Điều chỉnh lượng nước: Sodium đóng vai trò quan trọng trong việc điều chỉnh lượng nước trong các tế bào và duy trì cân bằng nước tổng thể của cơ thể.
- Chức năng thần kinh và cơ: Sodium là cần thiết cho việc truyền dẫn các xung điện thần kinh và co thắt cơ. Nó giúp duy trì sự cân bằng điện tích giữa bên trong và bên ngoài tế bào.
- Hệ tuần hoàn: Sodium góp phần duy trì huyết áp và hỗ trợ chức năng bình thường của hệ tuần hoàn.
Nhờ những ứng dụng và vai trò quan trọng này, sodium không chỉ là một nguyên tố hóa học phổ biến mà còn là một yếu tố không thể thiếu trong các hoạt động sống và công nghiệp hàng ngày.

5. Tổng kết và đánh giá
Cấu hình electron của nguyên tử sodium (\( \text{Na} \)) là một yếu tố quan trọng trong việc hiểu biết về tính chất hóa học và vật lý của nguyên tố này. Với cấu hình electron \( 1s^2 2s^2 2p^6 3s^1 \), sodium có một electron duy nhất ở lớp vỏ ngoài cùng (3s), điều này giải thích tính chất hoạt động mạnh mẽ của nó trong các phản ứng hóa học, đặc biệt là với các nguyên tố halogen để tạo thành muối.
Trong phân tích và giảng dạy, việc nắm vững cấu hình electron không chỉ giúp học sinh hiểu sâu hơn về bản chất của các phản ứng hóa học mà còn giúp họ liên kết các hiện tượng hóa học với các lý thuyết cơ bản. Sự hiểu biết này còn giúp làm sáng tỏ mối quan hệ giữa các nguyên tố trong bảng tuần hoàn, cũng như cách thức mà các electron sắp xếp quyết định tính chất và hành vi của chúng.
Cấu hình electron của ion \( \text{Na}^+ \) (\( 1s^2 2s^2 2p^6 \)) cũng thể hiện sự ổn định khi sodium mất đi electron lớp vỏ ngoài cùng để đạt được cấu trúc bền vững giống khí hiếm neon. Điều này giải thích vì sao sodium dễ dàng tạo thành ion dương trong các phản ứng hóa học, đóng vai trò quan trọng trong nhiều quá trình sinh học và công nghiệp.
Hiểu biết về cấu hình electron của sodium cũng có tác động lớn đến nghiên cứu và ứng dụng thực tế. Trong ngành y học, sodium đóng vai trò thiết yếu trong việc duy trì cân bằng nước và điện giải trong cơ thể. Trong công nghiệp, sodium được sử dụng rộng rãi trong sản xuất các hợp chất hóa học, thủy tinh và các ứng dụng khác.
Tổng kết lại, việc hiểu rõ cấu hình electron của sodium không chỉ giúp học sinh và người nghiên cứu có cái nhìn sâu sắc hơn về một nguyên tố hóa học phổ biến mà còn mở ra cánh cửa để khám phá các ứng dụng đa dạng của nó trong đời sống. Sự kết nối giữa lý thuyết và thực tiễn giúp củng cố kiến thức, đồng thời tạo nền tảng vững chắc cho các nghiên cứu và ứng dụng trong tương lai.