Chủ đề silicon electron configuration: Cấu hình electron của Silicon không chỉ là một khái niệm cơ bản trong hóa học, mà còn mang lại sự hiểu biết sâu sắc về một nguyên tố thiết yếu trong ngành công nghiệp hiện đại. Bài viết này sẽ giúp bạn khám phá chi tiết về cấu hình electron của Silicon và tầm quan trọng của nó trong các ứng dụng công nghệ.
Mục lục
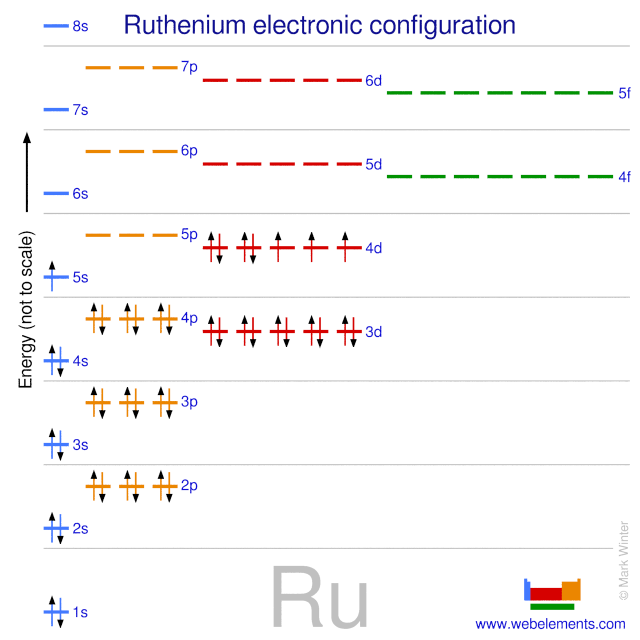
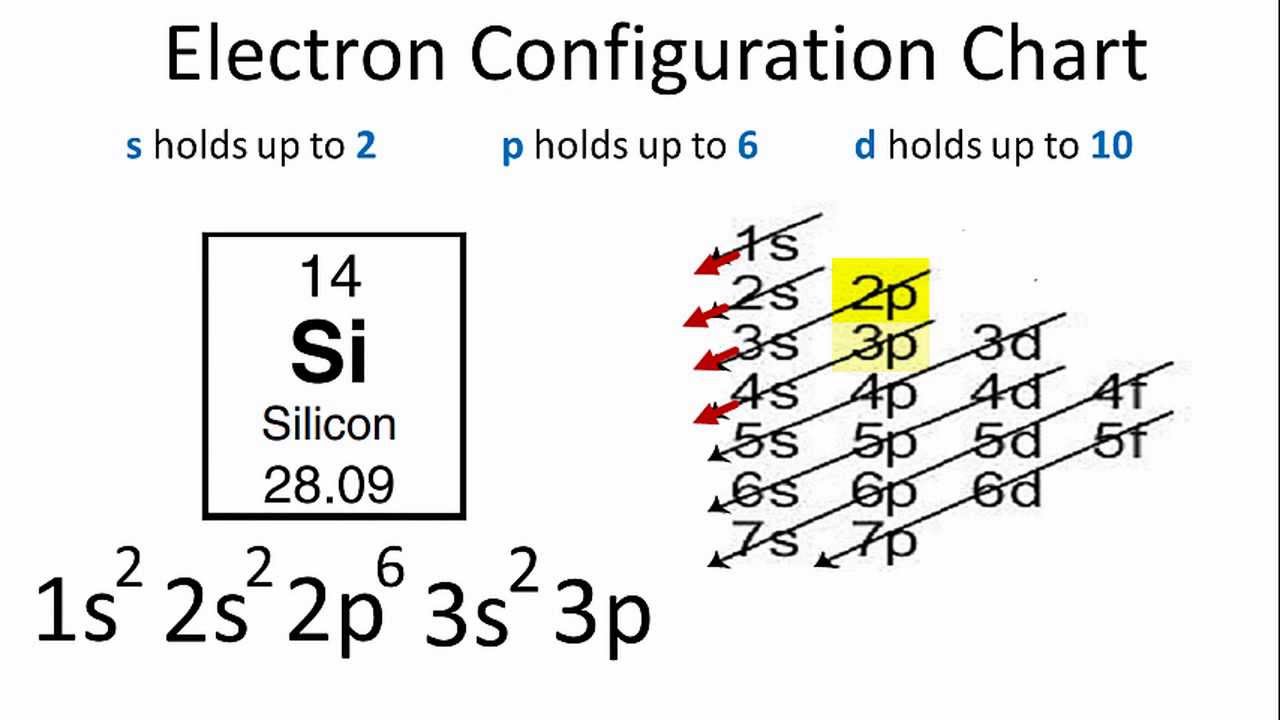
Cấu hình electron của nguyên tố Silicon
Silicon (ký hiệu hóa học là Si) là nguyên tố thứ 14 trong bảng tuần hoàn các nguyên tố hóa học, thuộc nhóm IVA. Đây là nguyên tố rất phổ biến trong vỏ Trái Đất và có vai trò quan trọng trong ngành công nghiệp điện tử và công nghệ bán dẫn.
Cấu hình electron của Silicon
Cấu hình electron của Silicon được biểu diễn như sau:
\[
\text{Si}: 1s^2 2s^2 2p^6 3s^2 3p^2
\]
Điều này có nghĩa là:
- Lớp thứ nhất: 2 electron trong phân lớp \(1s\)
- Lớp thứ hai: 2 electron trong phân lớp \(2s\), 6 electron trong phân lớp \(2p\)
- Lớp thứ ba: 2 electron trong phân lớp \(3s\), 2 electron trong phân lớp \(3p\)
Tầm quan trọng của Silicon trong công nghiệp
Silicon là nguyên tố quan trọng trong ngành công nghiệp bán dẫn, được sử dụng trong sản xuất vi mạch và các thiết bị điện tử. Nhờ đặc tính dẫn điện của mình, Silicon là vật liệu chủ yếu trong các thiết bị như máy tính, điện thoại di động và nhiều thiết bị công nghệ cao khác.
Silicon trong tự nhiên
Trong tự nhiên, Silicon không tồn tại ở dạng tự do mà chủ yếu được tìm thấy dưới dạng hợp chất như Silica (\(SiO_2\)) và Silicat. Silicon chiếm khoảng 27,7% khối lượng vỏ Trái Đất, khiến nó trở thành nguyên tố phổ biến thứ hai sau Oxygen.
Vai trò của Silicon trong cuộc sống hàng ngày
Silicon không chỉ quan trọng trong ngành công nghiệp mà còn có vai trò trong nhiều lĩnh vực khác như xây dựng (xi măng, kính), mỹ phẩm (silicon gel), y tế (dụng cụ cấy ghép, bộ phận giả), và nhiều ứng dụng khác.
Cấu hình electron của Silicon là kiến thức cơ bản trong hóa học và rất hữu ích trong việc hiểu rõ hơn về các tính chất và ứng dụng của nguyên tố này trong công nghiệp và cuộc sống hàng ngày.
.png)
Giới thiệu về Silicon và tầm quan trọng của nó
Silicon, với ký hiệu hóa học là Si và số nguyên tử 14, là một nguyên tố phi kim loại thuộc nhóm IV trong bảng tuần hoàn. Nó là nguyên tố phổ biến thứ hai trong vỏ Trái Đất, chỉ sau Oxygen, và chiếm khoảng 27,7% khối lượng vỏ Trái Đất.
Silicon được biết đến với vai trò quan trọng trong nhiều lĩnh vực công nghiệp, đặc biệt là trong ngành công nghệ cao và điện tử. Nhờ cấu hình electron \([Ne]3s^2 3p^2\), Silicon có khả năng dẫn điện trong các điều kiện nhất định, khiến nó trở thành vật liệu lý tưởng cho sản xuất vi mạch và các thiết bị bán dẫn.
- Trong công nghiệp điện tử: Silicon là thành phần chính của vi mạch và chip máy tính, đóng vai trò cốt lõi trong sự phát triển của công nghệ thông tin.
- Trong xây dựng: Silicon được sử dụng trong sản xuất vật liệu xây dựng như xi măng, kính, và gốm sứ.
- Trong y tế: Silicon được ứng dụng trong sản xuất các thiết bị y tế, từ dụng cụ phẫu thuật đến các bộ phận cấy ghép.
- Trong công nghệ năng lượng: Silicon cũng đóng vai trò quan trọng trong sản xuất các tấm pin mặt trời, góp phần vào sự phát triển của năng lượng tái tạo.
Nhờ vào những ứng dụng rộng rãi và quan trọng của mình, Silicon không chỉ là một nguyên tố cơ bản trong hóa học mà còn là một phần không thể thiếu trong cuộc sống hiện đại, ảnh hưởng sâu sắc đến nhiều lĩnh vực công nghiệp và công nghệ.
Silicon trong bảng tuần hoàn
Silicon (Si) là một nguyên tố quan trọng trong bảng tuần hoàn, nằm ở ô thứ 14 và thuộc nhóm IVA, hay còn gọi là nhóm Carbon. Vị trí của Silicon trong bảng tuần hoàn không chỉ thể hiện tính chất hóa học đặc trưng của nó mà còn cho thấy mối liên hệ với các nguyên tố khác trong cùng nhóm và chu kỳ.
- Nhóm IVA (nhóm 14): Silicon thuộc nhóm IVA, cùng với các nguyên tố khác như Carbon (C), Germanium (Ge), Tin (Sn), và Chì (Pb). Các nguyên tố trong nhóm này đều có 4 electron ở lớp ngoài cùng, điều này cho phép chúng tạo thành tối đa 4 liên kết cộng hóa trị với các nguyên tố khác.
- Chu kỳ 3: Silicon nằm ở chu kỳ 3 của bảng tuần hoàn, nghĩa là nó có ba lớp electron. Chu kỳ này cũng bao gồm các nguyên tố như Natri (Na), Magie (Mg), và Photpho (P). So với các nguyên tố trong chu kỳ này, Silicon có bán kính nguyên tử lớn hơn các nguyên tố ở đầu chu kỳ và nhỏ hơn các nguyên tố ở cuối chu kỳ.
- Tính chất hóa học: Do có cấu hình electron \([Ne]3s^2 3p^2\), Silicon có xu hướng tham gia vào các phản ứng hóa học để đạt cấu hình bền vững bằng cách chia sẻ hoặc nhận electron. Điều này giải thích tại sao Silicon chủ yếu tham gia vào các phản ứng cộng hóa trị.
- Liên kết với các nguyên tố khác: Trong tự nhiên, Silicon thường tạo thành hợp chất với Oxygen để tạo ra các khoáng chất Silicate và Silica, những hợp chất này chiếm phần lớn trong vỏ Trái Đất. Silicon cũng có khả năng tạo liên kết với Carbon để hình thành các hợp chất hữu cơ Silicon, được sử dụng rộng rãi trong các ứng dụng công nghiệp.
Vị trí của Silicon trong bảng tuần hoàn không chỉ giúp xác định tính chất hóa học của nó mà còn cung cấp cơ sở để hiểu rõ hơn về cách Silicon tương tác với các nguyên tố khác, tạo ra nhiều hợp chất và vật liệu quan trọng trong công nghiệp và công nghệ.

Ứng dụng của Silicon trong công nghiệp và đời sống
Silicon là một trong những nguyên tố có vai trò quan trọng nhất trong cả công nghiệp và đời sống. Nhờ vào tính chất bán dẫn và khả năng tạo liên kết mạnh với nhiều nguyên tố khác, Silicon đã trở thành nền tảng cho nhiều ngành công nghiệp hiện đại.
- Ngành công nghiệp bán dẫn: Silicon là vật liệu chủ yếu trong sản xuất vi mạch và chip máy tính, đóng vai trò cốt lõi trong ngành công nghiệp điện tử. Các tính chất bán dẫn của Silicon cho phép nó kiểm soát dòng điện, tạo nên các thiết bị vi mạch sử dụng trong hầu hết các thiết bị điện tử hiện đại như máy tính, điện thoại di động, và các thiết bị thông minh.
- Năng lượng mặt trời: Silicon được sử dụng rộng rãi trong sản xuất tấm pin năng lượng mặt trời. Các tấm pin này chuyển đổi năng lượng từ ánh sáng mặt trời thành điện năng, đóng góp to lớn vào ngành công nghiệp năng lượng tái tạo. Tính dẫn điện và hiệu suất quang điện cao của Silicon giúp tối ưu hóa quá trình chuyển đổi năng lượng.
- Công nghiệp xây dựng: Silicon được sử dụng để sản xuất nhiều vật liệu xây dựng như kính, xi măng, và gốm sứ. Trong sản xuất kính, Silicon dioxide (\(SiO_2\)) là thành phần chính, tạo ra các loại kính chịu nhiệt và có độ bền cao. Xi măng và gốm sứ có chứa Silicon cũng có đặc tính bền vững và được sử dụng rộng rãi trong xây dựng và trang trí nội thất.
- Công nghiệp y tế: Silicon được ứng dụng trong sản xuất các thiết bị y tế như ống thông, dụng cụ phẫu thuật, và các bộ phận cấy ghép. Silicone, một dạng polymer của Silicon, được sử dụng trong nhiều sản phẩm y tế vì tính trơ về mặt sinh học và độ bền cao.
- Sản xuất chất bán dẫn hữu cơ: Silicon cũng tham gia vào sản xuất các hợp chất hữu cơ Silicon, được sử dụng trong ngành công nghiệp hóa chất và dược phẩm. Các hợp chất này thường được dùng làm chất cách điện, chất bôi trơn, và trong nhiều ứng dụng khác liên quan đến hóa chất đặc biệt.
Với hàng loạt ứng dụng trong công nghiệp và đời sống, Silicon không chỉ là một nguyên tố hóa học mà còn là yếu tố không thể thiếu trong sự phát triển của công nghệ hiện đại và cuộc sống hàng ngày.
XEM THÊM:
Tính chất vật lý và hóa học của Silicon
Silicon là một nguyên tố quan trọng, có nhiều tính chất vật lý và hóa học đặc trưng, làm nền tảng cho các ứng dụng rộng rãi trong công nghiệp và công nghệ. Dưới đây là những tính chất cơ bản của Silicon:
Tính chất vật lý
- Màu sắc và hình dạng: Silicon ở dạng nguyên chất là một chất rắn màu xám, có ánh kim loại. Nó có cấu trúc tinh thể lập phương, tương tự như cấu trúc của kim cương.
- Trạng thái: Ở điều kiện thường, Silicon tồn tại ở trạng thái rắn.
- Khối lượng riêng: Khối lượng riêng của Silicon là khoảng 2.33 g/cm³, điều này làm cho nó nhẹ hơn nhiều so với kim loại như sắt hoặc đồng.
- Nhiệt độ nóng chảy và sôi: Silicon có nhiệt độ nóng chảy khoảng 1414°C và nhiệt độ sôi khoảng 3265°C, điều này khiến nó chịu được nhiệt độ cao trong các ứng dụng công nghiệp.
- Tính dẫn điện và dẫn nhiệt: Silicon có tính chất bán dẫn, nghĩa là nó có khả năng dẫn điện tốt hơn chất cách điện nhưng kém hơn so với kim loại. Khả năng dẫn nhiệt của Silicon cũng ở mức trung bình.
Tính chất hóa học
- Cấu hình electron: Silicon có cấu hình electron là \([Ne]3s^2 3p^2\), với 4 electron lớp ngoài cùng, tạo điều kiện cho nó tham gia vào nhiều phản ứng hóa học khác nhau.
- Phản ứng với Oxygen: Silicon dễ dàng phản ứng với Oxygen ở nhiệt độ cao để tạo thành Silicon dioxide (\(SiO_2\)), một hợp chất rất ổn định và phổ biến trong tự nhiên dưới dạng cát, thạch anh.
- Phản ứng với Halogen: Silicon phản ứng với các halogen (F, Cl, Br, I) tạo ra các hợp chất halide, như Silicon tetrafluoride (\(SiF_4\)), một chất khí không màu và có mùi khó chịu.
- Phản ứng với các kim loại: Silicon có thể tạo ra hợp kim với nhiều kim loại khác nhau, chẳng hạn như hợp kim với nhôm, làm tăng độ bền và độ nhẹ cho các sản phẩm công nghiệp.
- Tính trơ hóa học: Silicon khá trơ ở nhiệt độ phòng, không phản ứng mạnh với nhiều chất khác, điều này làm cho nó rất bền vững trong nhiều điều kiện môi trường khác nhau.
Những tính chất vật lý và hóa học đặc trưng này của Silicon giúp nó trở thành một nguyên tố có giá trị, được ứng dụng rộng rãi trong nhiều ngành công nghiệp và công nghệ khác nhau.

Silicon trong tự nhiên và khai thác
Silicon (Si) là nguyên tố phổ biến thứ hai trong vỏ Trái Đất, chiếm khoảng 27,7% trọng lượng vỏ Trái Đất. Silicon không tồn tại ở dạng tự do mà thường xuất hiện dưới dạng hợp chất trong các khoáng vật như cát, thạch anh (SiO2), và các silicat.
Silicon tồn tại ở đâu trong tự nhiên?
Silicon có mặt trong nhiều loại đá, khoáng vật và đất sét. Đặc biệt, thạch anh là một dạng tinh thể của silicon dioxide, đóng vai trò quan trọng trong các quá trình địa chất và công nghiệp.
- Thạch anh: Đây là nguồn chính cung cấp silicon trong tự nhiên, với độ tinh khiết cao, được sử dụng rộng rãi trong công nghiệp.
- Cát: Là một nguồn dồi dào silicon, chủ yếu dưới dạng SiO2, là nguyên liệu cơ bản trong sản xuất thủy tinh và vi mạch điện tử.
- Silicat: Silicon cũng tồn tại trong các khoáng vật silicat như mica và fenspat, được sử dụng trong nhiều ngành công nghiệp khác nhau.
Phương pháp khai thác và chế biến Silicon
Quá trình khai thác silicon chủ yếu bắt đầu bằng việc khai thác cát hoặc thạch anh. Các bước chính bao gồm:
- Khai thác: Silicon được khai thác từ cát hoặc thạch anh bằng phương pháp truyền thống, như nổ mìn hoặc cắt bằng máy móc chuyên dụng.
- Tinh chế: Silicon thô sau khi khai thác sẽ được tinh chế qua quá trình nung chảy với cacbon trong lò điện để tạo ra silicon cấp công nghiệp với độ tinh khiết lên đến 99%.
- Chế biến: Silicon được xử lý tiếp theo để tạo ra các sản phẩm như silicon tinh khiết dùng trong công nghiệp bán dẫn, hoặc hợp chất silicon khác như silicones cho các ứng dụng trong xây dựng và y tế.
Ảnh hưởng môi trường từ việc khai thác Silicon
Mặc dù silicon là một nguyên tố thiết yếu trong nhiều ngành công nghiệp, việc khai thác và chế biến nó cũng có thể gây ra các tác động tiêu cực đến môi trường:
- Suy giảm tài nguyên: Khai thác quá mức các nguồn tài nguyên như thạch anh và cát có thể dẫn đến suy giảm tài nguyên thiên nhiên.
- Ô nhiễm: Quá trình tinh chế silicon sử dụng năng lượng lớn và có thể thải ra các khí độc hại như CO2, gây ô nhiễm không khí.
- Suy thoái đất: Việc khai thác khoáng sản thường làm suy thoái đất và gây ra xói mòn.
Tuy nhiên, với sự phát triển của các công nghệ xanh và quy trình sản xuất bền vững, những tác động này đang được giảm thiểu đáng kể để bảo vệ môi trường.
Kết luận và các xu hướng nghiên cứu liên quan đến Silicon