Chủ đề rubidium electron configuration: Khám phá cấu hình electron của Rubidi, một nguyên tố quan trọng trong bảng tuần hoàn. Bài viết này sẽ giúp bạn hiểu rõ hơn về cách phân bố các electron trong các lớp vỏ của nguyên tử Rubidi và những tính chất hóa học đặc trưng của nó. Hãy cùng tìm hiểu về Rubidi và ứng dụng của nó trong đời sống hàng ngày.
Mục lục
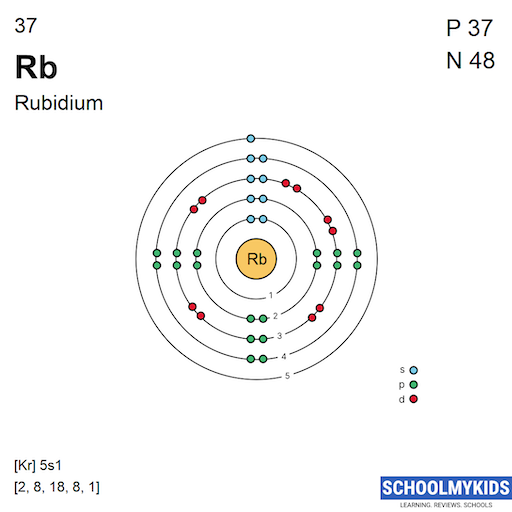
Cấu hình Electron của Rubidi
Rubidi (Rb) là một kim loại kiềm mềm, có ký hiệu hóa học là Rb và số nguyên tử là 37. Đây là một nguyên tố nằm ở nhóm 1 và chu kỳ 5 trong bảng tuần hoàn. Cấu hình electron của rubidi có thể được viết dưới dạng đầy đủ và dạng rút gọn (dạng khí hiếm).
Cấu hình electron đầy đủ
Cấu hình electron đầy đủ của rubidi là:
\[
1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^2 4p^6 5s^1
\]
Cấu hình electron rút gọn
Cấu hình electron rút gọn của rubidi, sử dụng cấu hình của khí hiếm kripton (Kr), là:
\[
[Kr] 5s^1
\]
Sơ đồ phân bố electron
Sơ đồ phân bố các electron trong các lớp vỏ của nguyên tử rubidi là:
\[
2.8.18.8.1
\]
Tính chất hóa học và vật lý
- Trạng thái tiêu chuẩn: Rắn ở 298 K
- Ngoại hình: Màu trắng bạc
- Khối lượng nguyên tử tương đối: 85.4678 g/mol
- Mật độ: 1532 kg/m³
- Nhiệt độ nóng chảy: 39.31°C (312.46 K)
- Nhiệt độ sôi: 688°C (961 K)
- Cấu trúc tinh thể: Lập phương tâm khối
Ứng dụng của Rubidi
Rubidi có nhiều ứng dụng trong các lĩnh vực khác nhau như:
- Thủy tinh đặc biệt: Rubidi được sử dụng để tạo ra thủy tinh đặc biệt cho các thiết bị quang học.
- Phát hiện bức xạ: Rubidi được sử dụng trong các thiết bị phát hiện bức xạ.
- Pháo hoa: Rubidi được sử dụng để tạo màu tím trong pháo hoa.
Chú ý và biện pháp an toàn
Rubidi là một kim loại rất hoạt động, phản ứng mạnh với nước và không khí. Do đó, cần phải cẩn trọng khi xử lý rubidi và lưu trữ trong điều kiện khô ráo và không tiếp xúc với không khí.

.png)
Tổng quan về Rubidi
Rubidi (Rb) là một nguyên tố hóa học thuộc nhóm kim loại kiềm, có ký hiệu là Rb và số nguyên tử là 37. Được phát hiện vào năm 1861 bởi nhà hóa học người Đức Robert Bunsen và Gustav Kirchoff, Rubidi nổi tiếng với đặc tính phản ứng mạnh mẽ với nước và không khí.
Rubidi có cấu hình electron \([Kr] 5s^1\), nghĩa là nó có một electron duy nhất trong lớp vỏ ngoài cùng (lớp vỏ s). Điều này làm cho Rubidi cực kỳ phản ứng, tương tự như các kim loại kiềm khác như lithium và sodium.
Trong tự nhiên, Rubidi không tồn tại ở dạng nguyên chất mà thường được tìm thấy trong các khoáng chất như lepidolite. Phần lớn Rubidi được sản xuất từ quá trình tách lithium từ lepidolite.
Rubidi có một số ứng dụng trong công nghiệp và nghiên cứu khoa học. Ví dụ, nó được sử dụng trong đồng hồ nguyên tử để đo thời gian chính xác và trong nghiên cứu các tính chất vật lý của các nguyên tử và phân tử.
Với nhiệt độ nóng chảy thấp và khả năng phản ứng mạnh, Rubidi cần được bảo quản trong điều kiện khí trơ để tránh phản ứng với không khí. Ngoài ra, Rubidi có hai đồng vị tự nhiên: Rubidi-85 và Rubidi-87, trong đó Rubidi-87 là đồng vị phóng xạ với chu kỳ bán rã khoảng 50 tỷ năm, hữu ích trong việc xác định tuổi của đá.
- Rubidi là một trong những nguyên tố phổ biến, chiếm khoảng 90 phần triệu trong vỏ Trái Đất.
- Rubidi có tên gọi từ tiếng Latin "rubidus", nghĩa là màu đỏ sậm, liên quan đến màu sắc của ngọn lửa khi đốt cháy Rubidi.
- Rubidi được sử dụng trong nghiên cứu khoa học và công nghiệp, đặc biệt trong các thiết bị đo thời gian chính xác như đồng hồ nguyên tử.
Cấu hình electron của Rubidi
Rubidi (Rb) là nguyên tố hóa học có số hiệu nguyên tử là 37 và ký hiệu là Rb. Đây là một kim loại kiềm mềm, có màu trắng bạc và rất dễ phản ứng, đặc biệt là với nước, tạo ra hydro và gây cháy nổ.
Cấu hình electron
Cấu hình electron của Rubidi được viết là \([Kr] 5s^1\). Để hiểu rõ hơn, ta cần xem xét các bước phân bố electron trong các lớp vỏ của Rubidi:
- Bước đầu tiên, ta xét nguyên tố Krypton (Kr) với số hiệu nguyên tử là 36. Cấu hình electron của Kr là \([Ar] 3d^{10} 4s^2 4p^6\).
- Sau đó, thêm 1 electron vào lớp tiếp theo của Rubidi, electron này sẽ nằm ở phân lớp 5s. Do đó, cấu hình electron cuối cùng của Rubidi là \([Kr] 5s^1\).
Phân tích chi tiết
Rubidi có tổng cộng 37 electron, được phân bố vào các lớp vỏ theo thứ tự:
- Lớp 1: 2 electron
- Lớp 2: 8 electron
- Lớp 3: 18 electron
- Lớp 4: 8 electron
- Lớp 5: 1 electron
Đặc điểm nổi bật
Rubidi là một trong những nguyên tố có tính kiềm mạnh nhất, phản ứng mạnh mẽ với nước và không khí. Do đó, việc xử lý và bảo quản Rubidi cần được thực hiện cẩn thận để tránh nguy cơ cháy nổ.

Tính chất hóa học và vật lý của Rubidi
Rubidi là một kim loại kiềm, nằm ở nhóm 1 trong bảng tuần hoàn hóa học, với ký hiệu hóa học là Rb và số nguyên tử là 37. Nó là một kim loại mềm, có màu trắng bạc, dễ bị oxy hóa trong không khí và rất nhạy với nước. Dưới đây là một số tính chất hóa học và vật lý quan trọng của Rubidi:
- Màu sắc: Trắng bạc
- Trạng thái: Rắn ở nhiệt độ phòng
- Điểm nóng chảy: 39°C
- Điểm sôi: 688°C
- Khối lượng riêng: 1.532 g/cm³
Tính chất vật lý
Rubidi có nhiệt độ nóng chảy và sôi khá thấp so với các kim loại khác. Nó có thể bị cắt dễ dàng bằng dao và trở nên dẻo ở nhiệt độ phòng. Khi bị nung nóng, rubidi cháy với ngọn lửa màu đỏ đậm, do electron duy nhất ở lớp ngoài cùng nhảy lên mức năng lượng cao hơn.
Tính chất hóa học
Rubidi là một trong những kim loại kiềm có tính phản ứng mạnh nhất. Khi tiếp xúc với không khí, nó nhanh chóng bị oxy hóa và tạo ra rubidi oxide (Rb2O). Khi tiếp xúc với nước, nó phản ứng mãnh liệt, giải phóng khí hydro và nhiệt lượng, có thể gây nổ.
Phản ứng với nước:
\[ 2Rb + 2H_2O \rightarrow 2RbOH + H_2\uparrow \]
Rubidi còn phản ứng với các halogen (như clo, brom) để tạo thành các muối rubidi halide (RbCl, RbBr). Các hợp chất của rubidi thường có trạng thái oxy hóa +1.
Ứng dụng
Mặc dù rubidi không có nhiều ứng dụng thương mại lớn, nhưng nó được sử dụng trong một số lĩnh vực khoa học và công nghệ. Ví dụ, rubidi được dùng trong các đồng hồ nguyên tử để đo thời gian chính xác và trong các nghiên cứu về ngưng tụ Bose-Einstein.
Phương pháp thu được và lưu trữ Rubidi
Rubidi là kim loại kiềm hiếm, được tìm thấy chủ yếu trong các khoáng vật như carnallit, lepidolite, và pollucite. Việc thu hồi và lưu trữ rubidi đòi hỏi các phương pháp đặc biệt để đảm bảo độ tinh khiết và an toàn của kim loại.
1. Phương pháp thu được Rubidi
- Chiết xuất từ khoáng sản: Rubidi thường được thu hồi từ các khoáng sản như lepidolite thông qua các quy trình khai thác và xử lý hóa học phức tạp.
- Phương pháp kết tủa hóa học: Sử dụng các chất như acid perchloric để kết tủa các tạp chất như kali, giúp làm tăng độ tinh khiết của rubidi.
- Chiết xuất dung môi: Sử dụng các dung môi như t-BAMBP để tách rubidi khỏi các kim loại khác như lithium, natri, và canxi.
2. Lưu trữ Rubidi
- Điều kiện lưu trữ: Rubidi phải được lưu trữ trong môi trường khô ráo, không có sự hiện diện của không khí và độ ẩm để tránh phản ứng với nước và oxy.
- Thùng chứa: Rubidi thường được lưu trữ trong các thùng chứa bằng thép không gỉ hoặc thủy tinh, có lớp bảo vệ chống lại các tác nhân hóa học bên ngoài.
- Biện pháp an toàn: Do tính chất phản ứng mạnh, cần có các biện pháp an toàn nghiêm ngặt khi xử lý và lưu trữ rubidi, bao gồm việc sử dụng trang thiết bị bảo hộ cá nhân và hệ thống thông gió tốt.
3. Các bước cụ thể
- Khai thác khoáng sản chứa rubidi như lepidolite hoặc pollucite.
- Nghiền nhỏ khoáng sản và xử lý bằng acid để tách các kim loại khác.
- Sử dụng dung môi t-BAMBP để tách rubidi từ dung dịch.
- Kết tủa và lọc để loại bỏ các tạp chất còn lại.
- Lưu trữ rubidi trong các thùng chứa chuyên dụng.
Phương pháp thu hồi và lưu trữ rubidi yêu cầu kỹ thuật cao và các biện pháp an toàn đặc biệt để đảm bảo chất lượng và an toàn cho người sử dụng.

Phân tích Rubidi trong tự nhiên
Rubidi là một nguyên tố hóa học thuộc nhóm kim loại kiềm, với ký hiệu là Rb và số nguyên tử là 37. Rubidi không xuất hiện tự do trong tự nhiên mà tồn tại chủ yếu dưới dạng các hợp chất. Nguyên tố này được phát hiện lần đầu tiên vào năm 1861 bởi các nhà hóa học người Đức Robert Bunsen và Gustav Kirchhoff thông qua việc phân tích quang phổ. Rubidi chiếm một lượng nhỏ trong vỏ trái đất và tồn tại chủ yếu trong các khoáng chất như leucite, pollucite, và zinnwaldite.
Sự tồn tại của Rubidi trong tự nhiên
Rubidi xuất hiện trong tự nhiên ở dạng các hợp chất như silicat và carbonat. Trong các mỏ quặng, nó thường được tìm thấy cùng với các kim loại kiềm khác như kali và cesium. Rubidi không phải là một nguyên tố phổ biến, nhưng có thể tìm thấy nó ở nhiều nơi trên thế giới, đặc biệt trong các khoáng chất như lepidolite và pollucite.
Tỷ lệ và phân bố trong vỏ trái đất
Rubidi chiếm khoảng 90 phần triệu (ppm) trong vỏ trái đất, đứng thứ 16 trong số các kim loại kiềm về mức độ phong phú. Tỷ lệ này có vẻ nhỏ, nhưng đủ để khai thác trong các ứng dụng công nghiệp. Rubidi phân bố rộng rãi trong các loại đá granit, pegmatit, và các loại đá phun trào khác. Đáng chú ý, nó cũng xuất hiện trong các suối nước khoáng và trong một số muối biển, mặc dù với tỷ lệ rất nhỏ.
Ứng dụng của Rubidi dựa trên sự phân bố tự nhiên
- Các thiết bị thời gian chính xác: Rubidi được sử dụng trong các đồng hồ nguyên tử nhờ vào tính chất ổn định cao của nó.
- Y học: Một số đồng vị của rubidi được sử dụng trong hình ảnh y học, đặc biệt là trong chụp cắt lớp phát xạ positron (PET).
- Nghiên cứu khoa học: Rubidi cũng được sử dụng trong các nghiên cứu vật lý lượng tử và các thí nghiệm liên quan đến siêu dẫn.
Rubidi, mặc dù không phổ biến, nhưng với sự phân bố tự nhiên và các tính chất độc đáo của nó, đóng vai trò quan trọng trong nhiều lĩnh vực từ công nghiệp đến y học và nghiên cứu khoa học. Việc khai thác và sử dụng Rubidi đang ngày càng được chú trọng và phát triển.
XEM THÊM:
Rubidi và sức khỏe
Rubidi, với số nguyên tử 37 và ký hiệu Rb, là một nguyên tố hóa học thuộc nhóm kim loại kiềm. Dù không phải là một nguyên tố phổ biến, Rubidi có vai trò đáng kể trong một số ứng dụng liên quan đến sức khỏe con người.
Ảnh hưởng của Rubidi đến sức khỏe con người
Rubidi, trong dạng tự nhiên của nó, không độc hại và thường được tìm thấy trong các hợp chất như Rubidi chloride (RbCl). Tuy nhiên, do tính chất hóa học của mình, Rubidi có khả năng thay thế các ion kali trong cơ thể, điều này có thể ảnh hưởng đến cân bằng điện giải và các chức năng sinh lý khác. Việc tiếp xúc với Rubidi trong liều lượng cao, đặc biệt là trong các môi trường công nghiệp, có thể gây ra một số ảnh hưởng đến sức khỏe nhưng thường là không đáng kể.
Ứng dụng của Rubidi trong y học
Một trong những ứng dụng quan trọng của Rubidi trong y học là sử dụng đồng vị phóng xạ Rubidi-82 \((^{82}Rb)\) trong chụp cắt lớp phát xạ positron (PET scan). Đây là một kỹ thuật hình ảnh giúp theo dõi hoạt động của các cơ quan trong cơ thể, đặc biệt là tim, giúp các bác sĩ chẩn đoán và theo dõi các bệnh lý liên quan đến tim mạch.
Khi Rubidi-82 được tiêm vào cơ thể, nó phát ra các positron, được ghi nhận bởi máy PET scan để tạo ra hình ảnh chi tiết về hoạt động của tim. Nhờ vào đặc tính này, Rubidi-82 là một công cụ hữu ích trong việc chẩn đoán các bệnh tim mạch và theo dõi hiệu quả điều trị.
Biện pháp an toàn khi sử dụng Rubidi
Trong quá trình làm việc với Rubidi, đặc biệt là các hợp chất của nó hoặc các đồng vị phóng xạ, cần tuân thủ nghiêm ngặt các biện pháp an toàn. Các biện pháp này bao gồm:
- Đeo thiết bị bảo hộ cá nhân (PPE) như găng tay, kính bảo hộ và áo khoác bảo hộ để tránh tiếp xúc trực tiếp với Rubidi.
- Thực hiện các thao tác trong phòng thí nghiệm có thông gió tốt hoặc trong tủ hút để giảm thiểu nguy cơ hít phải bụi hoặc hơi Rubidi.
- Tuân thủ các quy định về xử lý và lưu trữ chất thải có chứa Rubidi để ngăn ngừa ô nhiễm môi trường.
Tóm lại, Rubidi có vai trò quan trọng trong y học, đặc biệt là trong chẩn đoán và theo dõi bệnh tim mạch. Với việc tuân thủ các biện pháp an toàn phù hợp, Rubidi có thể được sử dụng một cách hiệu quả và an toàn trong các ứng dụng y học và nghiên cứu khoa học.