Chủ đề radon electron configuration: Radon là một nguyên tố hiếm và đặc biệt với cấu hình electron độc đáo. Trong bài viết này, chúng ta sẽ khám phá chi tiết về cấu hình electron của Radon, vị trí của nó trong bảng tuần hoàn, và những ứng dụng quan trọng trong cuộc sống. Hãy cùng tìm hiểu và mở rộng kiến thức về nguyên tố thú vị này.
Mục lục
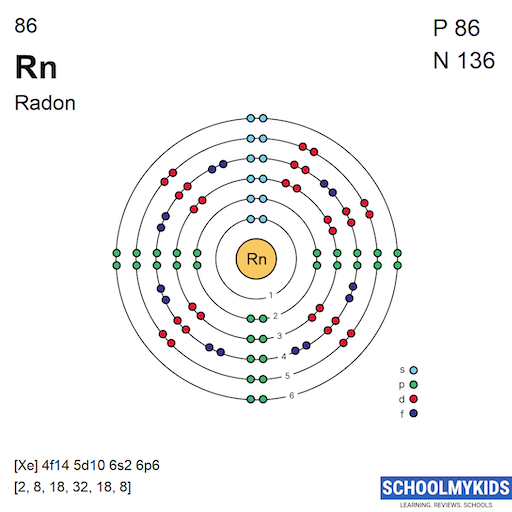
Cấu hình electron của Radon
Radon (ký hiệu hóa học: Rn) là nguyên tố hóa học thuộc nhóm khí hiếm trong bảng tuần hoàn, có số nguyên tử là 86. Đây là một nguyên tố phóng xạ và là một trong những khí hiếm nặng nhất. Cấu hình electron của Radon có thể được viết như sau:
\[
\text{Rn}: [\text{Xe}] 4f^{14} 5d^{10} 6s^{2} 6p^{6}
\]
Phân tích cấu hình electron
- [\text{Xe}]: Đây là cấu hình của khí hiếm Xenon (Z = 54), tương đương với các lớp vỏ electron đầu tiên của Radon.
- 4f^{14}: Lớp vỏ 4f chứa 14 electron, được điền đầy.
- 5d^{10}: Lớp vỏ 5d chứa 10 electron, được điền đầy.
- 6s^{2}: Lớp vỏ 6s chứa 2 electron, nằm ngoài cùng.
- 6p^{6}: Lớp vỏ 6p chứa 6 electron, nằm ngoài cùng và được điền đầy, điều này giúp Radon trở nên bền vững với cấu hình của một khí hiếm.
Vị trí của Radon trong Bảng Tuần Hoàn
Radon nằm ở nhóm 18 và chu kỳ 6 trong bảng tuần hoàn. Do có lớp vỏ electron ngoài cùng (6p) được điền đầy, Radon thuộc về nhóm khí hiếm, và nó có cấu hình ổn định không dễ dàng tham gia vào các phản ứng hóa học.
Trong bảng tuần hoàn, Radon nằm ở khối p, vì electron cuối cùng của nó nằm trong phân lớp p (6p).
Ứng dụng và tính chất
Radon là một nguyên tố phóng xạ và có một số ứng dụng trong nghiên cứu thủy học và trong y học, đặc biệt trong điều trị ung thư. Tuy nhiên, Radon cũng là một chất gây ung thư nguy hiểm khi được hít phải với nồng độ cao trong không khí.

.png)
1. Giới thiệu về Radon
Radon (ký hiệu hóa học: Rn) là một nguyên tố thuộc nhóm khí hiếm trong bảng tuần hoàn và có số nguyên tử là 86. Đây là một nguyên tố phóng xạ tự nhiên, không màu, không mùi và không vị. Radon được hình thành từ sự phân rã của uranium và thorium trong lòng đất, khiến nó trở thành một thành phần của không khí mà chúng ta hít thở, đặc biệt là ở những khu vực có hàm lượng uranium cao.
Radon nằm ở chu kỳ 6 và nhóm 18 trong bảng tuần hoàn, thể hiện nó là một khí hiếm với lớp vỏ electron ngoài cùng đã được điền đầy, tạo nên tính ổn định hóa học. Do có lớp vỏ ngoài cùng chứa đầy các electron, radon ít phản ứng với các chất khác và tồn tại chủ yếu ở trạng thái khí.
Mặc dù là một khí hiếm, radon lại có khả năng gây hại nghiêm trọng đối với sức khỏe con người. Nó là một trong những nguyên nhân chính gây ung thư phổi sau thuốc lá khi tồn tại với nồng độ cao trong không khí trong nhà. Vì lý do này, việc kiểm tra và giảm thiểu nồng độ radon trong không gian sống và làm việc là rất quan trọng.
2. Cấu hình Electron của Radon
Radon (Rn) là một nguyên tố hóa học có số nguyên tử 86, nằm trong nhóm khí hiếm của bảng tuần hoàn. Cấu hình electron của Radon là một đặc điểm quan trọng giúp xác định tính chất hóa học và vật lý của nguyên tố này. Cấu hình electron của Radon có thể được biểu diễn bằng cách liệt kê các lớp vỏ electron theo thứ tự từ trong ra ngoài.
Cấu hình electron của Radon được viết như sau:
\[
\text{Rn}: [\text{Xe}] 4f^{14} 5d^{10} 6s^{2} 6p^{6}
\]
- [\text{Xe}]: Đây là cấu hình electron của Xenon (Z=54), một khí hiếm khác trong cùng nhóm, có cấu trúc bền vững.
- 4f^{14}: Phân lớp 4f chứa đầy 14 electron, tạo ra sự ổn định cho nguyên tố.
- 5d^{10}: Phân lớp 5d chứa đầy 10 electron, tiếp tục đóng góp vào cấu hình bền vững.
- 6s^{2}: Phân lớp 6s chứa 2 electron, nằm ở lớp vỏ thứ 6 và đóng vai trò trong việc hoàn thiện cấu hình.
- 6p^{6}: Phân lớp 6p chứa đầy 6 electron, hoàn thành cấu hình electron ngoài cùng của Radon, khiến nó trở thành một nguyên tố rất ít hoạt động hóa học.
Với cấu hình electron này, Radon thể hiện tính chất đặc trưng của các khí hiếm, đó là tính trơ về mặt hóa học. Điều này là do lớp vỏ electron ngoài cùng đã được điền đầy, làm cho Radon không dễ dàng tham gia vào các phản ứng hóa học. Cấu hình này cũng là lý do tại sao Radon tồn tại ở trạng thái khí dưới điều kiện bình thường.

3. Vị trí của Radon trong bảng tuần hoàn
Radon (Rn) là một nguyên tố thuộc nhóm 18 trong bảng tuần hoàn, thường được gọi là nhóm khí hiếm hay nhóm khí trơ. Đây là nhóm các nguyên tố có tính chất hóa học rất ổn định, do lớp vỏ electron ngoài cùng đã được điền đầy, làm cho các nguyên tố này ít có xu hướng tham gia vào các phản ứng hóa học.
- Nhóm: Radon nằm trong nhóm 18 của bảng tuần hoàn, còn được gọi là nhóm khí hiếm. Đây là nhóm cuối cùng trong bảng tuần hoàn, bao gồm các nguyên tố như Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe), và Radon (Rn).
- Chu kỳ: Radon nằm trong chu kỳ 6 của bảng tuần hoàn. Chu kỳ 6 là chu kỳ chứa các nguyên tố nặng, và Radon là nguyên tố cuối cùng trong chu kỳ này.
- Khối: Radon thuộc khối p trong bảng tuần hoàn, vì electron cuối cùng của nó nằm trong phân lớp p (6p6).
- Vị trí trong nhóm khí hiếm: Radon là nguyên tố cuối cùng trong nhóm khí hiếm, có khối lượng nguyên tử lớn nhất và là khí hiếm nặng nhất. Vị trí này phản ánh sự gia tăng về khối lượng và độ phóng xạ khi di chuyển từ trên xuống dưới trong nhóm 18.
Nhờ vị trí của mình trong nhóm khí hiếm, Radon có các tính chất đặc trưng của các khí trơ như không màu, không mùi, không vị, và cực kỳ ít phản ứng hóa học. Tuy nhiên, điểm đặc biệt của Radon so với các khí hiếm khác là tính phóng xạ mạnh, điều này làm cho nó trở nên quan trọng trong nhiều ứng dụng y học và nghiên cứu khoa học.
4. Tính chất hóa học và ứng dụng của Radon
Radon (Rn) là một nguyên tố thuộc nhóm khí hiếm trong bảng tuần hoàn, vì vậy tính chất hóa học của nó mang đặc điểm chung của các khí hiếm khác. Tuy nhiên, Radon cũng có những tính chất đặc thù do tính phóng xạ mạnh mẽ của nó.
Tính chất hóa học của Radon
- Tính trơ: Giống như các khí hiếm khác, Radon có tính trơ về mặt hóa học do cấu hình electron bền vững với lớp vỏ ngoài cùng được điền đầy (\[6s^{2}6p^{6}\]). Điều này khiến Radon không dễ dàng tham gia vào các phản ứng hóa học thông thường.
- Tính phóng xạ: Radon là một nguyên tố phóng xạ với các đồng vị có thời gian bán rã ngắn. Trong đó, đồng vị Radon-222 là phổ biến nhất và phát ra bức xạ alpha, gây hại cho sức khỏe khi hít phải với nồng độ cao.
- Phản ứng trong điều kiện đặc biệt: Mặc dù tính trơ, Radon có thể tạo thành các hợp chất trong điều kiện đặc biệt, chẳng hạn như Radon fluoride (RnF2), tuy nhiên, những hợp chất này rất không ổn định.
Ứng dụng của Radon
- Trong y học: Radon được sử dụng trong liệu pháp xạ trị để điều trị một số loại ung thư. Sự phóng xạ của Radon được ứng dụng để tiêu diệt tế bào ung thư, mặc dù việc sử dụng này đã giảm đi do các nguy cơ sức khỏe liên quan.
- Trong nghiên cứu địa chất: Radon được sử dụng để theo dõi hoạt động của các đứt gãy và dự đoán động đất. Sự phát thải Radon từ các đứt gãy trong lòng đất có thể là dấu hiệu của các hoạt động địa chất tiềm năng.
- Trong nghiên cứu môi trường: Radon được sử dụng để nghiên cứu các quá trình lưu thông khí và nước ngầm trong lòng đất. Điều này giúp đánh giá mức độ ô nhiễm và hiểu rõ hơn về các quá trình tự nhiên trong môi trường.
Mặc dù Radon có những ứng dụng quan trọng, nhưng cần phải quản lý và sử dụng nó một cách thận trọng do tính chất phóng xạ nguy hiểm đối với sức khỏe con người.

5. Cảnh báo và biện pháp an toàn khi tiếp xúc với Radon
Radon là một khí phóng xạ tự nhiên, không màu, không mùi, và không vị, có thể gây hại nghiêm trọng đến sức khỏe nếu tiếp xúc với nồng độ cao trong thời gian dài. Đặc biệt, Radon được xem là nguyên nhân thứ hai gây ung thư phổi sau thuốc lá. Vì vậy, hiểu rõ các cảnh báo và biện pháp an toàn khi tiếp xúc với Radon là rất quan trọng.
Cảnh báo khi tiếp xúc với Radon
- Tính phóng xạ của Radon: Radon phân rã và phát ra các hạt alpha, có khả năng gây tổn thương tế bào nếu chúng xâm nhập vào cơ thể, đặc biệt qua đường hô hấp.
- Nguy cơ gây ung thư phổi: Khi hít phải Radon, các hạt phóng xạ có thể lưu lại trong phổi, gây tổn thương tế bào và tăng nguy cơ ung thư phổi, đặc biệt là đối với những người hút thuốc lá.
- Nồng độ Radon trong nhà: Radon có thể xâm nhập vào nhà từ lòng đất qua các kẽ hở, vết nứt trong nền móng và tường. Nồng độ Radon trong không khí trong nhà có thể tăng cao mà không có dấu hiệu rõ rệt, do đó cần kiểm tra thường xuyên.
Biện pháp an toàn khi tiếp xúc với Radon
- Kiểm tra nồng độ Radon: Thực hiện đo lường nồng độ Radon trong không gian sống và làm việc bằng các thiết bị đo lường chuyên dụng. Việc này nên được thực hiện định kỳ để phát hiện sớm bất kỳ sự gia tăng nào của Radon.
- Cải thiện hệ thống thông gió: Tăng cường thông gió trong nhà bằng cách mở cửa sổ, sử dụng quạt hoặc hệ thống thông gió để giảm nồng độ Radon trong không khí.
- Sửa chữa các kẽ hở và vết nứt: Kiểm tra và sửa chữa các vết nứt, kẽ hở trong nền móng, tường và sàn nhà để ngăn chặn Radon xâm nhập từ lòng đất vào nhà.
- Sử dụng hệ thống giảm thiểu Radon: Trong trường hợp nồng độ Radon cao, cần lắp đặt hệ thống giảm thiểu Radon chuyên dụng để giảm mức độ Radon trong không khí trong nhà xuống mức an toàn.
Việc nắm rõ các biện pháp an toàn và thực hiện kiểm tra định kỳ là rất quan trọng để bảo vệ sức khỏe của bản thân và gia đình khỏi nguy cơ phơi nhiễm Radon.