Chủ đề silver electron configuration: Silver electron configuration là cấu hình electron của nguyên tố bạc, biểu thị cách mà các electron sắp xếp trong các orbital của nguyên tử bạc. Cấu hình này ảnh hưởng lớn đến tính chất hóa học và vật lý của bạc, giúp chúng ta hiểu rõ hơn về cách bạc tương tác trong các phản ứng hóa học và các ứng dụng của nó trong công nghệ và công nghiệp.
Mục lục
- Cấu hình electron của bạc (Ag)
- 1. Giới thiệu về bạc và cấu hình electron
- 2. Cấu hình electron đầy đủ và rút gọn của bạc
- 3. Quy tắc và nguyên lý viết cấu hình electron
- 4. Ảnh hưởng của cấu hình electron đến tính chất hóa học và vật lý của bạc
- 5. Cách xác định cấu hình electron của các nguyên tố khác
- 6. Câu hỏi thường gặp về cấu hình electron của bạc
- 7. Kết luận
Cấu hình electron của bạc (Ag)
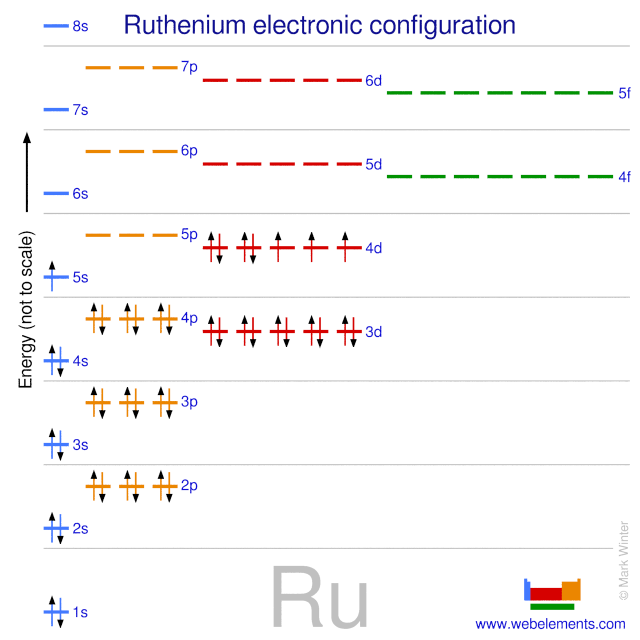
Nguyên tố bạc (ký hiệu Ag) có số nguyên tử là 47, nằm trong nhóm 11 của bảng tuần hoàn, thuộc dãy kim loại chuyển tiếp. Bạc có cấu hình electron đặc trưng, cho phép nó có các tính chất hóa học và vật lý độc đáo.
Cấu hình electron đầy đủ
Cấu hình electron đầy đủ của bạc được viết như sau:
\[1s^{2} 2s^{2} 2p^{6} 3s^{2} 3p^{6} 3d^{10} 4s^{2} 4p^{6} 4d^{10} 5s^{1}\]
Trong đó, các số trong ký hiệu (như 1s, 2s, 2p, v.v.) biểu thị các lớp vỏ và các phân lớp tương ứng, còn các số mũ (như ^2, ^6, ^10) biểu thị số electron có mặt trong phân lớp đó.
Cấu hình electron rút gọn
Cấu hình electron rút gọn của bạc, sử dụng ký hiệu khí hiếm Kr (krypton), có thể được viết như sau:
\[[Kr] 4d^{10} 5s^{1}\]
Điều này có nghĩa là các lớp vỏ bên trong của bạc tương ứng với cấu hình electron của khí krypton, và các electron còn lại nằm trong phân lớp 4d và 5s.
Lý do cấu hình đặc biệt
Bạc có cấu hình electron đặc biệt \[5s^{1} 4d^{10}\] thay vì \[5s^{2} 4d^{9}\]. Điều này là do sự ổn định đặc biệt của phân lớp đầy đủ. Một phân lớp 4d đầy đủ với 10 electron (thay vì 9) mang lại sự ổn định năng lượng cao hơn, vì vậy electron thứ hai trong phân lớp 5s chuyển sang phân lớp 4d.
Tính chất hóa học và vật lý
- Bạc có tính dẫn điện và dẫn nhiệt cao nhất trong số tất cả các kim loại.
- Nó có thể dễ dàng tạo thành hợp kim với nhiều kim loại khác và có khả năng phản ứng với nhiều phi kim khác nhau.
- Bạc thường được tìm thấy trong tự nhiên dưới dạng kim loại tự do (bạc nguyên sinh), trong hợp kim với vàng, và trong các khoáng chất như argentite và chlorargyrite.
Tầm quan trọng của cấu hình electron
Cấu hình electron cung cấp thông tin quan trọng về cách một nguyên tố sẽ tương tác với các nguyên tố khác, hình thành liên kết hóa học, và tham gia vào các phản ứng hóa học. Hiểu biết về cấu hình electron của bạc giúp các nhà khoa học dự đoán cách nó sẽ phản ứng trong các môi trường hóa học khác nhau và ứng dụng của nó trong công nghiệp và y học.

.png)
1. Giới thiệu về bạc và cấu hình electron
Bạc (ký hiệu hóa học là Ag, từ tiếng Latin "argentum") là một nguyên tố hóa học trong bảng tuần hoàn, có số nguyên tử là 47. Đây là một kim loại chuyển tiếp thuộc nhóm 11, nằm ở chu kỳ 5 và khối d. Bạc nổi tiếng với độ dẫn điện, dẫn nhiệt và độ phản xạ ánh sáng cao nhất trong tất cả các kim loại, làm cho nó được sử dụng rộng rãi trong nhiều ứng dụng khác nhau từ trang sức đến các thiết bị điện tử.
Về cấu hình electron, bạc có cấu hình electron đầy đủ là:
Đây là cấu hình electron của một nguyên tử bạc ở trạng thái cơ bản, với các electron được phân bố trong các lớp và phân lớp năng lượng khác nhau. Cấu hình rút gọn của bạc được biểu diễn là [Kr] 4d10 5s1, cho thấy bạc có một electron duy nhất trong phân lớp 5s, trong khi phân lớp 4d đã được lấp đầy với 10 electron.
Cấu hình electron này giải thích cho tính chất hóa học đặc trưng của bạc, bao gồm tính chất dẫn điện và phản ứng hóa học của nó với các chất khác. Bạc thường xuất hiện ở trạng thái oxy hóa +1, nhưng cũng có thể tồn tại ở trạng thái -1, +2 và +3 trong một số hợp chất đặc biệt.
Với tính chất dẫn điện vượt trội, bạc được sử dụng trong nhiều ngành công nghiệp và công nghệ, chẳng hạn như trong sản xuất bảng mạch điện tử và các thiết bị y tế. Bạc cũng có khả năng kháng khuẩn, làm cho nó hữu ích trong việc chế tạo các sản phẩm kháng khuẩn và bảo vệ sức khỏe.
2. Cấu hình electron đầy đủ và rút gọn của bạc
Bạc, với ký hiệu hóa học là Ag và số nguyên tử 47, có một cấu hình electron đặc biệt. Để hiểu rõ hơn về cách các electron phân bố trong các lớp và phân lớp của nguyên tử bạc, chúng ta cần xem xét cả cấu hình electron đầy đủ và rút gọn.
Cấu hình electron đầy đủ của bạc có thể được biểu diễn bằng cách liệt kê tất cả các electron trong các lớp và phân lớp tương ứng. Bắt đầu từ lớp đầu tiên, electron sẽ điền vào các orbital theo thứ tự năng lượng từ thấp đến cao, theo nguyên tắc Aufbau. Quá trình này bao gồm việc điền vào các phân lớp theo thứ tự: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, và 4d.
Với tổng cộng 47 electron, cấu hình electron đầy đủ của bạc là:
- 1s2
- 2s2 2p6
- 3s2 3p6
- 4s2 3d10
- 4p6 4d10
- 5s1
Cấu hình electron rút gọn của bạc, sử dụng ký hiệu của khí hiếm gần nhất là krypton (Kr), sẽ rút gọn các lớp đầy đủ trước krypton, giúp đơn giản hóa cấu hình. Do đó, cấu hình electron rút gọn của bạc là:
\[
[Kr] 4d^{10} 5s^1
\]
Trong cấu hình này, [Kr] đại diện cho cấu hình electron của khí hiếm krypton, bao gồm tất cả các electron từ 1s đến 4p. Phần còn lại của cấu hình mô tả các electron trong phân lớp 4d và 5s, tương ứng với lớp ngoài cùng của nguyên tử bạc.
Hiểu cấu hình electron của bạc không chỉ giúp chúng ta hiểu về tính chất hóa học của bạc, mà còn giải thích cách nó tương tác với các nguyên tố khác trong quá trình hình thành liên kết hóa học và tham gia các phản ứng hóa học.

3. Quy tắc và nguyên lý viết cấu hình electron
Viết cấu hình electron của một nguyên tố dựa trên một số quy tắc và nguyên lý cơ bản, bao gồm:
- Nguyên lý Pauli: Mỗi orbital chỉ chứa tối đa hai electron, và chúng phải có spin ngược chiều nhau. Điều này có nghĩa là không có hai electron nào trong cùng một nguyên tử có thể có bốn số lượng tử giống nhau.
- Quy tắc Hund: Trong một tập hợp các orbital có cùng năng lượng (degenerate orbitals), electron sẽ điền vào các orbital một cách đơn lẻ trước khi chúng được ghép đôi. Điều này giúp giảm thiểu lực đẩy giữa các electron do chúng có cùng chiều spin, từ đó tạo ra một trạng thái năng lượng thấp hơn cho nguyên tử.
- Nguyên lý Aufbau: Electron sẽ được điền vào các orbital theo thứ tự từ năng lượng thấp đến cao. Các orbital với năng lượng thấp hơn sẽ được điền trước, sau đó mới đến các orbital với năng lượng cao hơn. Thứ tự năng lượng của các orbital thường được xác định bằng cách sử dụng biểu đồ mức năng lượng hoặc bảng tuần hoàn mở rộng.
Ví dụ, khi viết cấu hình electron cho bạc (Ag), chúng ta áp dụng các quy tắc trên:
- Đầu tiên, ta áp dụng nguyên lý Aufbau để điền electron vào các orbital từ năng lượng thấp đến cao: \(1s^2, 2s^2, 2p^6, 3s^2, 3p^6, 4s^2, 3d^{10}, 4p^6, 5s^2, 4d^9\).
- Tiếp theo, theo quy tắc Hund, chúng ta đảm bảo rằng các electron trong orbital \(4d\) sẽ được điền sao cho mỗi orbital đều có một electron trước khi ghép đôi. Tuy nhiên, do cấu hình electron đặc biệt của bạc, thực tế là \(4d^{10} 5s^1\) để đạt trạng thái bền vững hơn.
- Cuối cùng, nguyên lý Pauli đảm bảo rằng trong mỗi orbital \(s\), \(p\), hoặc \(d\), các electron có spin ngược chiều nhau.
Thông qua việc áp dụng các quy tắc và nguyên lý này, chúng ta có thể hiểu rõ hơn về cách các electron được sắp xếp trong các nguyên tử và tác động của chúng đến tính chất hóa học của nguyên tố.

4. Ảnh hưởng của cấu hình electron đến tính chất hóa học và vật lý của bạc
Bạc (Ag) là một kim loại chuyển tiếp nằm trong nhóm 11 của bảng tuần hoàn, có cấu hình electron là [Kr] 4d10 5s1. Cấu hình này ảnh hưởng mạnh mẽ đến cả tính chất hóa học và vật lý của bạc.
Tính chất hóa học:
- Tính khử mạnh: Bạc có xu hướng mất electron 5s duy nhất để tạo thành ion Ag+. Điều này làm cho bạc thể hiện tính khử mạnh trong các phản ứng hóa học.
- Khả năng tạo phức: Orbital d đầy đủ (4d10) của bạc cho phép nó tạo thành các phức hợp đa dạng với các ion và phân tử khác, đóng vai trò quan trọng trong hóa học phức hợp và trong các quá trình sinh học.
Tính chất vật lý:
- Độ dẫn điện và dẫn nhiệt cao: Cấu hình electron của bạc cho phép các electron tự do di chuyển dễ dàng, dẫn đến khả năng dẫn điện và dẫn nhiệt vượt trội. Bạc có độ dẫn điện cao nhất trong tất cả các kim loại.
- Tính chất quang học: Bạc có khả năng phản xạ ánh sáng mạnh, điều này phần nào liên quan đến cấu trúc electron và tương tác giữa các electron trong các mức năng lượng khác nhau. Tính chất này được ứng dụng trong các thiết bị quang học và trang sức.
- Tính chất cơ học: Mặc dù có độ cứng thấp, bạc vẫn có độ bền kéo cao nhờ cấu hình electron bền vững của lớp 4d đầy đủ, giúp tạo ra một mạng lưới tinh thể ổn định và linh hoạt.
Nhờ những đặc điểm này, bạc đã trở thành một kim loại quan trọng trong nhiều ngành công nghiệp như điện tử, trang sức, và hóa học. Cấu hình electron độc đáo của nó là yếu tố chính giải thích các tính chất vượt trội này.

5. Cách xác định cấu hình electron của các nguyên tố khác
Cấu hình electron của một nguyên tố mô tả sự phân bố của các electron trong các lớp vỏ và phân lớp của nguyên tử đó. Để xác định cấu hình electron cho các nguyên tố khác, ta cần tuân theo một số nguyên tắc cơ bản như sau:
- Nguyên tắc Aufbau: Nguyên tắc này cho biết các electron sẽ lấp đầy các orbital có mức năng lượng thấp hơn trước khi lấp đầy các orbital có mức năng lượng cao hơn. Quá trình này diễn ra từ mức năng lượng thấp nhất đến cao nhất theo thứ tự từ s đến p, d, và f.
- Quy tắc Hund: Quy tắc này quy định rằng các electron sẽ được phân bố vào các orbital trong cùng một phân lớp sao cho số electron chưa ghép đôi là lớn nhất. Điều này giúp tối đa hóa spin tổng của các electron và giảm năng lượng tổng của hệ thống.
- Nguyên tắc Pauli: Theo nguyên tắc này, không có hai electron nào trong cùng một nguyên tử có thể có cùng bốn số lượng tử. Do đó, mỗi orbital có thể chứa tối đa hai electron với spin ngược chiều nhau.
Để xác định cấu hình electron của một nguyên tố, hãy thực hiện các bước sau:
- Tra cứu vị trí của nguyên tố trên bảng tuần hoàn để xác định số electron tổng cộng.
- Sử dụng nguyên tắc Aufbau để lấp đầy các orbital theo thứ tự năng lượng tăng dần. Ví dụ, bắt đầu với 1s, tiếp theo là 2s, 2p, 3s, 3p, và tiếp tục theo thứ tự cho đến khi lấp đầy hết số electron của nguyên tố đó.
- Áp dụng quy tắc Hund khi lấp đầy các phân lớp p, d, và f để đảm bảo rằng các electron được phân bố sao cho số electron chưa ghép đôi là tối đa.
- Kiểm tra và đảm bảo tuân thủ nguyên tắc Pauli để chắc chắn rằng không có hai electron nào trong cùng một orbital có cùng spin.
Ví dụ, để xác định cấu hình electron của nguyên tố bạc (Ag) với số nguyên tử là 47, ta có thể xác định cấu hình electron đầy đủ là 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁶ 5s¹ 4d¹⁰, và cấu hình rút gọn là [Kr] 4d¹⁰ 5s¹. Điều này dựa trên việc tuân thủ các nguyên tắc Aufbau, Hund và Pauli.
XEM THÊM:
6. Câu hỏi thường gặp về cấu hình electron của bạc
Trong quá trình học về bạc, nhiều câu hỏi thú vị có thể xuất hiện liên quan đến cấu hình electron của nguyên tố này. Dưới đây là một số câu hỏi thường gặp mà nhiều người quan tâm:
- Cấu hình electron của bạc là gì?
- Có bao nhiêu electron hóa trị trong bạc?
- Tại sao cấu hình electron của bạc không tuân theo quy tắc Aufbau thông thường?
- Làm thế nào để xác định cấu hình electron của một nguyên tố khác?
Cấu hình electron đầy đủ của bạc (Ag) là \(1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^2 4p^6 4d^{10} 5s^1\). Cấu hình rút gọn là \([Kr] 4d^{10} 5s^1\), trong đó [Kr] biểu thị cấu hình electron của nguyên tố khí hiếm Krypton.
Bạc có một electron hóa trị nằm trong lớp vỏ ngoài cùng, cụ thể là electron \(5s^1\). Electron này ảnh hưởng mạnh mẽ đến tính chất hóa học và khả năng liên kết của bạc.
Cấu hình electron của bạc không tuân theo quy tắc Aufbau thông thường do sự ổn định bổ sung của phân lớp \(d\) đã đầy đủ electron (\(4d^{10}\)). Điều này giúp bạc đạt đến trạng thái năng lượng thấp hơn và ổn định hơn.
Để xác định cấu hình electron của một nguyên tố khác, bạn có thể sử dụng bảng tuần hoàn để theo dõi thứ tự các phân lớp và điền vào electron dựa trên nguyên lý Pauli, quy tắc Hund và quy tắc Aufbau.

7. Kết luận
Hiểu biết về cấu hình electron là một yếu tố quan trọng trong hóa học, giúp giải thích và dự đoán tính chất hóa học của các nguyên tố. Cấu hình electron của bạc (Ag), được biểu diễn là \([Kr] 4d^{10} 5s^1\), không chỉ giải thích lý do tại sao bạc có khả năng dẫn điện tốt mà còn cho thấy sự ổn định đặc biệt của nó.
Qua cấu hình electron này, chúng ta thấy rằng bạc có một cấu hình đặc biệt, trong đó lớp 4d được lấp đầy trước khi lớp 5s. Điều này xảy ra do các tương tác năng lượng đặc thù giữa các orbital, làm cho trạng thái có năng lượng thấp hơn được lấp đầy trước. Việc này không chỉ giải thích tính chất vật lý của bạc như tính dẫn điện và nhiệt cao mà còn cho phép bạc tham gia vào các phản ứng hóa học một cách linh hoạt.
Những kiến thức về cấu hình electron giúp các nhà khoa học xác định được các hành vi hóa học của bạc khi tương tác với các nguyên tố khác, từ đó phát triển các ứng dụng công nghiệp và đời sống, như trong lĩnh vực điện tử, nha khoa và chế tác trang sức. Bạc, với tính chất độc đáo và các ứng dụng đa dạng, là một ví dụ điển hình về tầm quan trọng của việc hiểu rõ cấu hình electron.
Ngoài bạc, việc áp dụng các nguyên lý và quy tắc cấu hình electron cũng giúp chúng ta nắm bắt được tính chất và hành vi của nhiều nguyên tố khác trong bảng tuần hoàn. Điều này không chỉ góp phần vào sự phát triển của hóa học hiện đại mà còn mở rộng hiểu biết của chúng ta về thế giới vi mô, từ đó đóng góp vào nhiều lĩnh vực khoa học và công nghệ khác nhau.
Tóm lại, cấu hình electron không chỉ là một công cụ để mô tả sự phân bố của electron trong nguyên tử, mà còn là chìa khóa mở ra cánh cửa khám phá những tính chất kỳ diệu của các nguyên tố, giúp chúng ta hiểu rõ hơn về tự nhiên và cách các vật liệu hoạt động trong thế giới xung quanh.