Chủ đề the valence electron: The Valence Electron là yếu tố then chốt trong việc hiểu rõ cấu trúc nguyên tử và các phản ứng hóa học. Bài viết này sẽ đi sâu vào khái niệm electron hóa trị, cách xác định chúng và vai trò của chúng trong các liên kết hóa học, từ đó giúp bạn nắm bắt kiến thức cơ bản và ứng dụng thực tế trong đời sống và nghiên cứu khoa học.
Mục lục
Thông Tin Về Electron Hóa Trị
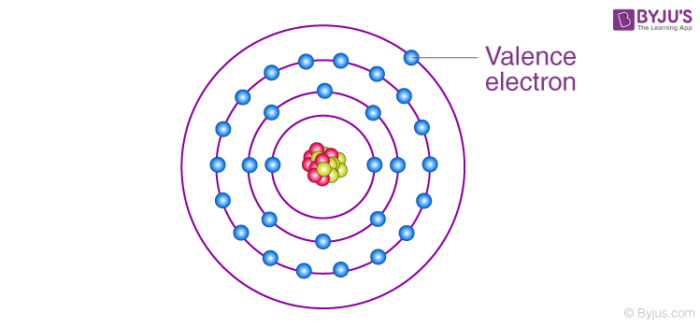
Electron hóa trị là các electron nằm ở lớp ngoài cùng của một nguyên tử, đóng vai trò quan trọng trong việc tạo liên kết hóa học giữa các nguyên tử. Các electron này quyết định tính chất hóa học của nguyên tố, như khả năng tạo liên kết và phản ứng hóa học.
Xác Định Electron Hóa Trị
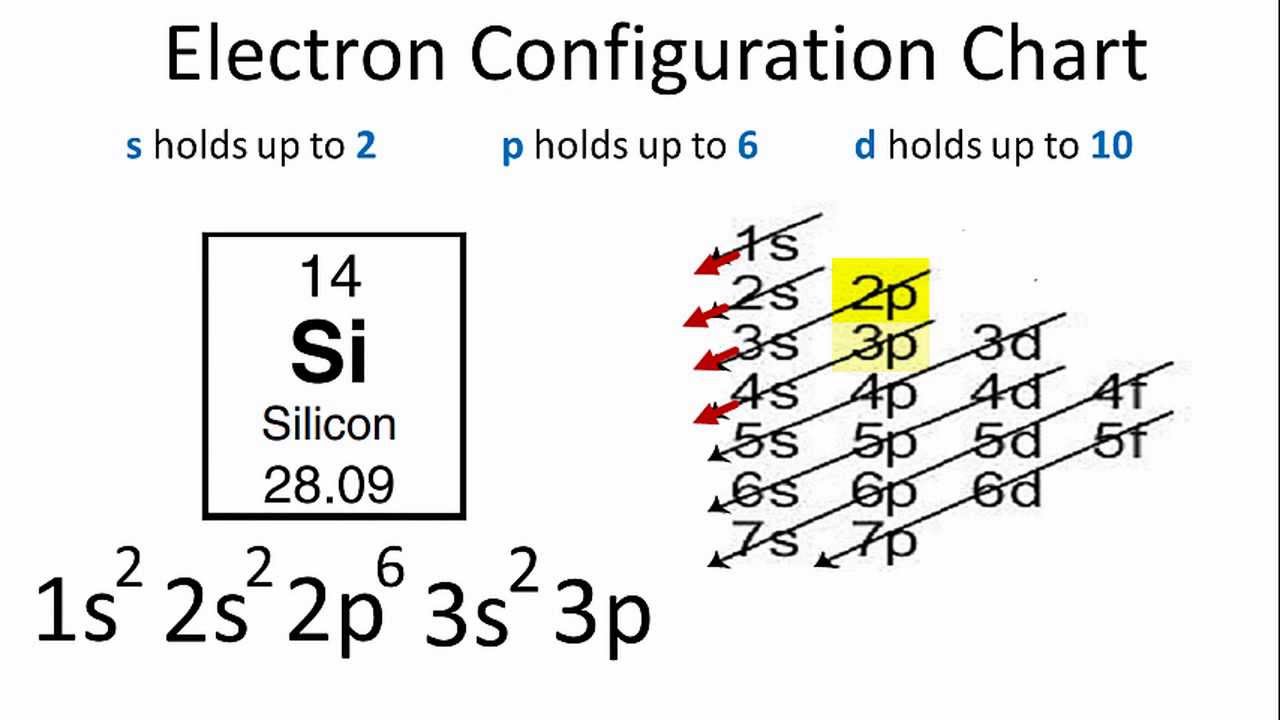
Electron hóa trị có thể được xác định dựa trên cấu hình electron của nguyên tử. Ví dụ, với nguyên tố nitơ (\(N\)), cấu hình electron là \(1s^2 2s^2 2p^3\), nghĩa là có 5 electron hóa trị.
Bảng Nhóm Và Electron Hóa Trị
| Nhóm | Số Electron Hóa Trị |
|---|---|
| Nhóm 1 (Kim loại kiềm) | 1 |
| Nhóm 2 (Kim loại kiềm thổ) | 2 |
| Nhóm 13 | 3 |
| Nhóm 14 | 4 |
| Nhóm 15 | 5 |
| Nhóm 16 | 6 |
| Nhóm 17 (Halogen) | 7 |
| Nhóm 18 (Khí hiếm) | 8 |
Vai Trò Của Electron Hóa Trị
- Quyết định tính chất hóa học của nguyên tử.
- Tham gia vào việc tạo thành liên kết hóa học.
- Giúp xác định loại liên kết: ion, cộng hóa trị.
Như vậy, electron hóa trị đóng vai trò then chốt trong việc quyết định tính chất và phản ứng hóa học của các nguyên tố.

.png)
1. Khái Niệm Về Electron Hóa Trị
Electron hóa trị là các electron nằm ở lớp ngoài cùng của nguyên tử, có khả năng tham gia vào các liên kết hóa học. Những electron này quyết định các đặc tính hóa học của nguyên tố, như khả năng tạo thành liên kết cộng hóa trị hay ion.
Ví dụ, nguyên tử carbon (\(C\)) có 4 electron hóa trị trong cấu hình electron của nó (\[1s^2 2s^2 2p^2\]). Điều này cho phép carbon tạo ra bốn liên kết cộng hóa trị với các nguyên tử khác.
- Cấu Hình Electron: Electron hóa trị là các electron ở lớp vỏ ngoài cùng, ví dụ như trong \(2p^2\) của carbon.
- Tính Chất Hóa Học: Số lượng electron hóa trị quyết định khả năng tạo liên kết và phản ứng hóa học của nguyên tử.
Các electron hóa trị là yếu tố then chốt trong việc hiểu cách các nguyên tố tương tác và phản ứng với nhau trong các phản ứng hóa học.
2. Cách Xác Định Electron Hóa Trị
Để xác định electron hóa trị, chúng ta có thể thực hiện các bước sau:
- Xác Định Số Lớp Electron: Xác định số lớp electron của nguyên tử dựa trên số thứ tự của nguyên tố trong bảng tuần hoàn.
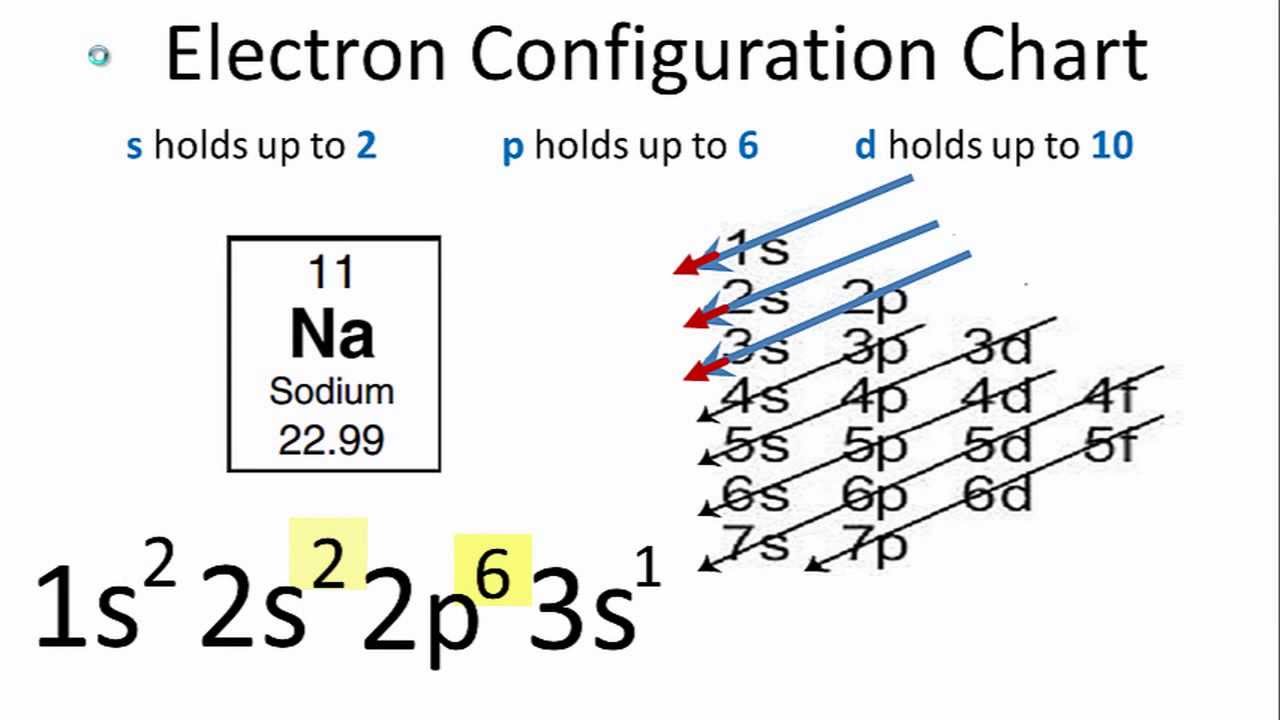
- Xác Định Cấu Hình Electron: Sử dụng bảng tuần hoàn để xác định cấu hình electron của nguyên tố, ví dụ với natri (\(Na\)):
Cấu hình electron của \(Na\) là \([1s^2 2s^2 2p^6 3s^1]\). Electron hóa trị ở lớp ngoài cùng là \(3s^1\). - Xác Định Electron Hóa Trị: Electron hóa trị là các electron ở lớp vỏ ngoài cùng. Đối với \(Na\), electron hóa trị là \(1\).
Việc xác định đúng electron hóa trị giúp dự đoán tính chất hóa học của nguyên tố và cách chúng tham gia vào các phản ứng hóa học.

3. Electron Hóa Trị Trong Các Nhóm Nguyên Tố
Electron hóa trị có số lượng khác nhau giữa các nhóm nguyên tố trong bảng tuần hoàn. Điều này ảnh hưởng đến tính chất hóa học của các nguyên tố trong cùng một nhóm.
- Nhóm 1 (Kim Loại Kiềm): Các nguyên tố trong nhóm này có 1 electron hóa trị, ví dụ: \(Li\), \(Na\), \(K\). Điều này làm cho chúng dễ dàng mất electron và tạo thành ion dương (\(+1\)).
- Nhóm 2 (Kim Loại Kiềm Thổ): Các nguyên tố này có 2 electron hóa trị, ví dụ: \(Be\), \(Mg\), \(Ca\). Chúng cũng dễ mất electron nhưng tạo thành ion có điện tích \(+2\).
- Nhóm 17 (Halogen): Các nguyên tố halogen có 7 electron hóa trị, ví dụ: \(F\), \(Cl\), \(Br\). Chúng có xu hướng nhận thêm 1 electron để đạt cấu hình bền vững, tạo thành ion âm (\(-1\)).
- Nhóm 18 (Khí Hiếm): Các nguyên tố này có 8 electron hóa trị (ngoại trừ \(He\) có 2 electron), ví dụ: \(Ne\), \(Ar\). Cấu hình electron bền vững này làm cho chúng rất khó phản ứng với các nguyên tố khác.
Việc hiểu rõ số lượng electron hóa trị trong các nhóm nguyên tố giúp dự đoán được các phản ứng hóa học và tính chất của nguyên tố.

4. Liên Kết Hóa Học Liên Quan Đến Electron Hóa Trị
Electron hóa trị đóng vai trò quan trọng trong việc hình thành các liên kết hóa học, bao gồm liên kết ion và liên kết cộng hóa trị.
- Liên Kết Ion: Xảy ra khi một nguyên tử mất electron hóa trị để trở thành ion dương, trong khi nguyên tử khác nhận electron để trở thành ion âm. Ví dụ, \(Na\) mất 1 electron hóa trị để trở thành \(Na^+\), và \(Cl\) nhận 1 electron để trở thành \(Cl^-\), tạo thành liên kết ion trong hợp chất \(NaCl\).
- Liên Kết Cộng Hóa Trị: Hình thành khi các nguyên tử chia sẻ electron hóa trị để đạt được cấu hình electron bền vững. Ví dụ, trong phân tử \(H_2O\), nguyên tử \(O\) chia sẻ electron với hai nguyên tử \(H\), tạo ra liên kết cộng hóa trị.
Các liên kết hóa học này giúp giải thích sự tương tác và phản ứng giữa các nguyên tử, hình thành nên các chất và hợp chất khác nhau.

5. Ứng Dụng Thực Tế Của Electron Hóa Trị
Electron hóa trị không chỉ quan trọng trong việc giải thích cấu trúc nguyên tử mà còn có nhiều ứng dụng thực tế trong cuộc sống hàng ngày.
- Trong Công Nghệ: Các thiết bị điện tử như transistor và diode đều dựa vào tính chất của electron hóa trị để hoạt động, từ đó tạo nên các mạch điện và thiết bị công nghệ.
- Trong Hóa Học: Electron hóa trị giúp xác định tính chất hóa học của các nguyên tố, từ đó ứng dụng trong việc tạo ra hợp chất mới, bao gồm dược phẩm, vật liệu mới, và chất xúc tác.
- Trong Công Nghiệp: Các quá trình như điện phân, mạ điện, và sản xuất pin đều dựa vào hiểu biết về electron hóa trị để cải thiện hiệu suất và an toàn.
Nhờ vào những ứng dụng này, electron hóa trị trở thành một khái niệm cốt lõi, không chỉ trong lý thuyết mà còn trong thực tiễn.
XEM THÊM:
6. Tổng Kết Và Hướng Nghiên Cứu Tương Lai
Electron hóa trị đóng vai trò quan trọng trong việc hiểu biết về cấu trúc nguyên tử và tính chất hóa học của các nguyên tố. Những nghiên cứu trong lĩnh vực này đã giúp tạo ra nhiều ứng dụng thực tiễn trong khoa học và công nghệ. Trong tương lai, hướng nghiên cứu có thể tập trung vào việc khám phá cách electron hóa trị ảnh hưởng đến các hiện tượng lượng tử, từ đó mở ra những cơ hội mới trong lĩnh vực vật liệu và năng lượng.