Chủ đề electron energy: Electron energy là một khái niệm quan trọng trong vật lý và công nghệ, đóng vai trò then chốt trong nhiều lĩnh vực như quang phổ học, công nghệ bán dẫn, và năng lượng tái tạo. Bài viết này sẽ giúp bạn hiểu rõ hơn về năng lượng điện tử, từ các khái niệm cơ bản đến những ứng dụng thực tiễn trong cuộc sống.
Mục lục
Tổng quan về năng lượng electron
Năng lượng electron là một khái niệm cơ bản trong vật lý và hóa học lượng tử, mô tả mức năng lượng mà một electron có thể tồn tại trong một nguyên tử hoặc phân tử. Khái niệm này liên quan đến nhiều hiện tượng vật lý như sự hấp thụ và phát xạ photon, chuyển dời năng lượng trong các phản ứng hóa học và cấu trúc phổ học.
Các mức năng lượng của electron
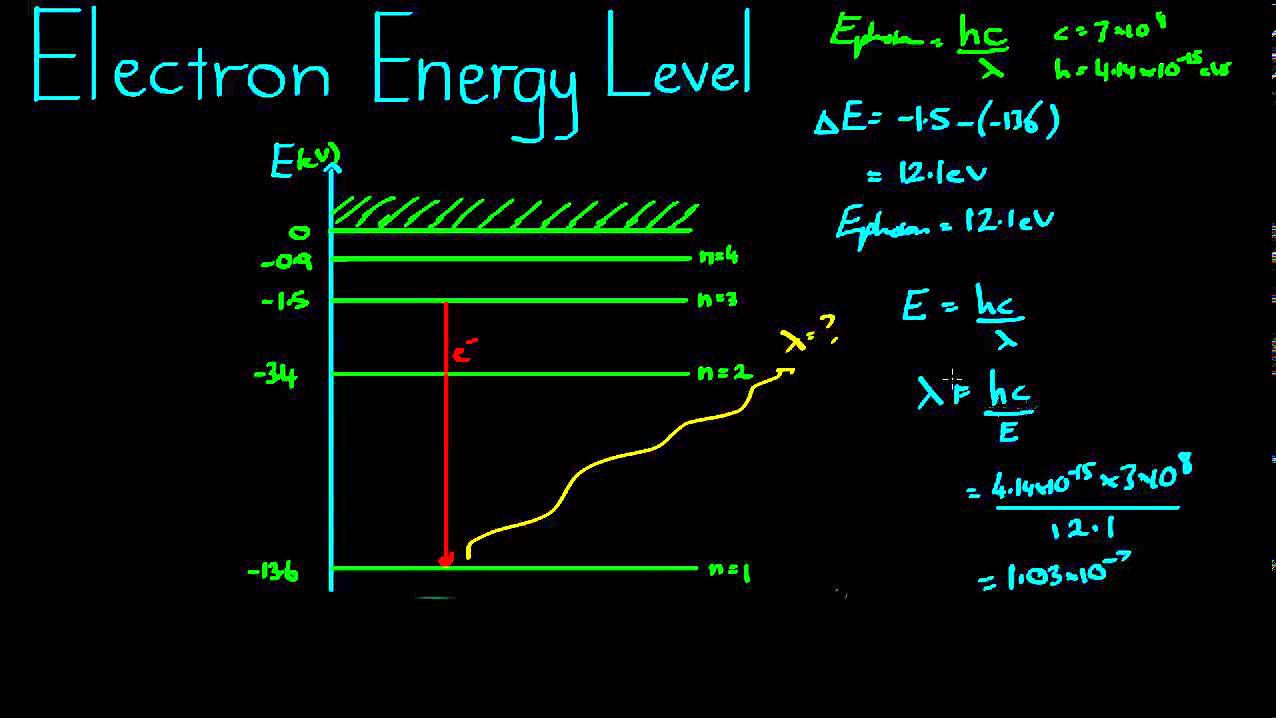
Một nguyên tử có thể có nhiều mức năng lượng khác nhau, và các electron có thể tồn tại trong các mức này. Mức năng lượng thấp nhất mà electron có thể chiếm giữ được gọi là trạng thái cơ bản. Khi electron nhận thêm năng lượng, nó có thể chuyển lên các mức năng lượng cao hơn, được gọi là trạng thái kích thích. Công thức tính năng lượng của electron trong nguyên tử hydro là:
\[
E_n = - \frac{13.6}{n^2} \text{ eV}
\]
Trong đó, \(n\) là số lượng tử chính, biểu thị mức năng lượng mà electron đang chiếm giữ.
Chuyển dời năng lượng của electron
Khi electron chuyển từ mức năng lượng cao về mức thấp hơn, nó sẽ phát ra một photon có năng lượng bằng hiệu số năng lượng giữa hai mức. Ngược lại, để electron nhảy từ mức năng lượng thấp lên cao, nó cần hấp thụ một photon với năng lượng tương đương. Công thức mô tả quá trình này là:
\[
\Delta E = E_{high} - E_{low} = h \nu
\]
Trong đó, \(\Delta E\) là năng lượng phát ra hoặc hấp thụ, \(h\) là hằng số Planck, và \(\nu\) là tần số của photon.
Ứng dụng của năng lượng electron
- Quang phổ học: Năng lượng electron được sử dụng để phân tích quang phổ của các nguyên tử và phân tử, qua đó giúp xác định cấu trúc và thành phần của chất.
- Phản ứng hóa học: Năng lượng của electron quyết định khả năng tham gia phản ứng của các nguyên tử và phân tử, đặc biệt trong các phản ứng oxi hóa khử.
- Công nghệ bán dẫn: Hiểu biết về mức năng lượng của electron là cơ sở để thiết kế và chế tạo các thiết bị bán dẫn như diode và transistor.
Các mô hình và lý thuyết liên quan
Các lý thuyết hiện đại như cơ học lượng tử và mô hình nguyên tử Bohr cung cấp cách giải thích chi tiết về năng lượng electron. Cơ học lượng tử mô tả electron như một sóng, với các mức năng lượng là các trạng thái đứng của sóng này trong một vùng không gian giới hạn.
Kết luận
Năng lượng electron không chỉ là một khái niệm cơ bản mà còn có ý nghĩa ứng dụng rộng rãi trong khoa học và công nghệ. Nó là nền tảng cho nhiều ngành nghiên cứu từ vật lý, hóa học đến công nghệ cao.
.png)
1. Khái Niệm Về Năng Lượng Electron
Năng lượng electron là một khái niệm cơ bản trong vật lý lượng tử và hóa học. Nó mô tả mức năng lượng mà một electron có thể sở hữu khi tồn tại trong một nguyên tử hoặc phân tử. Các electron trong nguyên tử có thể chiếm giữ các mức năng lượng khác nhau, được xác định bởi số lượng tử chính \(n\).
Các mức năng lượng của electron trong một nguyên tử được xác định bởi công thức:
\[
E_n = - \frac{13.6 \text{ eV}}{n^2}
\]
Trong đó:
- \(E_n\): năng lượng của electron ở mức lượng tử thứ \(n\).
- \(n\): số lượng tử chính, là số nguyên dương (1, 2, 3,...).
Năng lượng electron trong nguyên tử được lượng tử hóa, có nghĩa là nó chỉ có thể tồn tại ở những giá trị cụ thể chứ không phải bất kỳ giá trị nào. Điều này là do các electron bị ràng buộc bởi trường điện từ của hạt nhân nguyên tử, dẫn đến việc chúng chỉ có thể chiếm các mức năng lượng rời rạc.
Khi một electron chuyển từ mức năng lượng cao xuống mức năng lượng thấp hơn, nó phát ra một photon có năng lượng tương ứng với sự chênh lệch giữa hai mức năng lượng đó. Ngược lại, để một electron chuyển lên mức năng lượng cao hơn, nó phải hấp thụ một photon có năng lượng tương ứng.
Khái niệm này không chỉ áp dụng cho các electron trong nguyên tử mà còn cho các electron trong các hệ thống khác như phân tử, ion, và cả trong các chất rắn, nơi mà các electron có thể di chuyển tự do hoặc bị ràng buộc trong một dải năng lượng.
2. Các Mức Năng Lượng Của Electron
Trong một nguyên tử, các electron tồn tại trong các mức năng lượng rời rạc, được gọi là các vỏ hoặc lớp năng lượng. Mỗi lớp năng lượng này tương ứng với một số lượng tử chính \(n\), biểu thị khoảng cách trung bình của electron so với hạt nhân. Các lớp năng lượng được ký hiệu từ K, L, M,... hoặc theo số lượng tử chính \(n = 1, 2, 3,...\).
Công thức tổng quát để xác định số lượng electron tối đa trong một lớp năng lượng là:
\[
N = 2n^2
\]
Trong đó:
- \(N\): Số lượng electron tối đa trong lớp năng lượng đó.
- \(n\): Số lượng tử chính.
Các electron trong nguyên tử sẽ chiếm các lớp năng lượng từ thấp đến cao. Lớp K (\(n=1\)) có thể chứa tối đa 2 electron, lớp L (\(n=2\)) chứa tối đa 8 electron, lớp M (\(n=3\)) chứa tối đa 18 electron, và cứ thế tiếp tục.
Khi một electron chuyển từ một lớp năng lượng cao xuống lớp năng lượng thấp hơn, nó phát ra năng lượng dưới dạng photon. Ngược lại, để chuyển lên một lớp năng lượng cao hơn, electron cần hấp thụ năng lượng từ bên ngoài. Điều này dẫn đến hiện tượng phổ điện từ, được ứng dụng rộng rãi trong quang phổ học và các kỹ thuật phân tích hóa học.
Trong các nguyên tử có nhiều electron, các electron ở lớp năng lượng ngoài cùng (còn gọi là electron hóa trị) có vai trò quan trọng trong việc quyết định tính chất hóa học của nguyên tử. Những electron này dễ dàng tham gia vào các phản ứng hóa học, do đó các nguyên tử có số lượng electron hóa trị giống nhau thường có tính chất hóa học tương tự nhau.
Do các mức năng lượng của electron là rời rạc, nên chỉ có những bước nhảy năng lượng nhất định mới có thể xảy ra, và điều này tạo ra các vạch quang phổ đặc trưng cho mỗi nguyên tố, giúp chúng ta nhận diện và phân tích các nguyên tố qua quang phổ.

3. Quá Trình Chuyển Dời Năng Lượng Của Electron
Quá trình chuyển dời năng lượng của electron diễn ra khi electron di chuyển giữa các mức năng lượng trong nguyên tử hoặc phân tử. Đây là một hiện tượng quan trọng trong nhiều lĩnh vực khoa học, bao gồm vật lý lượng tử, hóa học, và quang học.
3.1 Chuyển Dời Từ Mức Năng Lượng Cao Xuống Mức Thấp
Khi một electron chuyển từ mức năng lượng cao xuống mức năng lượng thấp hơn, nó sẽ phát ra một photon có năng lượng tương đương với hiệu số giữa hai mức năng lượng này. Hiện tượng này được gọi là sự phát xạ. Công thức mô tả quá trình này là:
\[
\Delta E = E_{high} - E_{low} = h \nu
\]
Trong đó:
- \(\Delta E\): Sự chênh lệch năng lượng giữa hai mức.
- \(E_{high}\): Năng lượng của mức cao.
- \(E_{low}\): Năng lượng của mức thấp.
- \(h\): Hằng số Planck.
- \(\nu\): Tần số của photon phát ra.
3.2 Chuyển Dời Từ Mức Năng Lượng Thấp Lên Mức Cao
Ngược lại, để một electron chuyển từ mức năng lượng thấp lên mức năng lượng cao hơn, nó cần hấp thụ một photon có năng lượng bằng với sự chênh lệch giữa hai mức năng lượng này. Hiện tượng này gọi là sự hấp thụ năng lượng.
Chuyển dời năng lượng của electron là cơ sở của nhiều ứng dụng quan trọng, chẳng hạn như trong quang phổ học, nơi sự phát xạ và hấp thụ photon được sử dụng để xác định thành phần và cấu trúc của các nguyên tử và phân tử.
3.3 Quá Trình Kích Thích và Phát Xạ
Trong một số trường hợp, electron có thể được kích thích lên một mức năng lượng cao hơn bằng cách hấp thụ năng lượng từ bên ngoài, chẳng hạn như từ ánh sáng hoặc điện trường. Sau đó, electron sẽ trở về mức năng lượng thấp hơn bằng cách phát ra photon, quá trình này được gọi là phát xạ.
Quá trình kích thích và phát xạ của electron đóng vai trò quan trọng trong nhiều hiện tượng tự nhiên và ứng dụng công nghệ, bao gồm sự phát sáng của các chất huỳnh quang, hoạt động của các điốt phát quang (LED), và sự hoạt động của laser.
3.4 Ứng Dụng Trong Công Nghệ
Các quá trình chuyển dời năng lượng của electron được sử dụng rộng rãi trong nhiều lĩnh vực công nghệ. Ví dụ, trong các thiết bị bán dẫn, sự chuyển dời năng lượng của electron giữa các dải năng lượng quyết định tính dẫn điện và hoạt động của thiết bị. Trong lĩnh vực y học, các quá trình này được ứng dụng trong các kỹ thuật hình ảnh như cộng hưởng từ hạt nhân (MRI) và xạ trị.
Ngoài ra, việc hiểu rõ quá trình chuyển dời năng lượng của electron cũng là cơ sở cho sự phát triển của các công nghệ mới như tế bào năng lượng mặt trời, trong đó năng lượng từ ánh sáng mặt trời được sử dụng để kích thích electron, tạo ra dòng điện.

4. Ứng Dụng Của Năng Lượng Electron
Năng lượng electron đóng vai trò quan trọng trong nhiều lĩnh vực khoa học và công nghệ, từ các ứng dụng cơ bản trong hóa học đến các ứng dụng tiên tiến trong vật lý và y học. Dưới đây là một số ứng dụng tiêu biểu của năng lượng electron:
4.1 Quang Phổ Học
Quang phổ học sử dụng năng lượng electron để phân tích cấu trúc của các nguyên tử và phân tử. Khi các electron chuyển dời giữa các mức năng lượng, chúng phát ra hoặc hấp thụ photon với các bước sóng cụ thể. Việc phân tích các bước sóng này cho phép các nhà khoa học xác định thành phần hóa học của các chất.
4.2 Công Nghệ Bán Dẫn
Năng lượng electron là nền tảng cho công nghệ bán dẫn, được sử dụng rộng rãi trong các thiết bị điện tử như transistor, diot, và mạch tích hợp. Trong các vật liệu bán dẫn, các electron có thể được kích thích để chuyển từ dải hóa trị sang dải dẫn, tạo ra dòng điện. Quá trình này được kiểm soát để tạo ra các chức năng điện tử cụ thể trong các thiết bị.
4.3 Năng Lượng Mặt Trời
Trong các tế bào quang điện, năng lượng từ ánh sáng mặt trời được hấp thụ bởi các electron trong vật liệu bán dẫn, thường là silicon. Các electron này sau đó được kích thích lên mức năng lượng cao hơn, tạo ra dòng điện. Đây là nguyên lý cơ bản của việc chuyển đổi năng lượng mặt trời thành điện năng, một trong những công nghệ năng lượng tái tạo quan trọng nhất hiện nay.
4.4 Y Học và Công Nghệ Hình Ảnh
Năng lượng electron cũng được sử dụng trong y học, đặc biệt là trong các kỹ thuật hình ảnh như chụp cắt lớp vi tính (CT) và cộng hưởng từ hạt nhân (MRI). Các electron được kích thích để phát ra năng lượng, giúp tạo ra hình ảnh chi tiết của các cơ quan nội tạng, hỗ trợ chẩn đoán và điều trị bệnh.
4.5 Ứng Dụng Trong Laser
Laser hoạt động dựa trên nguyên lý khuếch đại ánh sáng bằng cách kích thích phát xạ năng lượng từ các electron. Khi các electron trong môi trường laser được kích thích lên mức năng lượng cao hơn và sau đó trở về trạng thái cơ bản, chúng phát ra ánh sáng đồng pha và cùng bước sóng, tạo ra chùm tia laser mạnh mẽ.
Các ứng dụng của năng lượng electron không chỉ giới hạn ở các lĩnh vực trên, mà còn có tiềm năng phát triển trong nhiều ngành công nghiệp và nghiên cứu khoa học khác, mang lại lợi ích to lớn cho xã hội.

5. Các Mô Hình và Lý Thuyết Liên Quan
Năng lượng electron trong nguyên tử và phân tử được mô tả qua nhiều mô hình và lý thuyết khác nhau, phản ánh sự phát triển của khoa học về cấu trúc vật chất. Các mô hình và lý thuyết này không chỉ cung cấp nền tảng lý thuyết mà còn giúp giải thích các hiện tượng quan sát được trong thực tế.
5.1 Mô Hình Nguyên Tử Bohr
Mô hình nguyên tử Bohr được phát triển bởi Niels Bohr vào năm 1913 là một trong những mô hình đầu tiên mô tả năng lượng electron một cách chi tiết. Theo mô hình này, electron di chuyển quanh hạt nhân trong các quỹ đạo tròn với mức năng lượng rời rạc. Năng lượng của electron trong một quỹ đạo được xác định bởi công thức:
\[
E_n = - \frac{13.6 \text{ eV}}{n^2}
\]
Trong đó \(n\) là số lượng tử chính của quỹ đạo.
5.2 Lý Thuyết Cơ Học Lượng Tử
Lý thuyết cơ học lượng tử, phát triển vào đầu thế kỷ 20, đã thay thế các mô hình cổ điển như mô hình Bohr. Lý thuyết này dựa trên phương trình Schrödinger để mô tả hành vi của các electron trong nguyên tử. Phương trình này cho phép tính toán hàm sóng của electron, từ đó xác định được xác suất tìm thấy electron tại một vị trí cụ thể.
Hàm sóng \(\psi\) được giải từ phương trình Schrödinger:
\[
\hat{H} \psi = E \psi
\]
Trong đó \(\hat{H}\) là toán tử Hamilton, \(\psi\) là hàm sóng, và \(E\) là năng lượng của trạng thái.
5.3 Mô Hình Đám Mây Electron
Mô hình đám mây electron là một phần mở rộng của lý thuyết cơ học lượng tử, trong đó các electron không còn được coi là các hạt chuyển động trên quỹ đạo cố định mà tồn tại trong các đám mây có mật độ xác suất cao quanh hạt nhân. Mật độ của đám mây này thể hiện xác suất tìm thấy electron tại một điểm nhất định, với các vùng mật độ cao tương ứng với các mức năng lượng thấp hơn.
5.4 Lý Thuyết Orbital Nguyên Tử
Lý thuyết orbital nguyên tử mở rộng khái niệm đám mây electron bằng cách mô tả các electron trong nguyên tử qua các orbital - các vùng không gian mà khả năng tìm thấy electron là cao nhất. Các orbital này có các dạng hình học cụ thể, chẳng hạn như hình cầu (orbital s), hình số tám (orbital p), và các dạng phức tạp hơn (orbital d và f).
5.5 Mô Hình Băng Tần Trong Chất Rắn
Trong vật lý chất rắn, mô hình băng tần được sử dụng để mô tả năng lượng electron trong các vật liệu. Theo mô hình này, các mức năng lượng của electron được chia thành các băng tần, với băng hóa trị chứa các electron liên kết và băng dẫn chứa các electron tự do có thể dẫn điện. Mô hình này là cơ sở cho việc hiểu về tính dẫn điện và các tính chất khác của chất rắn.
Các mô hình và lý thuyết trên đều đóng vai trò quan trọng trong việc hiểu và ứng dụng năng lượng electron trong nhiều lĩnh vực khoa học và công nghệ.
XEM THÊM:
6. Kết Luận
Năng lượng electron đóng vai trò quan trọng không chỉ trong các lý thuyết cơ bản về vật lý lượng tử mà còn trong các ứng dụng thực tiễn quan trọng. Từ việc giải thích các hiện tượng quang điện cho đến ứng dụng trong công nghệ bán dẫn, năng lượng electron đã trở thành một phần không thể thiếu trong sự phát triển của khoa học và công nghệ hiện đại.
Các nghiên cứu và phát triển gần đây về vật liệu bán dẫn và hiệu ứng quang điện đã chứng minh rằng việc kiểm soát và khai thác năng lượng electron có thể cải thiện đáng kể hiệu suất của các thiết bị điện tử và quang điện. Ví dụ, việc tối ưu hóa các chất bán dẫn trong pin năng lượng mặt trời giúp tăng cường khả năng chuyển đổi quang năng thành điện năng, tạo ra các giải pháp năng lượng tái tạo hiệu quả hơn.
Hơn nữa, sự hiểu biết sâu sắc về các mức năng lượng của electron và quá trình chuyển dời năng lượng trong các hệ thống nguyên tử và phân tử mở ra nhiều cơ hội nghiên cứu và ứng dụng mới. Các mô hình tiên tiến như mô hình nguyên tử Bohr hay các phương trình cơ học lượng tử đã cung cấp nền tảng lý thuyết vững chắc, giúp các nhà khoa học phát triển các công nghệ mới như vật liệu siêu dẫn, thiết bị điện tử nano, và nhiều lĩnh vực khác.
Tóm lại, năng lượng electron không chỉ là một khái niệm lý thuyết mà còn là chìa khóa mở ra những tiềm năng to lớn trong nhiều lĩnh vực công nghệ cao. Việc tiếp tục nghiên cứu và khai thác năng lượng electron sẽ góp phần quan trọng vào sự tiến bộ của khoa học và công nghệ, đặc biệt là trong bối cảnh nhu cầu năng lượng sạch và hiệu quả ngày càng tăng.