Chủ đề cu electron configuration: Cấu hình electron của Cu không chỉ là kiến thức hóa học cơ bản mà còn ẩn chứa nhiều điều thú vị về tính chất và ứng dụng của nguyên tố này. Trong bài viết này, chúng tôi sẽ hướng dẫn chi tiết về cấu hình electron của Cu, giải thích lý do tại sao nó có dạng độc đáo và các bài tập liên quan.
Mục lục
Cấu hình electron của nguyên tử đồng (Cu)
Cấu hình electron của nguyên tử đồng, ký hiệu hóa học là Cu, có số hiệu nguyên tử là 29. Đây là một kiến thức cơ bản trong hóa học, giúp xác định vị trí của nguyên tố trong bảng tuần hoàn cũng như các tính chất hóa học của nó.
1. Cấu hình electron của nguyên tử đồng (Z = 29)
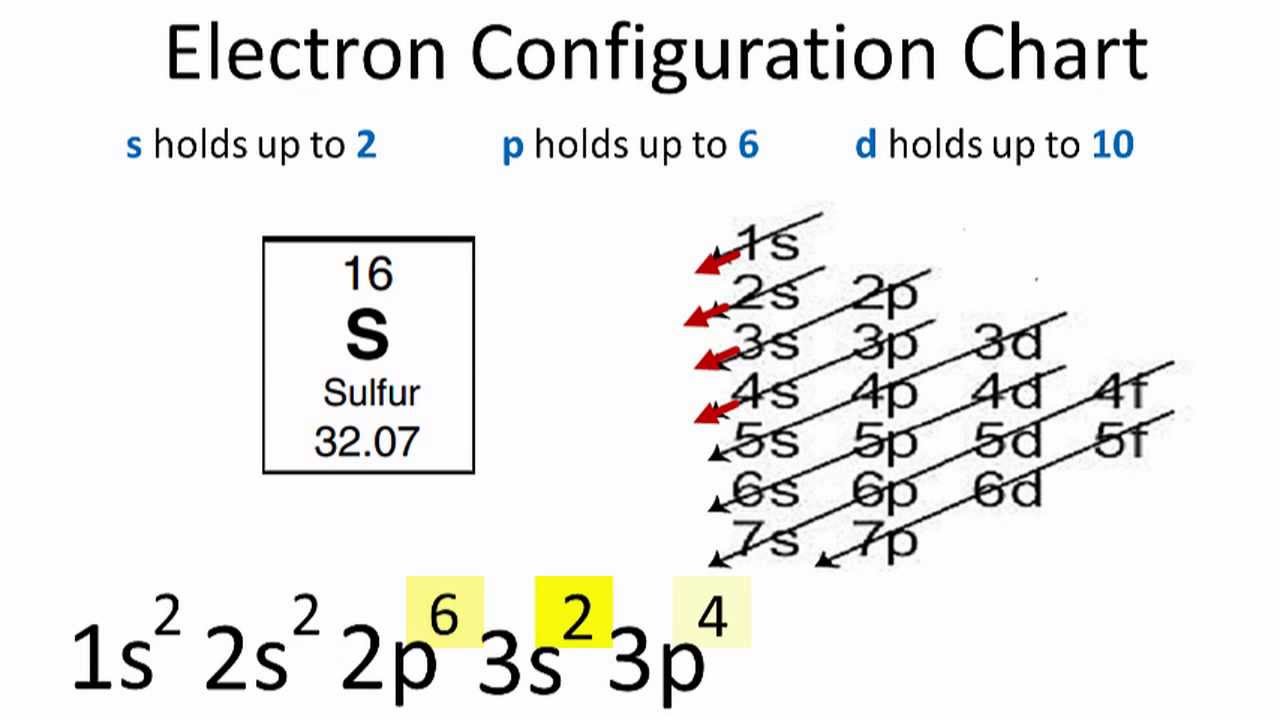
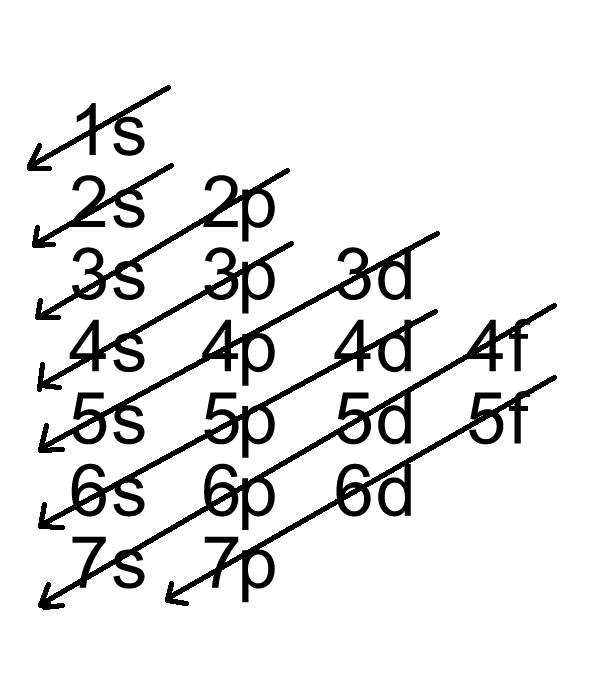
Cấu hình electron của Cu được xác định dựa trên phân bố các electron trong các phân lớp của các lớp electron. Dưới đây là cấu hình electron chi tiết:
- Phân bố ban đầu: \(1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^9\)
- Do trạng thái này không bền vững, một electron ở phân lớp 4s sẽ chuyển sang phân lớp 3d để đạt trạng thái bão hòa bền vững hơn.
- Cấu hình electron cuối cùng: \(1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^1\)
Viết gọn: \([Ar] 3d^{10} 4s^1\)
2. Vị trí trong bảng tuần hoàn
Dựa trên cấu hình electron của Cu, có thể xác định vị trí của nó trong bảng tuần hoàn như sau:
- Cu nằm ở ô số 29.
- Chu kỳ 4 (do có 4 lớp electron).
- Nhóm IB (do tổng số electron thuộc hai phân lớp 3d và 4s là 11).
- Cu là nguyên tố d, thuộc nhóm kim loại chuyển tiếp.
3. Tính chất hóa học của đồng
Đồng là một kim loại chuyển tiếp với các tính chất hóa học sau:
- Đồng có thể tồn tại ở các trạng thái oxy hóa +1 và +2, trong đó trạng thái +2 là phổ biến nhất.
- Trong hợp chất, đồng thường tạo ra các ion \(\text{Cu}^+\) và \(\text{Cu}^{2+}\).
4. Ví dụ và bài tập
Dưới đây là một số ví dụ minh họa cho cấu hình electron của Cu và các bài tập liên quan:
- Câu hỏi: Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là 4s1. Số electron phân lớp d nhiều hơn số electron phân lớp s là 3 electron. Vị trí của X trong bảng tuần hoàn hóa học?
Đáp án: Chu kỳ 4, nhóm IB. - Câu hỏi: Nguyên tử của nguyên tố X có cấu hình electron ở phân lớp ngoài cùng và sát ngoài cùng là 3d10 4s1. Cấu hình electron của nguyên tử X là gì?
Đáp án: [Ar] 3d10 4s1.

.png)
1. Giới thiệu về nguyên tố đồng (Cu)
Đồng (Cu) là một trong những kim loại quan trọng và phổ biến nhất trong bảng tuần hoàn hóa học. Đồng có số hiệu nguyên tử là 29, thuộc nhóm 11 và chu kỳ 4 của bảng tuần hoàn. Với ký hiệu hóa học là Cu, nguyên tố này đã được sử dụng từ thời cổ đại và hiện nay có mặt trong nhiều ứng dụng công nghiệp và đời sống.
Đồng có màu đỏ cam đặc trưng và là kim loại mềm, dẻo, dẫn điện và dẫn nhiệt rất tốt. Chính những tính chất này đã khiến đồng trở thành vật liệu không thể thiếu trong ngành điện tử, sản xuất dây điện, và các thiết bị truyền dẫn nhiệt.
Trong hóa học, đồng là một nguyên tố chuyển tiếp, điều này có nghĩa là nó có khả năng tạo ra nhiều trạng thái oxy hóa khác nhau, phổ biến nhất là +1 và +2. Cấu hình electron của đồng là:
\[
1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^1
\]
Cấu hình này giải thích tại sao đồng có những đặc tính hóa học đặc trưng và vai trò của nó trong nhiều phản ứng hóa học. Ngoài ra, đồng cũng đóng vai trò quan trọng trong cơ thể con người, tham gia vào nhiều quá trình sinh học thiết yếu.
2. Cấu hình electron của nguyên tử đồng (Cu)
Cấu hình electron của nguyên tử đồng (Cu) phản ánh cách các electron phân bố trong các lớp và phân lớp xung quanh hạt nhân nguyên tử. Đồng có số hiệu nguyên tử là 29, nghĩa là nó có 29 electron. Các electron này được phân bố trong các lớp electron theo một trật tự nhất định.
Bắt đầu với lớp electron đầu tiên, đồng có cấu hình electron như sau:
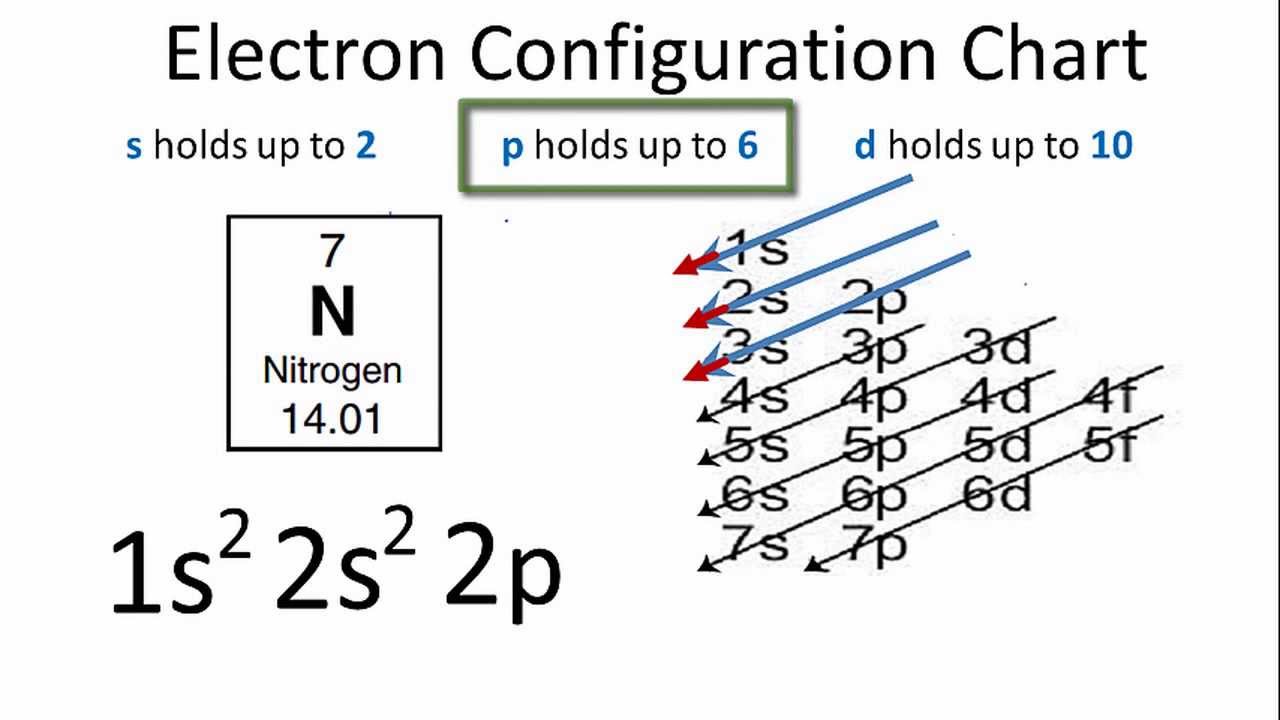
- Lớp 1: \(1s^2\)
- Lớp 2: \(2s^2 2p^6\)
- Lớp 3: \(3s^2 3p^6\)
- Lớp 4: \(3d^{10} 4s^1\)
Cấu hình electron đầy đủ của Cu là:
\[
1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^1
\]
Cấu hình electron này là kết quả của quá trình phân bố năng lượng, trong đó phân lớp 3d nhận được 10 electron trước khi phân lớp 4s nhận 1 electron. Điều này giúp đồng đạt được trạng thái ổn định hơn.
Một điểm đặc biệt của cấu hình electron của Cu là mặc dù các phân lớp electron thường được lấp đầy theo thứ tự năng lượng từ thấp đến cao, nhưng ở đây, phân lớp 4s chỉ chứa một electron trong khi phân lớp 3d chứa 10 electron. Điều này là do phân lớp 3d có mức năng lượng thấp hơn sau khi đã lấp đầy và trở nên ổn định hơn so với phân lớp 4s.
Việc hiểu rõ cấu hình electron của Cu không chỉ giúp nắm bắt các tính chất hóa học của nguyên tố này mà còn giải thích được vì sao đồng có thể tham gia vào nhiều phản ứng hóa học và có nhiều trạng thái oxy hóa khác nhau, chủ yếu là +1 và +2.

3. Vị trí của đồng (Cu) trong bảng tuần hoàn
Đồng (Cu) nằm ở vị trí đặc biệt trong bảng tuần hoàn, thuộc nhóm 11, chu kỳ 4. Đây là nhóm các kim loại chuyển tiếp, nơi Cu được xếp cùng với bạc (Ag) và vàng (Au), những kim loại có tính dẫn điện và dẫn nhiệt cao.
Với cấu hình electron \([Ar] 3d^{10} 4s^1\), Cu có tổng cộng 29 electron, phân bố qua 4 lớp electron. Điều này xác định vị trí của Cu trong chu kỳ 4, nơi các nguyên tố có số electron tăng dần từ trái sang phải. Đồng thuộc nhóm 11 vì số electron trong phân lớp d cộng với electron ở phân lớp s cuối cùng bằng 11.
Nhóm 11, nơi đồng thuộc về, còn được gọi là nhóm kim loại đồng, bao gồm các kim loại quý và có độ bền hóa học cao. Các nguyên tố trong nhóm này thường có trạng thái oxy hóa +1 và +2, với Cu chủ yếu ở trạng thái +2.
- Chu kỳ: Cu nằm trong chu kỳ 4, đây là chu kỳ bắt đầu lấp đầy phân lớp 3d.
- Nhóm: Cu thuộc nhóm 11, cùng với Ag và Au.
- Phân loại: Cu là kim loại chuyển tiếp, đặc trưng bởi khả năng tạo phức chất và nhiều trạng thái oxy hóa.
Vị trí của Cu trong bảng tuần hoàn cũng giải thích tính chất đặc biệt của nó, bao gồm khả năng dẫn điện vượt trội và khả năng tạo hợp kim mạnh mẽ, chẳng hạn như đồng thau (brass) và đồng đỏ (bronze). Những hợp kim này có nhiều ứng dụng trong công nghiệp và nghệ thuật.

XEM THÊM:
4. Tính chất hóa học của đồng (Cu)
Đồng (Cu) là một kim loại chuyển tiếp, nổi bật với những tính chất hóa học đặc trưng. Đồng thường xuất hiện trong tự nhiên dưới dạng nguyên chất hoặc trong các khoáng chất như chalcopyrit (CuFeS2) và malachit (Cu2(CO3)2(OH)2).
Dưới đây là một số tính chất hóa học quan trọng của đồng:
- Trạng thái oxy hóa: Đồng có thể tồn tại trong hai trạng thái oxy hóa phổ biến là +1 và +2. Trong hợp chất Cu(I), đồng có cấu hình electron \([Ar] 3d^{10}\), và trong hợp chất Cu(II), cấu hình electron là \([Ar] 3d^9\).
- Phản ứng với phi kim: Đồng phản ứng với phi kim như oxi và lưu huỳnh để tạo thành các oxit và sulfua tương ứng. Ví dụ:
- Cu phản ứng với O2 tạo CuO (oxit đồng II) hoặc Cu2O (oxit đồng I) tùy vào điều kiện phản ứng.
- Cu phản ứng với S tạo CuS (sulfua đồng II).
- Phản ứng với axit: Đồng không phản ứng với axit clohydric (HCl) hoặc axit sulfuric loãng (H2SO4 loãng) ở điều kiện thường, nhưng phản ứng mạnh với axit nitric (HNO3) và axit sulfuric đặc (H2SO4 đặc) khi đun nóng để tạo ra khí NO2 hoặc SO2 và các muối tương ứng.
- Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
- Cu + 2H2SO4 (đặc) → CuSO4 + SO2 + 2H2O
- Tính chất khử: Trong các phản ứng oxy hóa khử, Cu có thể đóng vai trò là chất khử, chuyển từ Cu(0) sang Cu(II) khi mất đi hai electron:
- Phức chất: Đồng dễ dàng tạo thành phức chất với các ligan như amoniac (NH3), nước (H2O) và clorua (Cl-). Ví dụ, ion đồng (II) trong dung dịch tạo phức chất với amoniac:
\[
Cu^{2+} + 4NH_3 \rightarrow [Cu(NH_3)_4]^{2+}
\]
\[
Cu \rightarrow Cu^{2+} + 2e^-
\]
Tính chất hóa học của đồng khiến nó trở thành một nguyên tố quan trọng trong nhiều ứng dụng công nghiệp, đặc biệt trong ngành điện tử, sản xuất vật liệu và hóa học phân tích.

5. Bài tập và ví dụ về cấu hình electron của Cu
Để hiểu rõ hơn về cấu hình electron của đồng (Cu), dưới đây là một số bài tập và ví dụ giúp củng cố kiến thức:
Ví dụ 1: Xác định cấu hình electron của Cu
Đề bài: Hãy viết cấu hình electron của nguyên tử đồng (Cu) với số hiệu nguyên tử là 29.
Giải:
Để viết cấu hình electron, chúng ta cần sắp xếp các electron theo thứ tự từ lớp có mức năng lượng thấp đến lớp có mức năng lượng cao. Cấu hình electron của Cu là:
\[
1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^1
\]
Đây là cấu hình electron đặc trưng của Cu, với 10 electron ở phân lớp 3d và 1 electron ở phân lớp 4s.
Bài tập 1: So sánh cấu hình electron của Cu và Zn
Đề bài: Hãy so sánh cấu hình electron của đồng (Cu) và kẽm (Zn), với số hiệu nguyên tử lần lượt là 29 và 30. Giải thích tại sao chúng có tính chất hóa học khác nhau.
- Cu (Z=29): \[1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^1\]
- Zn (Z=30): \[1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^2\]
Cu có 1 electron ở phân lớp 4s, trong khi Zn có 2 electron. Điều này dẫn đến việc Cu dễ dàng mất electron hơn, làm cho Cu hoạt động hóa học mạnh hơn so với Zn.
Bài tập 2: Xác định số electron hóa trị của Cu
Đề bài: Hãy xác định số electron hóa trị của nguyên tử đồng (Cu) và giải thích vai trò của chúng trong phản ứng hóa học.
Giải:
Electron hóa trị của Cu là các electron ở lớp ngoài cùng, cụ thể là 1 electron ở phân lớp 4s và 10 electron ở phân lớp 3d. Tuy nhiên, trong hầu hết các phản ứng, electron ở phân lớp 4s dễ dàng bị mất đi, tạo thành ion Cu+ hoặc Cu2+.
Từ các bài tập trên, chúng ta có thể thấy rằng hiểu rõ cấu hình electron của Cu là rất quan trọng để dự đoán và giải thích tính chất hóa học của nó.