Chủ đề xác định số lớp electron: Xác định số lớp electron là một khái niệm quan trọng trong hóa học, giúp hiểu rõ hơn về cấu trúc nguyên tử và tính chất hóa học của các nguyên tố. Bài viết này cung cấp phương pháp chi tiết để xác định số lớp electron, ứng dụng trong việc phân tích và dự đoán tính chất của các nguyên tố, đồng thời giải đáp các thắc mắc thường gặp liên quan đến chủ đề này.
Mục lục
Xác định Số Lớp Electron
Trong hóa học, xác định số lớp electron của một nguyên tử là một khái niệm cơ bản liên quan đến cấu trúc electron trong nguyên tử. Số lớp electron tương ứng với các lớp năng lượng mà electron của nguyên tử có thể nằm trong đó. Các lớp này được đánh số thứ tự từ 1 trở đi, với lớp thứ nhất gần hạt nhân nhất và có mức năng lượng thấp nhất.
1. Khái niệm về Lớp Electron
Lớp electron là tập hợp các electron có mức năng lượng gần bằng nhau và được sắp xếp theo thứ tự từ lớp có năng lượng thấp nhất (gần hạt nhân nhất) đến lớp có năng lượng cao hơn. Các lớp electron được ký hiệu từ K, L, M, N,... tương ứng với lớp thứ 1, 2, 3, 4,...
2. Phân lớp Electron
Mỗi lớp electron lại được chia thành các phân lớp nhỏ hơn với mức năng lượng cụ thể. Các phân lớp này được ký hiệu bằng các chữ cái như s, p, d, f. Số phân lớp trong một lớp electron bằng với số thứ tự của lớp đó.
- Lớp thứ 1 (K) có 1 phân lớp: 1s
- Lớp thứ 2 (L) có 2 phân lớp: 2s, 2p
- Lớp thứ 3 (M) có 3 phân lớp: 3s, 3p, 3d
- Lớp thứ 4 (N) có 4 phân lớp: 4s, 4p, 4d, 4f
3. Cách Xác Định Số Lớp Electron
Để xác định số lớp electron, người ta thường dựa vào số hiệu nguyên tử (Z) và bảng tuần hoàn các nguyên tố:
- Dựa vào số hiệu nguyên tử: Số hiệu nguyên tử Z cho biết tổng số electron trong nguyên tử. Các electron này sẽ được điền vào các lớp electron theo thứ tự từ lớp có mức năng lượng thấp nhất.
- Sử dụng bảng tuần hoàn: Vị trí của nguyên tố trong bảng tuần hoàn cũng cho biết số lớp electron. Các nguyên tố ở chu kỳ 1 chỉ có 1 lớp, chu kỳ 2 có 2 lớp, và cứ thế tiếp tục.
- Áp dụng quy tắc 2n²: Quy tắc này cho biết mỗi lớp electron có thể chứa tối đa \(2n^2\) electron, trong đó \(n\) là số thứ tự của lớp.
4. Ví dụ Minh Họa
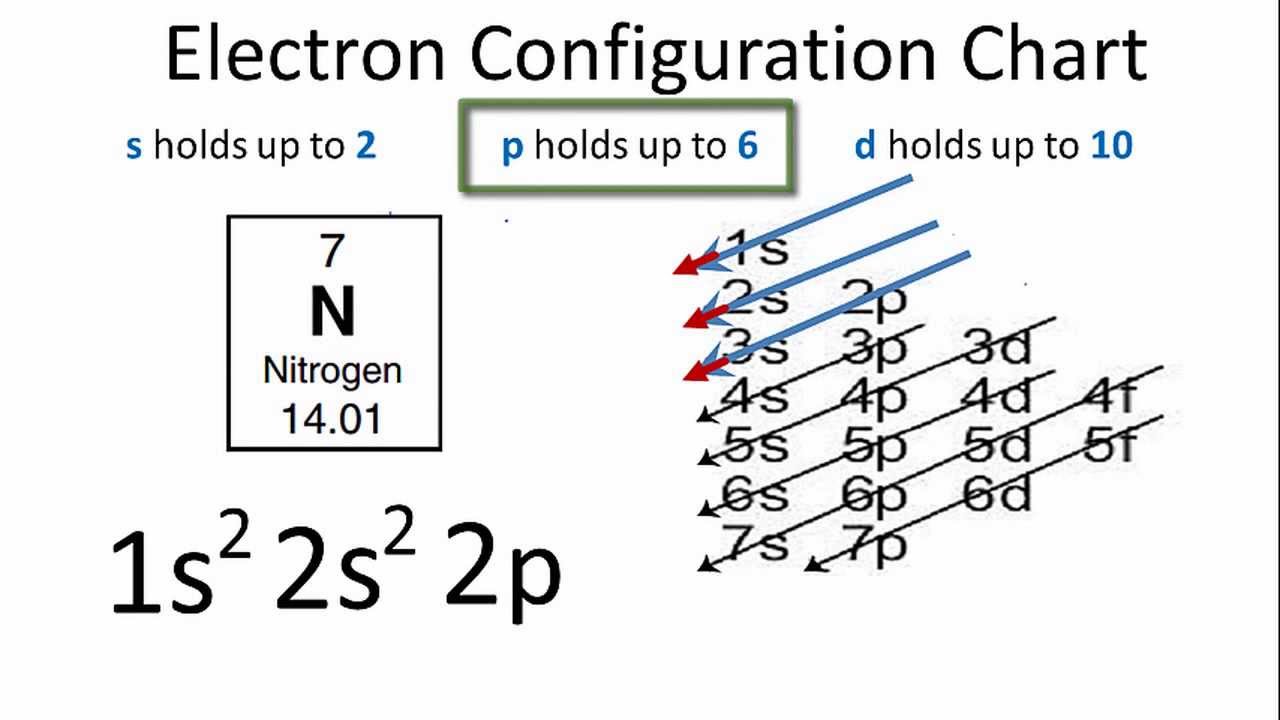
Hãy xét nguyên tử oxy với số hiệu nguyên tử Z = 8. Oxy có cấu hình electron là 1s² 2s² 2p⁴, điều này có nghĩa là nó có 2 lớp electron:
- Lớp thứ nhất chứa 2 electron: 1s²
- Lớp thứ hai chứa 6 electron: 2s² 2p⁴
5. Tính Chất của Lớp Electron Ngoài Cùng
Lớp electron ngoài cùng là lớp có mức năng lượng cao nhất và quyết định tính chất hóa học của nguyên tử. Các nguyên tố có cùng số electron ở lớp ngoài cùng được xếp vào cùng một nhóm trong bảng tuần hoàn.
6. Một Số Quy Tắc Khác
Trong khi điền electron vào các lớp, cần tuân thủ các nguyên lý và quy tắc sau:
- Nguyên lý vững bền: Electron sẽ chiếm các obital có mức năng lượng từ thấp đến cao.
- Nguyên lý Pauli: Mỗi obital chỉ chứa tối đa hai electron và hai electron này phải có chiều tự quay khác nhau.
- Quy tắc Hund: Trong cùng một phân lớp, các electron sẽ phân bố trên các obital sao cho số electron độc thân là tối đa và các electron này phải có chiều tự quay giống nhau.

.png)
1. Khái Niệm Về Lớp Electron
Lớp electron là một trong những khái niệm cơ bản trong hóa học và vật lý nguyên tử, đại diện cho các mức năng lượng khác nhau mà electron có thể tồn tại xung quanh hạt nhân của nguyên tử. Mỗi lớp electron tương ứng với một khoảng cách nhất định từ hạt nhân và chứa một số lượng electron nhất định.
Các lớp electron được đánh số từ 1 trở đi, bắt đầu từ lớp gần hạt nhân nhất:
- Lớp 1: Gần hạt nhân nhất, có mức năng lượng thấp nhất.
- Lớp 2: Xa hơn lớp 1, có mức năng lượng cao hơn.
- Lớp 3: Tiếp tục xa hơn và có mức năng lượng tiếp tục tăng.
Số lớp electron trong một nguyên tử được xác định bởi số hiệu nguyên tử (Z) của nguyên tố đó. Quy tắc chung là electron sẽ được sắp xếp vào các lớp từ lớp có năng lượng thấp nhất (lớp 1) đến cao nhất, theo quy tắc 2n², trong đó:
- \(n\) là số thứ tự của lớp electron.
- \(2n^2\) là số lượng electron tối đa có thể tồn tại trong một lớp.
Ví dụ:
- Lớp 1 (\(n = 1\)): Có thể chứa tối đa \(2 \times 1^2 = 2\) electron.
- Lớp 2 (\(n = 2\)): Có thể chứa tối đa \(2 \times 2^2 = 8\) electron.
- Lớp 3 (\(n = 3\)): Có thể chứa tối đa \(2 \times 3^2 = 18\) electron.
Các lớp electron đóng vai trò quan trọng trong việc xác định tính chất hóa học của nguyên tử. Electron ở lớp ngoài cùng (lớp có mức năng lượng cao nhất) là những electron tham gia vào các phản ứng hóa học, quyết định tính chất và hành vi của nguyên tố.
2. Cách Xác Định Số Lớp Electron
Việc xác định số lớp electron của một nguyên tử là bước quan trọng để hiểu rõ cấu trúc và tính chất hóa học của nguyên tố. Dưới đây là các phương pháp cụ thể để xác định số lớp electron trong một nguyên tử:
2.1 Sử Dụng Số Hiệu Nguyên Tử (Z)
Mỗi nguyên tố hóa học đều có một số hiệu nguyên tử Z, đại diện cho tổng số proton trong hạt nhân, và đồng thời là số lượng electron trong nguyên tử trung hòa về điện tích. Để xác định số lớp electron, ta tiến hành phân bố các electron vào các lớp, theo thứ tự từ lớp có năng lượng thấp nhất (lớp 1) đến lớp cao hơn:
- Bước 1: Xác định số hiệu nguyên tử \(Z\).
- Bước 2: Điền electron vào các lớp theo quy tắc \(2n^2\), với \(n\) là số thứ tự của lớp:
Ví dụ, với nguyên tử có Z = 11 (Natri), số electron được phân bố như sau:
- Lớp 1: \(2 \times 1^2 = 2\) electron.
- Lớp 2: \(2 \times 2^2 = 8\) electron.
- Lớp 3: \(2 \times 3^2 = 1\) electron (lớp này còn có thể chứa tối đa 18 electron, nhưng chỉ có 1 electron trong trường hợp này).
2.2 Áp Dụng Bảng Tuần Hoàn Các Nguyên Tố
Vị trí của một nguyên tố trong bảng tuần hoàn cung cấp thông tin quan trọng về số lớp electron:
- Các nguyên tố nằm trong cùng một chu kỳ (hàng ngang) của bảng tuần hoàn có cùng số lớp electron.
- Chu kỳ thứ nhất có 1 lớp electron, chu kỳ thứ hai có 2 lớp electron, và cứ tiếp tục như vậy.
Ví dụ: Nguyên tố Oxy (O) nằm ở chu kỳ 2, do đó nó có 2 lớp electron.
2.3 Áp Dụng Quy Tắc \(2n^2\)
Quy tắc \(2n^2\) được sử dụng để xác định số lượng electron tối đa mà một lớp electron có thể chứa:
- Lớp 1: Tối đa 2 electron.
- Lớp 2: Tối đa 8 electron.
- Lớp 3: Tối đa 18 electron.
Các electron sẽ được phân bố vào các lớp theo quy tắc này, bắt đầu từ lớp có năng lượng thấp nhất đến lớp có năng lượng cao hơn, cho đến khi tất cả các electron được điền hết.
2.4 Xác Định Cấu Hình Electron và Số Lớp Electron
Cấu hình electron mô tả cách các electron được sắp xếp trong các lớp và phân lớp xung quanh hạt nhân. Việc viết cấu hình electron giúp xác định số lớp electron của nguyên tử:
- Bước 1: Viết cấu hình electron theo thứ tự mức năng lượng AO tăng dần.
- Bước 2: Xác định số lớp electron bằng cách đếm các lớp khác nhau trong cấu hình electron.
Ví dụ: Cấu hình electron của nguyên tử Ne (Neon) là 1s² 2s² 2p⁶, điều này cho thấy Neon có 2 lớp electron.

3. Vai Trò của Lớp Electron Ngoài Cùng
Lớp electron ngoài cùng, còn được gọi là lớp electron hóa trị, đóng vai trò quan trọng trong việc quyết định tính chất hóa học của một nguyên tử. Đây là lớp có mức năng lượng cao nhất và là nơi diễn ra các tương tác giữa các nguyên tử trong các phản ứng hóa học. Dưới đây là các vai trò chính của lớp electron ngoài cùng:
3.1 Quyết Định Tính Chất Hóa Học
Số lượng electron ở lớp ngoài cùng ảnh hưởng trực tiếp đến tính chất hóa học của nguyên tố. Các nguyên tố có cùng số electron ngoài cùng thường có tính chất hóa học tương tự và được xếp vào cùng một nhóm trong bảng tuần hoàn:
- Các nguyên tố có 1 electron ở lớp ngoài cùng (nhóm 1) thường là kim loại kiềm và rất dễ mất electron để đạt được cấu hình electron bền vững.
- Các nguyên tố có 7 electron ở lớp ngoài cùng (nhóm 17) thường là halogen và có xu hướng nhận thêm 1 electron để đạt được cấu hình bền vững.
3.2 Ảnh Hưởng Đến Liên Kết Hóa Học
Lớp electron ngoài cùng tham gia vào việc hình thành các liên kết hóa học giữa các nguyên tử:
- Liên kết ion: Xảy ra khi một nguyên tử mất hoặc nhận electron từ nguyên tử khác để tạo ra các ion có cấu hình electron bền vững.
- Liên kết cộng hóa trị: Xảy ra khi hai nguyên tử chia sẻ electron ở lớp ngoài cùng để cùng đạt được cấu hình electron bền vững.
3.3 Quyết Định Trạng Thái Oxi Hóa
Trạng thái oxi hóa của một nguyên tố trong hợp chất phụ thuộc vào số electron ở lớp ngoài cùng mà nguyên tố đó có thể mất, nhận, hoặc chia sẻ:
- Các kim loại thường có trạng thái oxi hóa dương do mất electron.
- Các phi kim thường có trạng thái oxi hóa âm do nhận electron.
3.4 Ảnh Hưởng Đến Tính Chất Vật Lý
Lớp electron ngoài cùng không chỉ ảnh hưởng đến tính chất hóa học mà còn ảnh hưởng đến một số tính chất vật lý của nguyên tử:
- Độ âm điện: Khả năng hút electron về phía mình trong liên kết hóa học.
- Năng lượng ion hóa: Năng lượng cần thiết để loại bỏ một electron từ lớp ngoài cùng.
- Độ cứng và độ dẫn điện: Liên quan đến sự tương tác giữa các electron ở lớp ngoài cùng với các nguyên tử lân cận.

4. Ví Dụ Về Xác Định Số Lớp Electron
Để hiểu rõ hơn về cách xác định số lớp electron, dưới đây là một số ví dụ cụ thể minh họa cho quá trình này:
4.1 Ví Dụ 1: Nguyên Tử Hydro (H)
Hydro có số hiệu nguyên tử \(Z = 1\). Điều này có nghĩa là nguyên tử Hydro chỉ có 1 electron. Theo quy tắc \(2n^2\), lớp đầu tiên (n=1) có thể chứa tối đa 2 electron. Do đó, Hydro có 1 lớp electron duy nhất:
- Lớp 1: 1 electron.
4.2 Ví Dụ 2: Nguyên Tử Carbon (C)
Carbon có số hiệu nguyên tử \(Z = 6\). Để xác định số lớp electron, ta phân bố 6 electron vào các lớp theo quy tắc \(2n^2\):
- Lớp 1: 2 electron.
- Lớp 2: 4 electron.
Vậy nguyên tử Carbon có 2 lớp electron.
4.3 Ví Dụ 3: Nguyên Tử Natri (Na)
Natri có số hiệu nguyên tử \(Z = 11\). Các electron được phân bố như sau:
- Lớp 1: 2 electron.
- Lớp 2: 8 electron.
- Lớp 3: 1 electron.
Vì vậy, Natri có 3 lớp electron.
4.4 Ví Dụ 4: Nguyên Tử Neon (Ne)
Neon có số hiệu nguyên tử \(Z = 10\). Các electron được phân bố như sau:
- Lớp 1: 2 electron.
- Lớp 2: 8 electron.
Do đó, Neon có 2 lớp electron.
Những ví dụ trên minh họa cho quy trình xác định số lớp electron trong các nguyên tử khác nhau dựa trên số hiệu nguyên tử và cách phân bố electron theo quy tắc \(2n^2\).

5. Các Quy Tắc Khi Điền Electron Vào Các Lớp
Khi điền electron vào các lớp và phân lớp trong nguyên tử, các nguyên lý và quy tắc sau đây cần được tuân thủ để đảm bảo cấu hình electron chính xác và bền vững nhất:
5.1 Nguyên lý vững bền (Aufbau Principle)
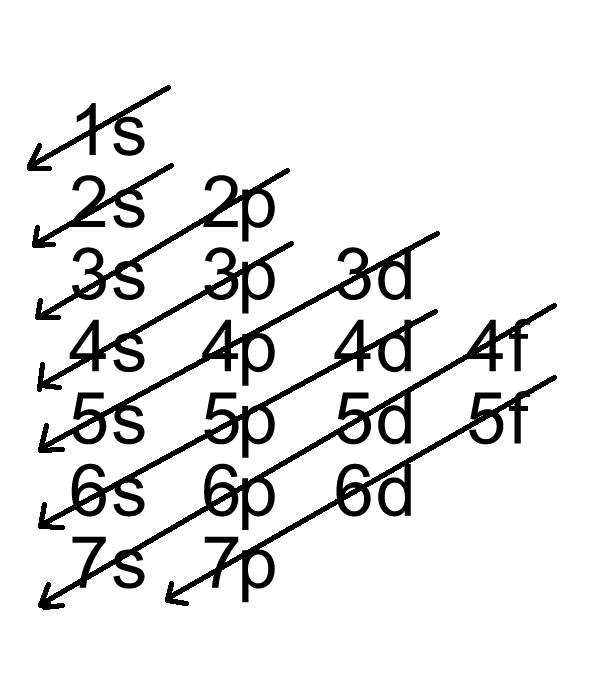
Theo nguyên lý vững bền, các electron sẽ được điền vào các orbital có mức năng lượng thấp trước, sau đó mới đến các orbital có mức năng lượng cao hơn. Trật tự điền electron vào các orbital có thể được biểu diễn như sau:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d...
5.2 Nguyên lý Pauli (Pauli Exclusion Principle)
Nguyên lý Pauli phát biểu rằng: trong một nguyên tử, không thể có hai electron có cùng bốn số lượng tử giống nhau. Điều này có nghĩa là mỗi orbital chỉ chứa tối đa hai electron và hai electron này phải có chiều tự quay (spin) ngược nhau.
\[
\text{Ví dụ: Nếu orbital 1s chứa 2 electron, chúng sẽ được biểu diễn như sau: } \uparrow \downarrow
\]
Khi một orbital chỉ chứa một electron, electron đó được gọi là electron độc thân và được biểu diễn bằng một mũi tên lên hoặc xuống:
\[
\text{Ví dụ: Orbital 2p có thể chứa electron như sau: } \uparrow \, \uparrow \, \uparrow
\]
5.3 Quy tắc Hund (Hund's Rule)
Theo quy tắc Hund, trong một phân lớp (vd: phân lớp p có 3 orbital), các electron sẽ được điền vào các orbital trống trước tiên, sao cho số electron độc thân là tối đa và các electron độc thân này phải có spin cùng chiều.
\[
\text{Ví dụ: Cấu hình electron của Carbon (Z=6) sẽ là } 1s^2 2s^2 2p^2 \text{ với các electron 2p được biểu diễn như sau: } \uparrow \, \uparrow \, \quad
\]
Khi tất cả các orbital trong phân lớp đã có một electron, các electron còn lại mới bắt đầu điền vào các orbital đã có electron theo chiều spin ngược lại.
Các quy tắc trên giúp xác định chính xác cách điền electron vào các lớp và phân lớp, từ đó xác định cấu hình electron ổn định nhất cho nguyên tử.