Chủ đề nitrogen electron configuration: Cấu hình electron của nitrogen (N) là chủ đề quan trọng trong hóa học, giúp chúng ta hiểu rõ về tính chất và vai trò của nguyên tố này. Bài viết này sẽ đưa bạn vào hành trình khám phá cách sắp xếp electron trong nguyên tử nitrogen, đồng thời giải thích các khái niệm liên quan và ứng dụng thực tế của nitrogen trong đời sống.
Mục lục
- Cấu hình electron của Nitrogen (N) và ion N3-
- Tổng quan về Nitrogen (N)
- Cấu hình Electron của Nguyên Tử Nitrogen
- Cấu hình Electron của Ion Nitride (N3-)
- Mối Quan Hệ Giữa Cấu Hình Electron và Vị Trí trong Bảng Tuần Hoàn
- Tác Động của Cấu Hình Electron đến Tính Chất Hóa Học của Nitrogen
- Ứng Dụng Của Nitrogen Trong Đời Sống
Cấu hình electron của Nitrogen (N) và ion N3-
Nitrogen, hay còn gọi là nitơ, là một nguyên tố hóa học có ký hiệu là N với số hiệu nguyên tử là 7. Cấu hình electron của nitrogen là một chủ đề quan trọng trong hóa học, giúp chúng ta hiểu rõ hơn về các đặc tính hóa học và vật lý của nguyên tố này. Dưới đây là thông tin chi tiết về cấu hình electron của nitrogen và ion N3-.
Cấu hình electron của nguyên tử Nitrogen
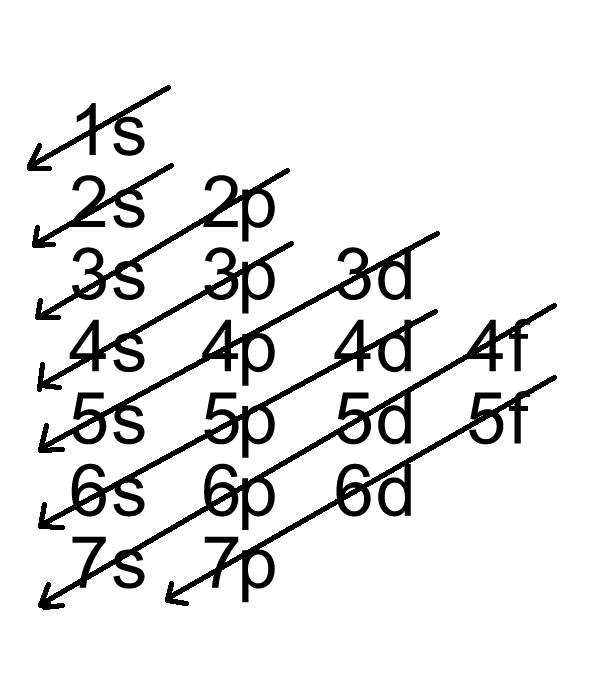
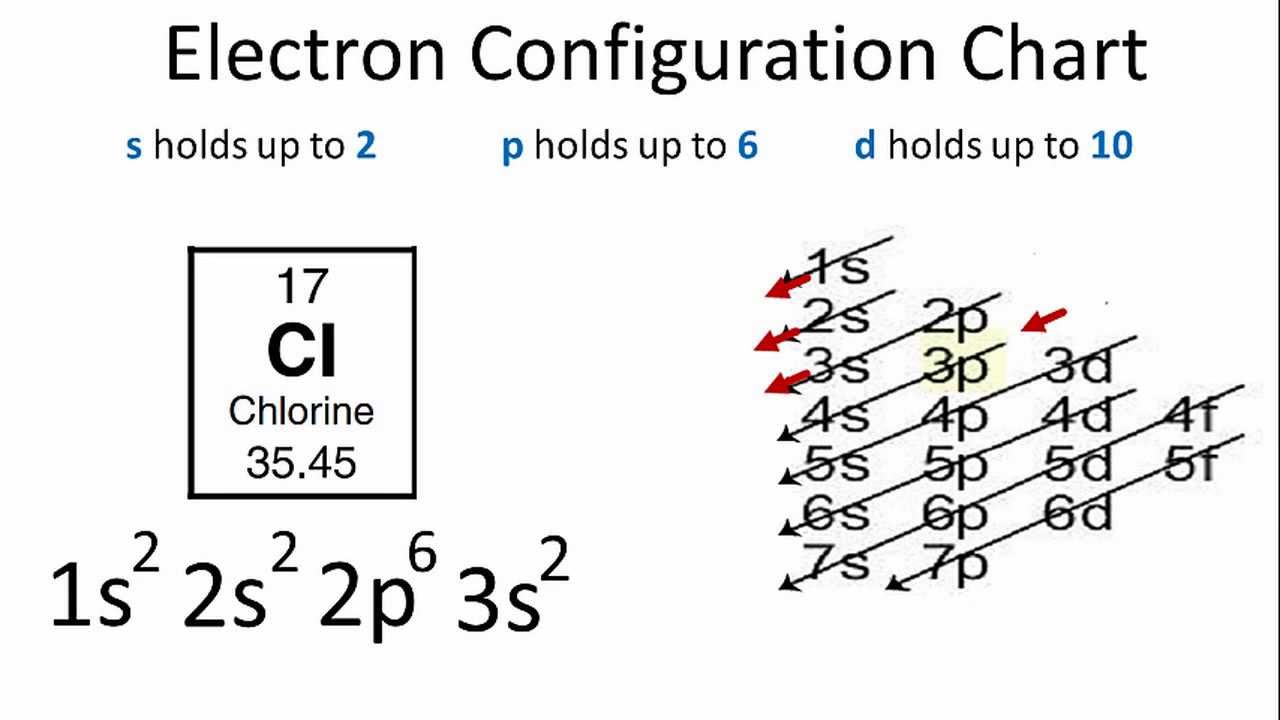
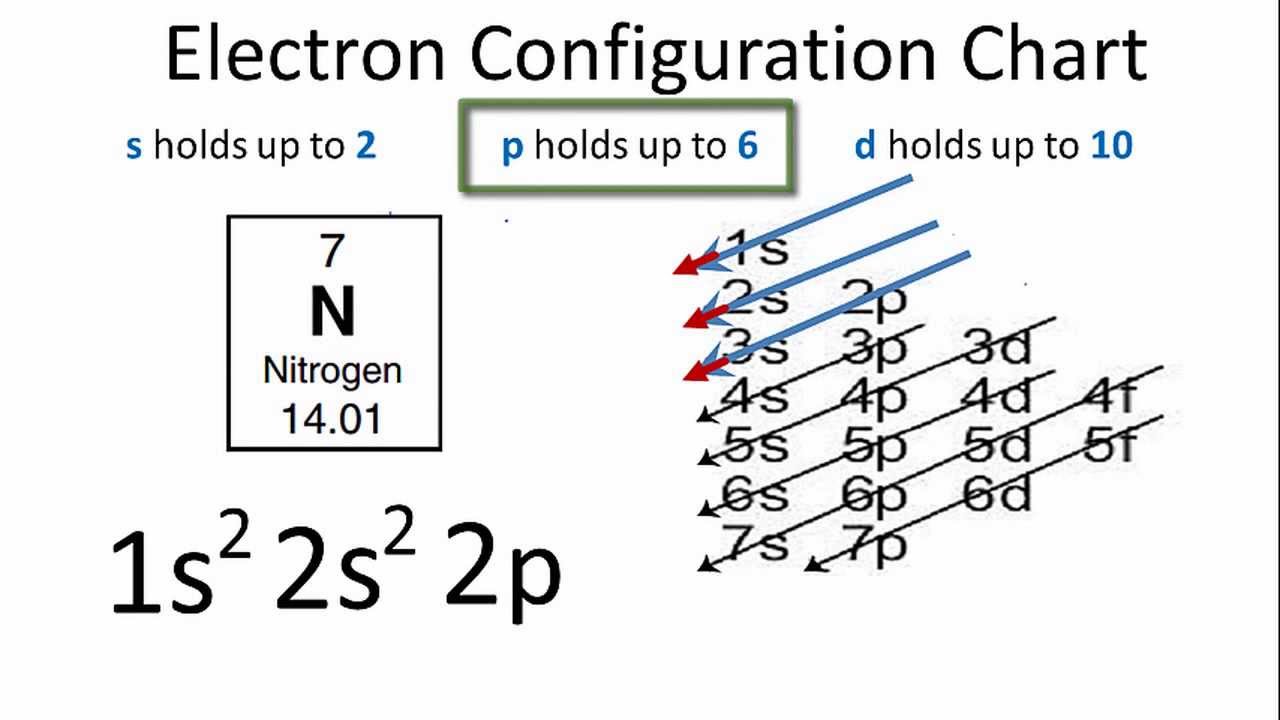
Nguyên tử nitrogen có tổng cộng 7 electron. Các electron này được sắp xếp vào các lớp và phân lớp theo nguyên lý Aufbau, theo đó các electron sẽ điền vào các orbital có năng lượng thấp trước tiên. Cấu hình electron đầy đủ của nitrogen là:
1s2 2s2 2p3
Điều này có nghĩa là:
- Lớp thứ nhất (n = 1): có 2 electron trong phân lớp 1s.
- Lớp thứ hai (n = 2): có 2 electron trong phân lớp 2s và 3 electron trong phân lớp 2p.
Trong trạng thái cơ bản, các electron trong phân lớp 2p của nitrogen sẽ chiếm ba orbital khác nhau, mỗi orbital có một electron có spin song song.
Cấu hình electron của ion Nitride (N3-)
Khi nitrogen nhận thêm 3 electron để tạo thành ion nitride (N3-), số lượng electron tổng cộng sẽ trở thành 10. Các electron bổ sung sẽ điền đầy vào phân lớp 2p, tạo ra một cấu hình electron bền vững giống với cấu hình của khí hiếm neon:
1s2 2s2 2p6
Điều này cho thấy rằng tất cả các orbital p trong lớp thứ hai đều đã đầy, làm cho ion N3- trở nên bền vững hơn.
Mối liên hệ giữa cấu hình electron và tính chất hóa học của Nitrogen
Cấu hình electron của nitrogen ảnh hưởng lớn đến các tính chất hóa học của nó. Với 5 electron ở lớp vỏ ngoài cùng (2s2 2p3), nitrogen có xu hướng nhận thêm 3 electron để đạt được cấu hình bền vững của khí hiếm. Điều này giải thích tại sao nitrogen thường có hóa trị 3 trong các hợp chất như amoniac (NH3) và các hợp chất nitride.
Ngoài ra, do có 3 electron độc thân trong các orbital p, nitrogen có khả năng tạo ra các liên kết cộng hóa trị mạnh, góp phần quan trọng trong cấu trúc của nhiều hợp chất hữu cơ và vô cơ.
Ứng dụng của Nitrogen trong đời sống
Nitrogen đóng vai trò quan trọng trong nhiều ngành công nghiệp, từ sản xuất phân bón, chất nổ, đến các quy trình hóa học trong phòng thí nghiệm. Ngoài ra, nitrogen cũng là thành phần chính của không khí, chiếm khoảng 78% thể tích khí quyển Trái Đất, và có vai trò quan trọng trong chu trình sinh học.
 3-" style="object-fit:cover; margin-right: 20px;" width="760px" height="428">
3-" style="object-fit:cover; margin-right: 20px;" width="760px" height="428">.png)
Tổng quan về Nitrogen (N)
Nitrogen, hay còn gọi là nitơ, là nguyên tố hóa học có ký hiệu là N và số hiệu nguyên tử là 7. Nitrogen thuộc nhóm VA trong bảng tuần hoàn, tức là nhóm nguyên tố phi kim. Với cấu hình electron là 1s22s22p3, nitrogen có 5 electron ở lớp vỏ ngoài cùng, điều này giúp nó có khả năng nhận thêm 3 electron để đạt cấu hình bền vững giống khí hiếm Neon. Điều này lý giải vì sao nitrogen thường có xu hướng tạo ra các hợp chất có hóa trị -3.
Nitrogen chiếm khoảng 78% thể tích của khí quyển Trái Đất, là thành phần thiết yếu trong sự sống và có vai trò quan trọng trong các quá trình sinh học. Trong cơ thể sống, nitrogen là thành phần của các axit amin và nucleic acid, hai hợp chất cơ bản cấu tạo nên protein và DNA.
Nitrogen tồn tại dưới nhiều dạng khác nhau, phổ biến nhất là dạng phân tử N2, một chất khí không màu, không mùi, không vị, và rất trơ về mặt hóa học ở nhiệt độ thường. Tuy nhiên, khi ở nhiệt độ cao hoặc trong các điều kiện đặc biệt, nitrogen có thể trở nên phản ứng mạnh và tạo ra nhiều hợp chất khác nhau như ammonia (NH3), oxit nitơ (NO, NO2), và acid nitric (HNO3).
Trong tự nhiên, nitrogen có hai đồng vị chính là 14N và 15N, trong đó 14N chiếm khoảng 99.63% tổng lượng nitrogen. Cơ thể con người chứa khoảng 3% nitrogen theo trọng lượng, chủ yếu tồn tại trong các phân tử sinh học như protein và DNA.
Cấu hình Electron của Nguyên Tử Nitrogen
Nguyên tử nitrogen (N) có số hiệu nguyên tử Z = 7, nghĩa là nó có 7 electron. Các electron này được phân bố vào các lớp và phân lớp electron theo nguyên tắc Aufbau, Hund và Pauli, tuân theo thứ tự năng lượng từ thấp đến cao.
Cấu hình electron đầy đủ của nguyên tử nitrogen ở trạng thái cơ bản là:
1s2 2s2 2p3
Điều này có nghĩa là:
- Lớp thứ nhất (n=1) có 2 electron trong phân lớp 1s.
- Lớp thứ hai (n=2) có 2 electron trong phân lớp 2s và 3 electron trong phân lớp 2p.
Với cấu hình này, nguyên tử nitrogen có 3 electron độc thân nằm trong các orbital p (2p3), điều này rất quan trọng vì nó ảnh hưởng đến tính chất hóa học của nitrogen.
Ngoài ra, nếu viết theo ký hiệu cấu hình electron rút gọn, sử dụng khí hiếm Helium (He) làm cơ sở, ta có thể biểu diễn cấu hình của nitrogen như sau:
[He] 2s2 2p3
Ở trạng thái kích thích, các electron có thể nhảy lên mức năng lượng cao hơn, nhưng cấu hình trên đại diện cho trạng thái năng lượng thấp nhất và ổn định nhất của nguyên tử nitrogen.
Nitrogen nằm ở chu kỳ 2, nhóm VA trong bảng tuần hoàn, và là một nguyên tố phi kim điển hình. Tính chất hóa học của nó phần lớn được quyết định bởi 3 electron độc thân trong lớp 2p, làm cho nitrogen có xu hướng nhận thêm 3 electron để đạt cấu hình electron bền vững như khí hiếm Neon (Ne).

Cấu hình Electron của Ion Nitride (N3-)
Ion Nitride (N3-) được hình thành khi nguyên tử nitrogen (N) nhận thêm 3 electron. Quá trình này giúp nitrogen đạt được cấu hình electron bền vững giống với cấu hình của khí hiếm neon (Ne).
Nguyên tử nitrogen có số hiệu nguyên tử là 7, vì vậy cấu hình electron của nó ở trạng thái cơ bản là:
1s2 2s2 2p3
Khi nitrogen nhận thêm 3 electron để tạo thành ion N3-, cấu hình electron mới của nó sẽ là:
1s2 2s2 2p6
Viết gọn lại, cấu hình này có thể được biểu diễn như sau:
\[ \text{N}^{3-}: \, [\text{Ne}] \]
Điều này cho thấy ion N3- có cấu hình electron tương tự như cấu hình electron của neon, một nguyên tố khí hiếm với lớp vỏ electron ngoài cùng đã đầy đủ. Nhờ vậy, ion N3- trở nên rất ổn định về mặt hóa học.

Mối Quan Hệ Giữa Cấu Hình Electron và Vị Trí trong Bảng Tuần Hoàn
Trong bảng tuần hoàn, mỗi nguyên tố được sắp xếp dựa trên cấu hình electron của nó, điều này quyết định vị trí và tính chất hóa học của nguyên tố đó. Đối với Nitrogen (N), với cấu hình electron là \(1s^2 2s^2 2p^3\), ta có thể suy ra các đặc điểm vị trí của nó như sau:
- Ô nguyên tố: Nitrogen nằm ở ô số 7 trong bảng tuần hoàn, điều này tương ứng với số electron và số proton trong nguyên tử Nitrogen.
- Chu kỳ: Nitrogen thuộc chu kỳ 2 vì nó có 2 lớp electron. Chu kỳ biểu thị số lượng lớp electron mà nguyên tử của nguyên tố đó có.
- Nhóm: Nitrogen thuộc nhóm VA (hay còn gọi là nhóm 15), do nó có 5 electron ở lớp ngoài cùng (\(2s^2 2p^3\)). Đây là nhóm các nguyên tố phi kim, có xu hướng nhận thêm electron để đạt cấu hình bền vững.
Từ cấu hình electron, ta có thể dự đoán một số tính chất hóa học cơ bản của Nitrogen:
- Tính phi kim: Với 5 electron ở lớp ngoài cùng và độ âm điện cao, Nitrogen có xu hướng nhận thêm 3 electron để đạt cấu hình bền vững của khí hiếm, biểu hiện tính phi kim mạnh.
- Khả năng tạo liên kết: Nitrogen có thể tạo liên kết cộng hóa trị bằng cách chia sẻ electron với các nguyên tố khác, thường là trong các hợp chất như \(NH_3\) và \(NO_2\).
Mối quan hệ giữa cấu hình electron và vị trí trong bảng tuần hoàn không chỉ giúp xác định tính chất của Nitrogen mà còn cung cấp cơ sở để so sánh với các nguyên tố khác trong cùng nhóm hoặc chu kỳ.

Tác Động của Cấu Hình Electron đến Tính Chất Hóa Học của Nitrogen
Cấu hình electron của một nguyên tố quyết định trực tiếp đến tính chất hóa học của nó. Đối với nitrogen (N), có số hiệu nguyên tử là 7, cấu hình electron ở trạng thái cơ bản là:
\[ 1s^2 2s^2 2p^3 \]
Cấu hình này chỉ ra rằng nitrogen có 5 electron ở lớp vỏ ngoài cùng (lớp 2), với 3 electron độc thân trong phân lớp 2p. Những electron này chính là nguyên nhân chính tạo ra tính chất hóa học đặc trưng của nitrogen.
1. Tính Chất Phi Kim
Nitrogen là một phi kim mạnh. Điều này được lý giải qua cấu hình electron với 5 electron ở lớp ngoài cùng. Để đạt được cấu hình bền vững của khí hiếm gần nhất (Neon), nitrogen có xu hướng nhận thêm 3 electron, tạo thành ion nitride (N3-). Do đó, trong các phản ứng hóa học, nitrogen thường thể hiện tính oxi hóa mạnh, đặc biệt khi phản ứng với các kim loại để tạo thành các hợp chất nitride.
2. Tính Oxi Hóa và Tính Khử
Ở điều kiện thường, phân tử nitrogen (N2) rất bền và khá trơ về mặt hóa học do liên kết ba giữa hai nguyên tử nitrogen rất mạnh. Tuy nhiên, trong những điều kiện thích hợp như nhiệt độ cao, nitrogen có thể tham gia phản ứng với hydrogen để tạo thành ammonia (NH3), thể hiện tính oxi hóa:
\[ N_2 (g) + 3H_2 (g) \rightarrow 2NH_3 (g) \]
Ngược lại, nitrogen cũng có thể thể hiện tính khử khi tác dụng với oxy, tạo ra nitơ oxit (NO):
\[ N_2 (g) + O_2 (g) \rightarrow 2NO (g) \]
3. Khả Năng Tạo Liên Kết Ba
Khả năng tạo liên kết ba trong phân tử N2 là một trong những đặc điểm nổi bật của nitrogen, làm cho nó trở nên bền vững và khó tham gia vào các phản ứng hóa học ở điều kiện thường. Điều này đồng thời giải thích tại sao nitrogen tồn tại ở dạng khí không màu, không mùi, và không vị trong khí quyển.
Tóm lại, cấu hình electron của nitrogen không chỉ quyết định vị trí của nó trong bảng tuần hoàn mà còn ảnh hưởng sâu sắc đến tính chất hóa học của nó, từ tính phi kim, khả năng oxi hóa và khử, đến sự bền vững của phân tử nitrogen trong tự nhiên.
XEM THÊM:
Ứng Dụng Của Nitrogen Trong Đời Sống
Nitrogen (N) đóng một vai trò quan trọng trong nhiều lĩnh vực của đời sống, từ công nghiệp, y tế cho đến nông nghiệp. Dưới đây là một số ứng dụng tiêu biểu của nitrogen trong đời sống hàng ngày:
Sản Xuất Phân Bón và Hóa Chất
Nitrogen là thành phần chính trong sản xuất phân đạm, một loại phân bón quan trọng giúp cải thiện năng suất cây trồng. Phân đạm cung cấp nguồn nitrogen cần thiết cho cây phát triển, đặc biệt là trong quá trình tổng hợp protein và axit nucleic.
Ngoài ra, nitrogen còn được sử dụng trong sản xuất nhiều loại hóa chất công nghiệp khác như amoniac (NH3), một chất trung gian quan trọng trong nhiều quá trình hóa học.
Sử Dụng Nitrogen Trong Công Nghiệp
- Bảo quản thực phẩm: Khí nitrogen, nhờ tính trơ hóa học, được sử dụng để đóng gói thực phẩm nhằm ngăn chặn quá trình oxy hóa, giữ cho thực phẩm tươi lâu hơn.
- Luyện kim: Nitrogen được sử dụng để tạo môi trường khí trơ trong quá trình luyện kim, giúp bảo vệ kim loại khỏi oxy hóa và nâng cao độ cứng của bề mặt sản phẩm.
- Sản xuất kính và nhựa: Nitrogen lỏng được sử dụng trong quá trình sản xuất kính và nhựa, giúp cải thiện chất lượng và độ bền của sản phẩm.
Vai Trò của Nitrogen Trong Y Tế
Trong y học, nitrogen được sử dụng trong nhiều ứng dụng khác nhau:
- Bảo quản sinh học: Nitrogen lỏng được dùng để bảo quản các mẫu sinh học như máu, trứng, và tinh trùng ở nhiệt độ rất thấp, giúp duy trì chất lượng và tính khả dụng của chúng trong thời gian dài.
- Điều trị da liễu: Nitrogen lỏng còn được sử dụng trong điều trị một số bệnh da liễu như loại bỏ mụn cóc, mụn nhọt bằng phương pháp áp lạnh.
Sử Dụng Nitrogen Trong Các Ứng Dụng Khác
- Bơm lốp xe: Nitrogen được sử dụng để bơm lốp xe ô tô và máy bay, giúp duy trì áp suất lốp ổn định hơn so với không khí thông thường.
- Làm mát linh kiện điện tử: Nitrogen lỏng được sử dụng để làm mát các bộ phận máy tính như CPU, giúp tăng hiệu suất và tuổi thọ của thiết bị.