Chủ đề sulfur electron configuration: Cấu hình electron của lưu huỳnh là nền tảng để hiểu rõ tính chất hóa học và vai trò quan trọng của nguyên tố này trong tự nhiên và công nghiệp. Bài viết này sẽ giúp bạn nắm vững cách các electron được sắp xếp trong nguyên tử lưu huỳnh và tại sao điều này lại quan trọng trong nhiều lĩnh vực khác nhau.
Mục lục
Cấu hình electron của lưu huỳnh
Lưu huỳnh là một nguyên tố hóa học trong bảng tuần hoàn, có ký hiệu là S và số nguyên tử là 16. Cấu hình electron của lưu huỳnh giúp hiểu rõ hơn về cách các electron được phân bố trong các lớp và phân lớp xung quanh hạt nhân của nguyên tử lưu huỳnh.
Cấu hình electron của lưu huỳnh
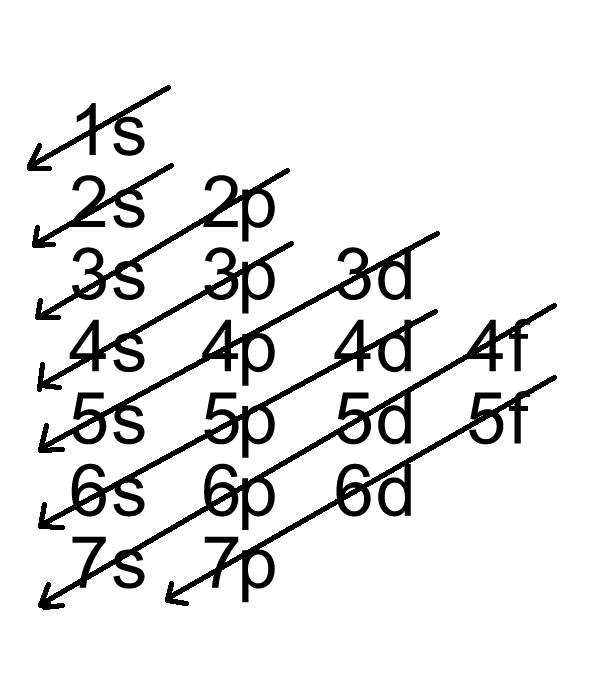
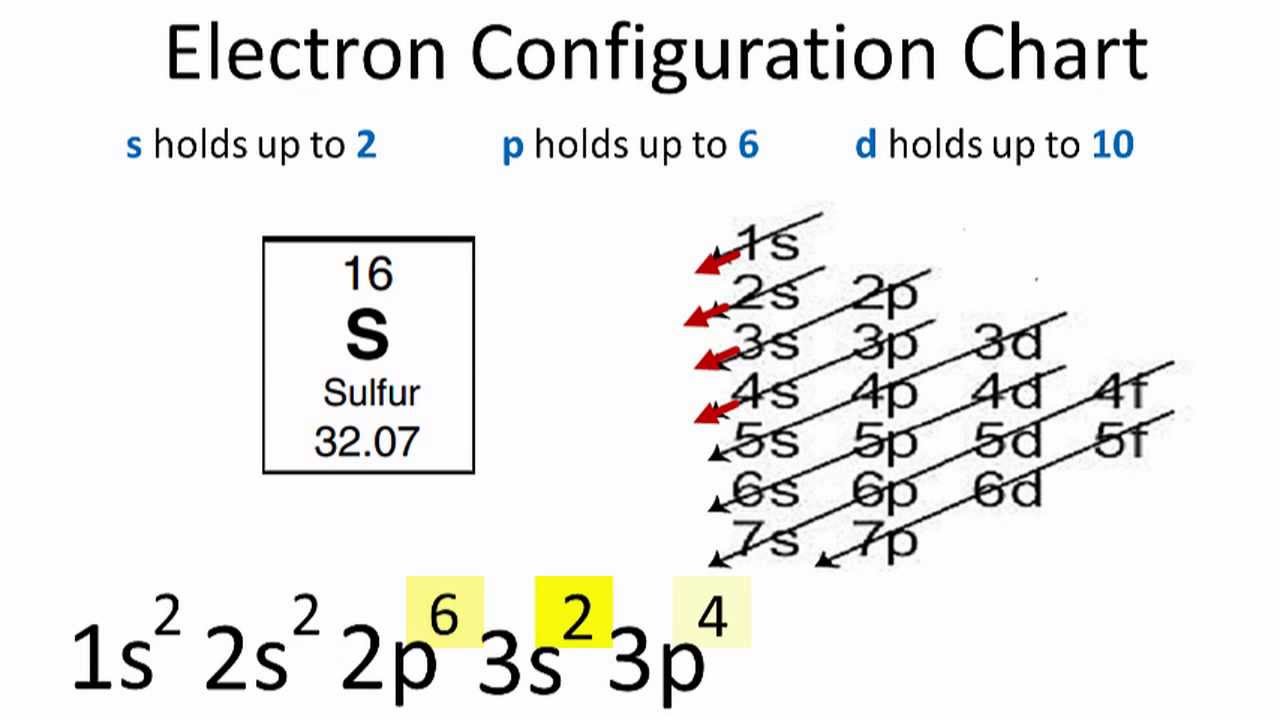
Cấu hình electron của lưu huỳnh ở trạng thái cơ bản là:
\[1s^2 \, 2s^2 \, 2p^6 \, 3s^2 \, 3p^4\]
Giải thích cấu hình electron
Cấu hình này cho thấy:
- Lớp 1: Có 2 electron trong phân lớp 1s.
- Lớp 2: Có 2 electron trong phân lớp 2s và 6 electron trong phân lớp 2p, tổng cộng 8 electron.
- Lớp 3: Có 2 electron trong phân lớp 3s và 4 electron trong phân lớp 3p, tổng cộng 6 electron.
Do đó, lưu huỳnh có tổng cộng 16 electron, được phân bố theo cấu hình electron trên.
Ứng dụng của việc hiểu cấu hình electron của lưu huỳnh
- Hóa học: Giúp dự đoán cách lưu huỳnh tham gia vào các phản ứng hóa học, ví dụ như tạo liên kết với các nguyên tố khác.
- Vật liệu: Cấu hình electron giúp giải thích tính chất dẫn điện, nhiệt của các hợp chất chứa lưu huỳnh.
- Sinh học: Lưu huỳnh là thành phần quan trọng trong các axit amin và protein, việc hiểu cấu hình electron có thể giúp giải thích vai trò của lưu huỳnh trong sinh học.
Cấu hình electron là một phần quan trọng trong việc nghiên cứu và ứng dụng khoa học về lưu huỳnh, giúp chúng ta hiểu rõ hơn về tính chất hóa học và vật lý của nguyên tố này.
.png)
Giới thiệu về lưu huỳnh
Lưu huỳnh là một nguyên tố hóa học có ký hiệu là S và số nguyên tử là 16. Đây là một nguyên tố phi kim phổ biến, tồn tại trong tự nhiên dưới nhiều dạng, chủ yếu là lưu huỳnh tự do hoặc trong các hợp chất như sunfua và sunfat.
Lưu huỳnh có vai trò quan trọng trong nhiều lĩnh vực, từ công nghiệp đến sinh học. Một số đặc điểm nổi bật của lưu huỳnh bao gồm:
- Màu sắc: Lưu huỳnh có màu vàng nhạt đặc trưng.
- Tính chất vật lý: Lưu huỳnh ở trạng thái rắn, có độ giòn cao và không tan trong nước.
- Tính chất hóa học: Lưu huỳnh là một phi kim mạnh, có khả năng tạo ra nhiều hợp chất quan trọng với cả kim loại và phi kim khác.
Trong tự nhiên, lưu huỳnh được tìm thấy nhiều trong các khoáng chất, núi lửa và suối nước nóng. Ngoài ra, lưu huỳnh còn có vai trò quan trọng trong sự sống, là thành phần cấu tạo của các axit amin thiết yếu như cysteine và methionine.
Cấu hình electron của lưu huỳnh là \[1s^2 \, 2s^2 \, 2p^6 \, 3s^2 \, 3p^4\], giải thích cách các electron được phân bố trong các lớp xung quanh hạt nhân. Điều này giúp hiểu rõ hơn về cách lưu huỳnh tham gia vào các phản ứng hóa học và các quá trình sinh học quan trọng.
Tính chất hóa học của lưu huỳnh
Lưu huỳnh là một nguyên tố phi kim hoạt động mạnh, có nhiều tính chất hóa học đặc trưng. Nhờ cấu hình electron \[1s^2 \, 2s^2 \, 2p^6 \, 3s^2 \, 3p^4\], lưu huỳnh có khả năng tham gia vào nhiều loại phản ứng hóa học khác nhau, thể hiện cả tính oxy hóa lẫn tính khử.
Tính chất oxy hóa
Trong nhiều phản ứng, lưu huỳnh đóng vai trò là chất oxy hóa, có khả năng nhận thêm 2 electron để đạt cấu hình bền vững như khí hiếm argon. Ví dụ:
- Phản ứng với kim loại: Lưu huỳnh phản ứng với nhiều kim loại để tạo thành sunfua kim loại. Ví dụ, khi phản ứng với natri, phản ứng tạo ra natri sunfua (\(Na_2S\)) theo phương trình: \[ 2Na + S \rightarrow Na_2S \]
- Phản ứng với hydro: Lưu huỳnh phản ứng với hydro để tạo thành khí hydro sunfua (\(H_2S\)): \[ H_2 + S \rightarrow H_2S \]
Tính chất khử
Lưu huỳnh cũng thể hiện tính khử trong một số phản ứng, đặc biệt là khi nó phản ứng với các chất có tính oxy hóa mạnh. Ví dụ:
- Phản ứng với axit nitric: Lưu huỳnh bị oxy hóa thành axit sunfuric (\(H_2SO_4\)) khi phản ứng với axit nitric (\(HNO_3\)): \[ S + 6HNO_3 \rightarrow H_2SO_4 + 6NO_2 + 2H_2O \]
Phản ứng đặc trưng khác của lưu huỳnh
- Phản ứng với oxi: Lưu huỳnh dễ dàng cháy trong không khí, tạo ra lưu huỳnh đioxit (\(SO_2\)): \[ S + O_2 \rightarrow SO_2 \] Khí \(SO_2\) có thể bị oxy hóa tiếp tục để tạo ra lưu huỳnh trioxit (\(SO_3\)), tiền chất của axit sunfuric: \[ 2SO_2 + O_2 \rightarrow 2SO_3 \]
Những tính chất hóa học đặc trưng này của lưu huỳnh giúp nó trở thành một nguyên tố quan trọng trong nhiều ngành công nghiệp, từ sản xuất hóa chất, phân bón đến các ứng dụng y học và môi trường.

Vai trò và ứng dụng của lưu huỳnh
Lưu huỳnh là một nguyên tố quan trọng với nhiều ứng dụng trong các lĩnh vực khác nhau. Nhờ cấu hình electron \[1s^2 \, 2s^2 \, 2p^6 \, 3s^2 \, 3p^4\], lưu huỳnh có khả năng tạo ra nhiều hợp chất hữu ích, góp phần quan trọng trong công nghiệp, nông nghiệp, y học và sinh học.
1. Vai trò trong sinh học
Lưu huỳnh là một thành phần thiết yếu trong cấu trúc của các axit amin như cysteine và methionine, từ đó tham gia vào việc cấu thành protein. Điều này làm cho lưu huỳnh trở nên cần thiết cho sự sống, ảnh hưởng đến quá trình phát triển và chức năng của các tế bào.
- Hệ thống enzyme: Nhiều enzyme quan trọng chứa lưu huỳnh, giúp xúc tác các phản ứng sinh hóa trong cơ thể.
- Sự hình thành keratin: Lưu huỳnh là thành phần của keratin, protein chính trong tóc, da và móng.
2. Ứng dụng trong công nghiệp
Lưu huỳnh được sử dụng rộng rãi trong nhiều ngành công nghiệp nhờ khả năng tạo thành các hợp chất hữu ích.
- Sản xuất axit sunfuric: Axit sunfuric (\(H_2SO_4\)) là một trong những hóa chất công nghiệp quan trọng nhất, được sản xuất chủ yếu từ lưu huỳnh. Axit này được sử dụng rộng rãi trong sản xuất phân bón, xử lý nước, và trong nhiều quy trình hóa học khác.
- Cao su lưu hóa: Lưu huỳnh được sử dụng trong quá trình lưu hóa cao su, giúp cải thiện độ bền và độ đàn hồi của sản phẩm cao su.
- Sản xuất thuốc nổ: Lưu huỳnh là thành phần trong sản xuất thuốc nổ như thuốc súng, nơi nó hoạt động như một chất oxy hóa để tạo ra các phản ứng nổ mạnh mẽ.
3. Ứng dụng trong nông nghiệp
Lưu huỳnh là một nguyên tố dinh dưỡng cần thiết cho cây trồng, đóng vai trò quan trọng trong quá trình tổng hợp protein và enzyme.
- Phân bón: Các loại phân bón chứa lưu huỳnh được sử dụng để bổ sung dinh dưỡng cho cây trồng, giúp cải thiện năng suất và chất lượng nông sản.
- Thuốc bảo vệ thực vật: Lưu huỳnh cũng được sử dụng trong các sản phẩm thuốc bảo vệ thực vật để kiểm soát sâu bệnh và nấm hại.
4. Ứng dụng trong y học
Lưu huỳnh được sử dụng trong nhiều sản phẩm y tế và dược phẩm, đặc biệt là trong các loại thuốc điều trị các bệnh về da.
- Điều trị mụn trứng cá: Lưu huỳnh có tính chất kháng khuẩn và kháng viêm, giúp điều trị mụn trứng cá và các vấn đề da liễu khác.
- Điều trị các bệnh về da: Các loại kem và thuốc mỡ chứa lưu huỳnh được sử dụng để điều trị các bệnh về da như eczema và bệnh vẩy nến.
Tóm lại, lưu huỳnh đóng một vai trò quan trọng và có ứng dụng rộng rãi trong nhiều lĩnh vực khác nhau, từ sinh học đến công nghiệp, nông nghiệp và y học. Những đặc điểm hóa học đặc trưng của lưu huỳnh đã tạo nên giá trị to lớn của nguyên tố này trong cuộc sống hàng ngày.

Phản ứng hóa học liên quan đến cấu hình electron của lưu huỳnh
Cấu hình electron của lưu huỳnh \([1s^2 \, 2s^2 \, 2p^6 \, 3s^2 \, 3p^4]\) đóng vai trò quan trọng trong việc xác định cách thức lưu huỳnh tham gia vào các phản ứng hóa học. Với 6 electron ở lớp vỏ ngoài cùng, lưu huỳnh có khả năng nhận thêm 2 electron để đạt cấu hình bền vững như khí hiếm, hoặc chia sẻ electron với các nguyên tố khác. Dưới đây là một số phản ứng hóa học quan trọng liên quan đến cấu hình electron của lưu huỳnh.
1. Phản ứng với kim loại
Khi phản ứng với kim loại, lưu huỳnh thường nhận 2 electron từ kim loại để tạo thành ion sunfua \((S^{2-})\). Ví dụ:
- Phản ứng với natri: Lưu huỳnh phản ứng với natri để tạo thành natri sunfua: \[ 2Na + S \rightarrow Na_2S \]
- Phản ứng với kẽm: Lưu huỳnh cũng phản ứng với kẽm để tạo thành kẽm sunfua: \[ Zn + S \rightarrow ZnS \]
2. Phản ứng với hydro
Lưu huỳnh có khả năng phản ứng với hydro để tạo thành khí hydro sunfua \((H_2S)\). Trong phản ứng này, lưu huỳnh chia sẻ electron với hydro:
- Phản ứng trực tiếp: Khi lưu huỳnh được nung nóng với hydro, phản ứng tạo ra khí \(H_2S\): \[ H_2 + S \rightarrow H_2S \]
3. Phản ứng với oxy
Khi đốt cháy trong không khí, lưu huỳnh phản ứng với oxy để tạo ra lưu huỳnh đioxit \((SO_2)\). Lưu huỳnh đóng vai trò là chất khử, mất electron trong quá trình này:
- Phản ứng cháy: Lưu huỳnh cháy trong không khí tạo ra \(SO_2\): \[ S + O_2 \rightarrow SO_2 \] \[SO_2\] có thể tiếp tục bị oxy hóa thành lưu huỳnh trioxit \((SO_3)\) trong điều kiện nhiệt độ và xúc tác phù hợp: \[ 2SO_2 + O_2 \rightarrow 2SO_3 \]
4. Phản ứng oxy hóa - khử
Lưu huỳnh tham gia nhiều phản ứng oxy hóa - khử, nhờ khả năng thay đổi số oxy hóa. Ví dụ:
- Phản ứng với axit nitric: Khi phản ứng với axit nitric đậm đặc, lưu huỳnh bị oxy hóa thành axit sunfuric: \[ S + 6HNO_3 \rightarrow H_2SO_4 + 6NO_2 + 2H_2O \]
Những phản ứng hóa học này minh họa cách cấu hình electron của lưu huỳnh ảnh hưởng đến vai trò của nó trong các phản ứng, đồng thời thể hiện sự đa dạng và tầm quan trọng của lưu huỳnh trong hóa học và công nghiệp.

So sánh cấu hình electron của lưu huỳnh với các nguyên tố khác
Cấu hình electron của lưu huỳnh là \([1s^2 \, 2s^2 \, 2p^6 \, 3s^2 \, 3p^4]\), với tổng số 16 electron. Lưu huỳnh nằm ở chu kỳ 3, nhóm 16 trong bảng tuần hoàn, thuộc nhóm chalcogen. Dưới đây là sự so sánh cấu hình electron của lưu huỳnh với một số nguyên tố khác trong cùng nhóm và các nguyên tố lân cận.
1. So sánh với nguyên tố oxy
Oxy (\(O\)) có cấu hình electron là \([1s^2 \, 2s^2 \, 2p^4]\), với tổng số 8 electron. Oxy và lưu huỳnh đều có 6 electron ở lớp vỏ ngoài cùng, điều này giúp chúng có tính chất hóa học tương tự nhau, như khả năng tạo thành hợp chất với kim loại và phi kim.
- Khác biệt về kích thước nguyên tử: Kích thước nguyên tử của lưu huỳnh lớn hơn oxy, dẫn đến năng lượng ion hóa của lưu huỳnh thấp hơn, dễ dàng mất electron hoặc tham gia vào các phản ứng hóa học hơn.
- Tính oxy hóa: Oxy có tính oxy hóa mạnh hơn lưu huỳnh do độ âm điện cao hơn và cấu trúc nguyên tử nhỏ hơn.
2. So sánh với nguyên tố selen
Selen (\(Se\)) có cấu hình electron là \([1s^2 \, 2s^2 \, 2p^6 \, 3s^2 \, 3p^6 \, 4s^2 \, 3d^{10} \, 4p^4]\), với tổng số 34 electron. Cả lưu huỳnh và selen đều thuộc nhóm chalcogen, và có cấu hình electron tương tự với 6 electron ở lớp ngoài cùng.
- Khác biệt về độ âm điện: Selen có độ âm điện thấp hơn lưu huỳnh, khiến selen kém hoạt động hơn trong các phản ứng hóa học.
- Tính chất hóa học: Mặc dù có sự tương đồng về cấu hình electron, selen có xu hướng hình thành các hợp chất khác biệt so với lưu huỳnh, đặc biệt là trong hóa học hữu cơ và hóa học vô cơ.
3. So sánh với nguyên tố photpho
Photpho (\(P\)) có cấu hình electron là \([1s^2 \, 2s^2 \, 2p^6 \, 3s^2 \, 3p^3]\), với tổng số 15 electron. Mặc dù nằm gần lưu huỳnh trong bảng tuần hoàn, photpho thuộc nhóm 15 và có 5 electron ở lớp vỏ ngoài cùng.
- Tính chất hóa học: Photpho có xu hướng chia sẻ hoặc nhận electron để đạt cấu hình bền vững, nhưng khác với lưu huỳnh, photpho không có xu hướng nhận 2 electron để tạo thành anion như lưu huỳnh.
- Phản ứng với kim loại: Photpho thường tạo hợp chất với kim loại với tỷ lệ khác so với lưu huỳnh, như trong \(PCl_5\) so với \(SCl_2\).
Tóm lại, cấu hình electron của lưu huỳnh, khi so sánh với các nguyên tố khác, cho thấy sự tương đồng với các nguyên tố cùng nhóm nhưng cũng thể hiện những khác biệt quan trọng với các nguyên tố ở các nhóm khác. Điều này giải thích phần lớn các tính chất hóa học và vật lý đặc trưng của lưu huỳnh.