Chủ đề cobalt electron configuration: Cobalt electron configuration là một chủ đề quan trọng trong hóa học, giúp hiểu rõ cấu trúc nguyên tử và tính chất hóa học của nguyên tố Cobalt. Bài viết này sẽ cung cấp một cái nhìn toàn diện về cấu hình electron của Cobalt, từ cơ bản đến ứng dụng thực tiễn trong công nghiệp và khoa học.
Mục lục
Cấu hình electron của nguyên tố Cobalt
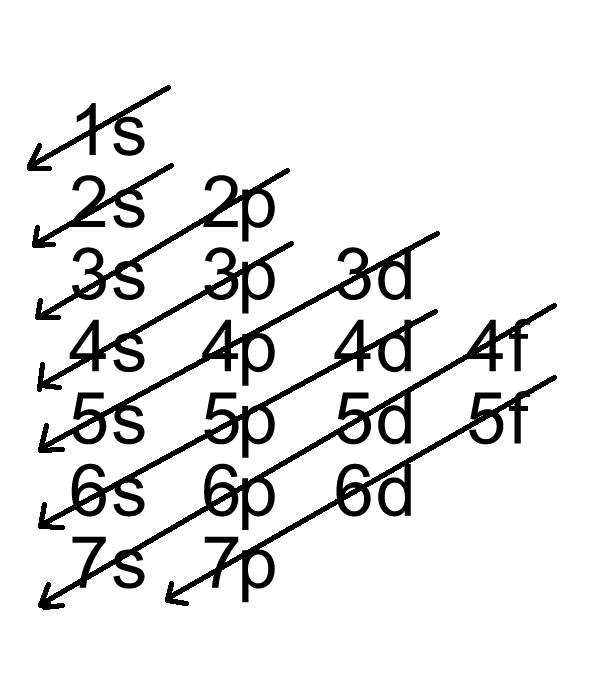
Cấu hình electron của nguyên tố Cobalt (Co) là một chủ đề trong hóa học, đặc biệt là hóa học vô cơ. Cobalt là nguyên tố thứ 27 trong bảng tuần hoàn và thuộc nhóm kim loại chuyển tiếp.
Thông tin chung về Cobalt
- Ký hiệu hóa học: Co
- Số nguyên tử: 27
- Khối lượng nguyên tử: 58.933 g/mol
- Nhóm: 9 (Kim loại chuyển tiếp)
Cấu hình electron của Cobalt
Cấu hình electron của Cobalt được viết như sau:
\[ \text{Co}: 1s^2 2s^2 2p^6 3s^2 3p^6 3d^7 4s^2 \]
Hoặc có thể viết ngắn gọn bằng cách sử dụng cấu hình electron của khí hiếm Argon (Ar):
\[ \text{Co}: [\text{Ar}] 3d^7 4s^2 \]
Trong đó:
- Orbital 1s, 2s, 2p, 3s, 3p, 3d là các orbital của các lớp vỏ bên trong, đã được lấp đầy bởi các electron.
- Orbital 4s chứa 2 electron, nằm ở lớp vỏ ngoài cùng.
Tính chất hóa học liên quan đến cấu hình electron
Cobalt có tính chất hóa học đặc trưng của kim loại chuyển tiếp, bao gồm:
- Có nhiều trạng thái oxy hóa, phổ biến nhất là +2 và +3.
- Tạo thành các hợp chất phức với nhiều màu sắc khác nhau.
- Ứng dụng trong các hợp kim, pin, và xúc tác công nghiệp.
Ứng dụng của Cobalt
Cobalt là một nguyên tố quan trọng trong nhiều lĩnh vực như:
- Sản xuất hợp kim siêu bền, chịu nhiệt.
- Pin sạc, đặc biệt là pin lithium-ion.
- Chất xúc tác trong ngành hóa dầu.
Kết luận
Cấu hình electron của Cobalt không chỉ cung cấp thông tin về cấu trúc nguyên tử mà còn giúp hiểu rõ hơn về tính chất hóa học và ứng dụng của nguyên tố này trong cuộc sống và công nghiệp.

.png)
Giới Thiệu Về Nguyên Tố Cobalt
Cobalt (Co) là một nguyên tố hóa học thuộc nhóm kim loại chuyển tiếp trong bảng tuần hoàn, có số nguyên tử là 27 và khối lượng nguyên tử khoảng 58.933 g/mol. Cobalt nổi bật nhờ vào khả năng từ tính và tính chất hóa học đa dạng của nó. Đây là một kim loại quan trọng được sử dụng rộng rãi trong nhiều ngành công nghiệp và khoa học.
- Lịch sử và phát hiện: Cobalt đã được con người biết đến và sử dụng từ thời cổ đại, chủ yếu để tạo ra màu xanh cobalt trong gốm sứ và thủy tinh. Tuy nhiên, phải đến thế kỷ 18, nhà hóa học Georg Brandt mới chính thức xác định được Cobalt là một nguyên tố hóa học riêng biệt.
- Tính chất vật lý: Cobalt có màu trắng xám, ánh kim, cứng và dễ uốn. Nó có từ tính mạnh, đặc biệt là ở nhiệt độ phòng, và chỉ số Curie (nhiệt độ mà tại đó nó mất đi từ tính) của nó là khoảng 1,115 °C.
- Tính chất hóa học: Cobalt có tính chất hóa học tương tự như sắt và niken, thường tạo ra các hợp chất có trạng thái oxy hóa +2 và +3. Cobalt ít bị oxy hóa trong không khí ở nhiệt độ phòng, nhưng nó có thể bị ăn mòn khi tiếp xúc với các axit mạnh.
- Ứng dụng: Cobalt được sử dụng rộng rãi trong sản xuất pin lithium-ion, hợp kim siêu bền, và làm chất xúc tác trong các quá trình hóa học. Nó cũng đóng vai trò quan trọng trong ngành y học, đặc biệt là trong việc điều trị ung thư bằng các hợp chất cobalt phóng xạ.
Cấu Hình Electron Của Cobalt
Cấu hình electron của một nguyên tố là cách sắp xếp các electron xung quanh hạt nhân nguyên tử trong các orbital. Đối với nguyên tố Cobalt (Co), việc xác định cấu hình electron là điều cần thiết để hiểu rõ tính chất hóa học và vật lý của nó.
- Số nguyên tử: Cobalt có số nguyên tử là 27, nghĩa là một nguyên tử Cobalt có 27 proton trong hạt nhân và 27 electron sắp xếp quanh hạt nhân.
- Cấu hình electron cơ bản: Cấu hình electron đầy đủ của Cobalt được viết như sau: \[ \text{Co}: 1s^2 2s^2 2p^6 3s^2 3p^6 3d^7 4s^2 \] Trong cấu hình này, các electron được phân bố vào các lớp và phân lớp theo thứ tự năng lượng tăng dần.
- Cấu hình electron rút gọn: Để đơn giản hóa, cấu hình electron của Cobalt có thể được viết rút gọn bằng cách sử dụng khí hiếm Argon (Ar) làm nền tảng: \[ \text{Co}: [\text{Ar}] 3d^7 4s^2 \] Cách viết này chỉ ra rằng cấu hình electron của Cobalt bao gồm cấu hình electron của Argon cộng với 7 electron trong phân lớp \(3d\) và 2 electron trong phân lớp \(4s\).
- Giải thích: Cobalt có 2 electron trong phân lớp \(4s\) và 7 electron trong phân lớp \(3d\). Đây là một đặc điểm của các nguyên tố kim loại chuyển tiếp, nơi các electron \(d\) có vai trò quan trọng trong tính chất hóa học và vật lý của nguyên tố.
- Tính chất liên quan: Cấu hình electron của Cobalt cho phép nó tham gia vào nhiều phản ứng hóa học khác nhau, tạo ra các trạng thái oxy hóa phổ biến như +2 và +3, điều này rất quan trọng trong việc hình thành các hợp chất cobalt.

Tính Chất Hóa Học Liên Quan Đến Cấu Hình Electron
Cấu hình electron của nguyên tố Cobalt (Co) đóng vai trò quan trọng trong việc quyết định các tính chất hóa học đặc trưng của nó. Cobalt, với cấu hình electron \([ \text{Ar} ] 3d^7 4s^2\), thể hiện nhiều tính chất hóa học đáng chú ý, đặc biệt trong các phản ứng oxy hóa khử và sự hình thành các phức chất.
- Trạng thái oxy hóa: Cobalt có thể tồn tại ở nhiều trạng thái oxy hóa khác nhau, phổ biến nhất là +2 và +3. Điều này là do khả năng mất các electron từ các phân lớp \(3d\) và \(4s\) để tạo ra các ion như \(\text{Co}^{2+}\) và \(\text{Co}^{3+}\).
- \(\text{Co}^{2+}\): Đây là trạng thái oxy hóa phổ biến nhất của Cobalt, thường gặp trong các hợp chất như \(\text{CoCl}_2\) và \(\text{CoSO}_4\). Trong trạng thái này, Cobalt mất 2 electron từ phân lớp \(4s\).
- \(\text{Co}^{3+}\): Trạng thái này ít phổ biến hơn, nhưng vẫn quan trọng, đặc biệt trong các phức chất như \([\text{Co}(\text{NH}_3)_6]^{3+}\). Trong trạng thái này, Cobalt mất thêm 1 electron từ phân lớp \(3d\), ngoài 2 electron từ phân lớp \(4s\).
- Phức chất và khả năng tạo phức: Do có cấu hình electron dọc theo các phân lớp \(3d\) và \(4s\), Cobalt dễ dàng tạo ra các phức chất với nhiều loại ligand khác nhau. Các phức chất của Cobalt thường có màu sắc rực rỡ, chẳng hạn như phức chất \([\text{CoCl}_4]^{2-}\) có màu xanh dương và \([\text{Co}(\text{NH}_3)_6]^{3+}\) có màu vàng cam.
- Đặc tính từ tính: Cobalt là một kim loại có từ tính mạnh, điều này chủ yếu liên quan đến các electron chưa ghép đôi trong phân lớp \(3d\). Cấu hình electron của nó làm cho Cobalt trở thành một trong những vật liệu có từ tính tự nhiên mạnh nhất, thường được sử dụng trong sản xuất nam châm và các ứng dụng công nghiệp liên quan đến từ tính.
- Phản ứng với các chất hóa học khác: Cobalt phản ứng với nhiều chất hóa học khác, chẳng hạn như axit và kiềm. Trong môi trường axit, Cobalt thường bị oxy hóa thành \(\text{Co}^{2+}\), trong khi trong các điều kiện oxy hóa mạnh, nó có thể bị oxy hóa thành \(\text{Co}^{3+}\).
Nhờ vào cấu hình electron đặc trưng, Cobalt thể hiện những tính chất hóa học đa dạng và quan trọng, làm cho nó trở thành một nguyên tố thiết yếu trong nhiều ngành công nghiệp và ứng dụng khoa học.

Ứng Dụng Của Cobalt Trong Thực Tiễn
Cobalt là một nguyên tố có nhiều ứng dụng quan trọng trong các ngành công nghiệp, công nghệ và y học nhờ vào những tính chất vật lý và hóa học đặc trưng của nó. Các ứng dụng của Cobalt có thể được thấy rõ trong những lĩnh vực sau:
- Sản xuất pin: Cobalt là thành phần chính trong các loại pin lithium-ion, được sử dụng rộng rãi trong các thiết bị điện tử như điện thoại di động, máy tính xách tay, và xe điện. Cấu trúc ổn định của các hợp chất Cobalt giúp tăng cường hiệu suất và tuổi thọ của pin.
- Hợp kim siêu bền: Cobalt được sử dụng để tạo ra các hợp kim chịu nhiệt và chống ăn mòn, chẳng hạn như các hợp kim Cobalt-chrome, được sử dụng trong sản xuất động cơ phản lực, tuabin khí và các bộ phận quan trọng trong ngành hàng không vũ trụ. Những hợp kim này có khả năng chịu được nhiệt độ cao và môi trường khắc nghiệt.
- Xúc tác trong công nghiệp hóa dầu: Các hợp chất của Cobalt được sử dụng làm chất xúc tác trong các quá trình lọc dầu và sản xuất các hợp chất hữu cơ quan trọng. Cobalt giúp đẩy nhanh các phản ứng hóa học và cải thiện hiệu quả sản xuất, đặc biệt là trong các quá trình hydro hóa.
- Ngành y tế: Cobalt-60, một đồng vị phóng xạ của Cobalt, được sử dụng trong liệu pháp xạ trị để điều trị ung thư. Bức xạ từ Cobalt-60 có thể tiêu diệt tế bào ung thư và giúp kiểm soát sự phát triển của khối u. Ngoài ra, Cobalt cũng được sử dụng trong sản xuất các thiết bị y tế, như chân tay giả và các bộ phận cấy ghép.
- Sản xuất nam châm: Cobalt là thành phần chính trong các nam châm vĩnh cửu, đặc biệt là nam châm Alnico (hợp kim của nhôm, niken, và cobalt). Những nam châm này có độ bền cao và từ tính mạnh, được sử dụng trong nhiều thiết bị điện tử, máy phát điện và động cơ.
Nhờ vào những tính chất độc đáo và khả năng ứng dụng rộng rãi, Cobalt đóng vai trò không thể thiếu trong nhiều lĩnh vực, từ công nghệ cao đến y học và công nghiệp nặng.

Kết Luận
Cobalt, với cấu hình electron đặc trưng \([ \text{Ar} ] 3d^7 4s^2\), không chỉ thể hiện những tính chất hóa học độc đáo mà còn đóng vai trò quan trọng trong nhiều lĩnh vực công nghiệp và y học. Từ việc là một thành phần không thể thiếu trong sản xuất pin lithium-ion, hợp kim siêu bền, đến việc trở thành chất xúc tác trong công nghiệp hóa dầu và liệu pháp xạ trị trong y học, Cobalt đã chứng minh được giá trị to lớn của mình.
Những ứng dụng thực tiễn của Cobalt phản ánh rõ rệt tầm quan trọng của nó trong cuộc sống hàng ngày, đặc biệt là trong các ngành công nghệ cao và y tế. Việc hiểu rõ cấu hình electron và các tính chất hóa học liên quan của Cobalt không chỉ giúp chúng ta tận dụng hiệu quả nguyên tố này mà còn mở ra những hướng đi mới trong nghiên cứu và phát triển các sản phẩm và công nghệ tiên tiến.
Tóm lại, Cobalt là một nguyên tố thiết yếu với nhiều ứng dụng đa dạng, và kiến thức về cấu hình electron của nó là nền tảng cho sự phát triển và ứng dụng trong nhiều lĩnh vực khác nhau.