Chủ đề electron arrangement: Cấu hình electron là chìa khóa để hiểu rõ hơn về tính chất hóa học và vật lý của các nguyên tố. Bài viết này sẽ cung cấp cho bạn một hướng dẫn toàn diện về cách xác định, viết và áp dụng cấu hình electron trong thực tế, giúp bạn nắm vững kiến thức và dễ dàng vận dụng vào học tập cũng như nghiên cứu.
Mục lục
Cấu Hình Electron: Khái Niệm và Cách Xác Định
Cấu hình electron mô tả cách các electron được phân bố trong các lớp vỏ và phân lớp của nguyên tử. Đây là một khía cạnh quan trọng trong hóa học, giúp giải thích nhiều hiện tượng liên quan đến tính chất hóa học và vật lý của nguyên tố.
1. Khái niệm cấu hình electron
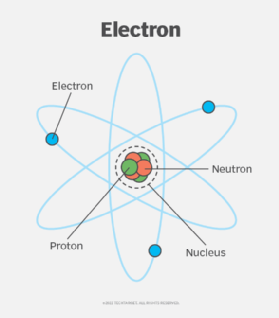
Cấu hình electron của nguyên tử là sự sắp xếp các electron trong các mức năng lượng quanh hạt nhân. Mỗi electron di chuyển trong một vùng không gian gọi là obitan và được mô tả bởi các chỉ số nguyên tử (n, l, m, s).
2. Các quy tắc và nguyên lý viết cấu hình electron
Việc viết cấu hình electron tuân theo ba nguyên lý chính:
- Nguyên lý Pauli: Mỗi obitan chỉ chứa tối đa hai electron, và chúng phải có spin ngược chiều.
- Quy tắc Hund: Trong cùng một phân lớp, các electron sẽ chiếm các obitan trống trước khi bắt đầu ghép đôi.
- Nguyên lý vững bền: Electron sẽ lấp đầy các mức năng lượng từ thấp đến cao theo thứ tự nhất định.
3. Ví dụ về cấu hình electron
Ví dụ về cấu hình electron của một số nguyên tố:
- Hydrogen (Z=1): \[1s^1\]
- Oxygen (Z=8): \[1s^2 2s^2 2p^4\]
- Sắt (Fe, Z=26): \[1s^2 2s^2 2p^6 3s^2 3p^6 3d^6 4s^2\]
4. Ứng dụng của cấu hình electron
Hiểu cấu hình electron giúp chúng ta:
- Xác định tính chất hóa học của các nguyên tố.
- Giải thích các liên kết hóa học và hình thành phân tử.
- Dự đoán phản ứng hóa học và xu hướng của các nguyên tố trong bảng tuần hoàn.
5. Bài tập ví dụ
Hãy viết cấu hình electron cho các nguyên tố sau:
- Natri (Na, Z=11): Đáp án: \[1s^2 2s^2 2p^6 3s^1\]
- Nhôm (Al, Z=13): Đáp án: \[1s^2 2s^2 2p^6 3s^2 3p^1\]
- Kẽm (Zn, Z=30): Đáp án: \[1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^2\]
6. Bảng phân bố electron
| Nguyên tố | Cấu hình electron |
|---|---|
| Carbon (C) | \[1s^2 2s^2 2p^2\] |
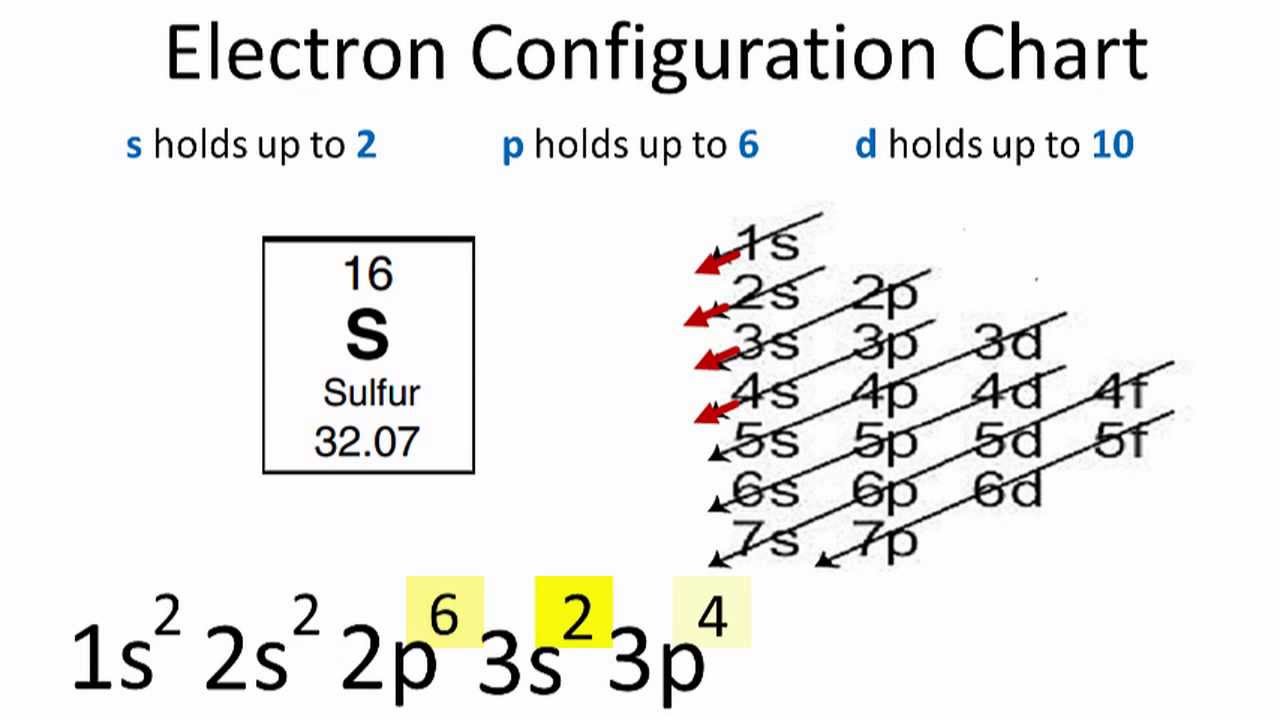
| Lưu huỳnh (S) | \[1s^2 2s^2 2p^6 3s^2 3p^4\] |
| Đồng (Cu) | \[1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^1\] |
Cấu hình electron là nền tảng để hiểu sâu hơn về hóa học nguyên tử và các nguyên tố hóa học. Nắm vững cấu hình electron sẽ giúp bạn tự tin hơn trong việc học và ứng dụng hóa học vào thực tế.

.png)
1. Giới Thiệu Về Cấu Hình Electron
Cấu hình electron là cách mô tả sự phân bố của các electron trong nguyên tử theo các lớp và phân lớp năng lượng. Hiểu rõ cấu hình electron giúp chúng ta nắm bắt được các tính chất hóa học cơ bản của nguyên tố và dự đoán được sự tham gia của chúng vào các phản ứng hóa học.
Trong mỗi nguyên tử, các electron di chuyển quanh hạt nhân theo các mức năng lượng khác nhau. Các mức năng lượng này được chia thành các lớp chính, ký hiệu bằng các chữ cái K, L, M, N, O, P, Q, với lớp K gần hạt nhân nhất và có mức năng lượng thấp nhất.
- Lớp electron: Mỗi lớp chính bao gồm một hoặc nhiều phân lớp, ký hiệu bằng các chữ cái thường như s, p, d, f. Các electron trong cùng một phân lớp có mức năng lượng bằng nhau.
- Nguyên tắc: Các electron sẽ được sắp xếp vào các lớp và phân lớp theo nguyên tắc từ mức năng lượng thấp đến cao, tức là từ lớp trong cùng ra ngoài cùng.
- Số electron tối đa: Số electron tối đa trong mỗi lớp và phân lớp được xác định bởi quy tắc sau:
- Phân lớp s: chứa tối đa 2 electron.
- Phân lớp p: chứa tối đa 6 electron.
- Phân lớp d: chứa tối đa 10 electron.
- Phân lớp f: chứa tối đa 14 electron.
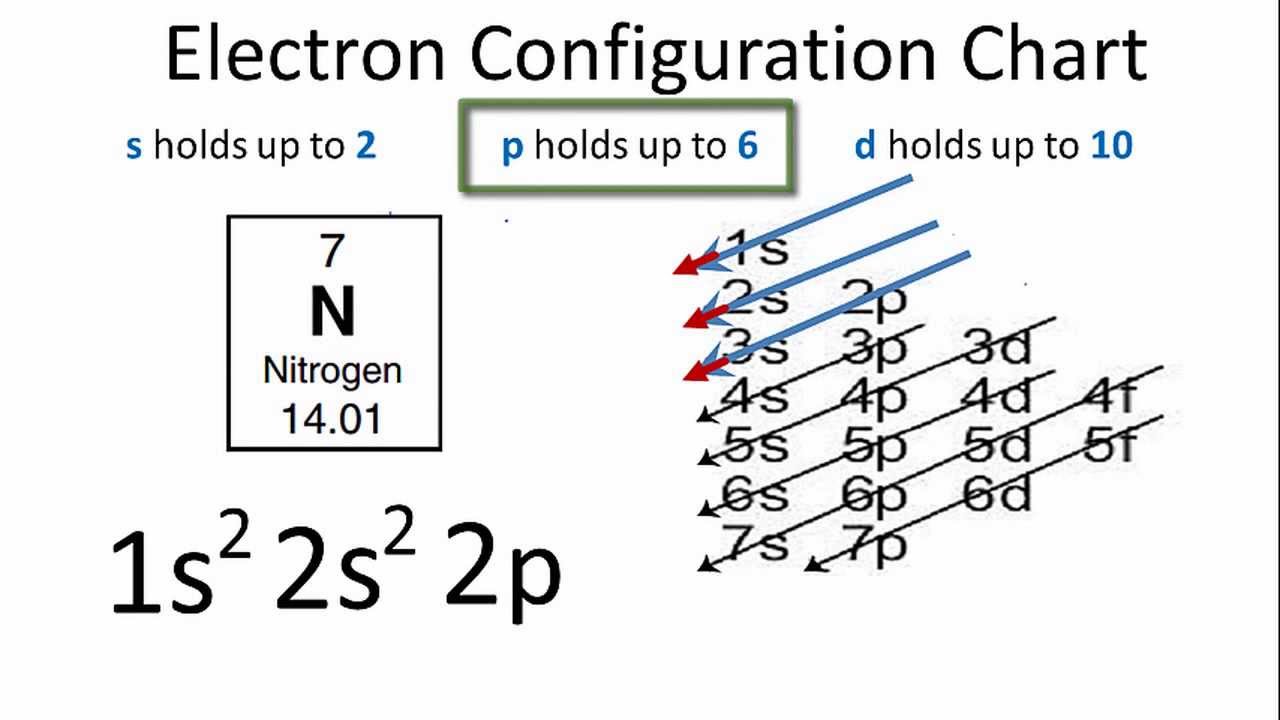
Ví dụ, cấu hình electron của nguyên tố Carbon (C) có số nguyên tử Z = 6 được viết là \[1s^2 2s^2 2p^2\], biểu thị rằng có 2 electron trong phân lớp 1s, 2 electron trong phân lớp 2s và 2 electron trong phân lớp 2p.
Hiểu cấu hình electron không chỉ giúp chúng ta nắm rõ cấu trúc nguyên tử mà còn hỗ trợ trong việc dự đoán và giải thích các tính chất hóa học và vật lý của các nguyên tố trong bảng tuần hoàn.
2. Quy Tắc và Nguyên Lý Viết Cấu Hình Electron
Viết cấu hình electron của một nguyên tử đòi hỏi phải tuân theo một số quy tắc và nguyên lý quan trọng. Những quy tắc này giúp xác định cách các electron phân bố trong các lớp và phân lớp quanh hạt nhân nguyên tử.
- Nguyên lý Pauli: Nguyên lý này khẳng định rằng trong một nguyên tử, không thể có hai electron cùng tồn tại trong một obitan với bốn số lượng tử giống hệt nhau. Điều này có nghĩa là mỗi obitan chỉ có thể chứa tối đa hai electron và chúng phải có spin ngược chiều (\(\uparrow\) và \(\downarrow\)).
- Quy tắc Hund: Quy tắc Hund được áp dụng khi các electron lấp đầy các obitan của một phân lớp. Theo quy tắc này, các electron sẽ chiếm các obitan trống trước khi bắt đầu ghép đôi trong cùng một obitan. Điều này giúp các electron có mức năng lượng thấp nhất có thể.
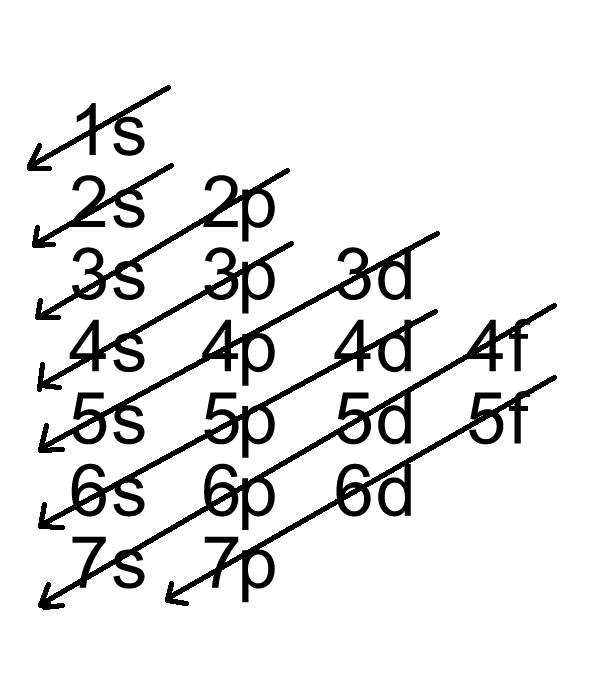
- Nguyên lý vững bền: Theo nguyên lý này, các electron sẽ điền vào các obitan theo thứ tự mức năng lượng từ thấp đến cao. Thứ tự này thường được biểu diễn bằng sơ đồ chéo, trong đó các obitan được sắp xếp theo thứ tự năng lượng tăng dần: \[1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p\].
Ví dụ về cách viết cấu hình electron:
- Hydrogen (Z=1): Cấu hình electron đơn giản nhất là của nguyên tử hydrogen với cấu hình \[1s^1\].
- Carbon (Z=6): Áp dụng các nguyên lý trên, cấu hình electron của carbon là \[1s^2 2s^2 2p^2\].
- Neon (Z=10): Neon có cấu hình electron đầy đủ trong lớp thứ hai với \[1s^2 2s^2 2p^6\], làm cho nó trở thành một nguyên tố khí hiếm ổn định.
Hiểu và áp dụng chính xác các quy tắc này sẽ giúp bạn viết đúng cấu hình electron cho bất kỳ nguyên tố nào trong bảng tuần hoàn, từ đó hiểu sâu hơn về tính chất hóa học và vật lý của các nguyên tố.

3. Cách Viết Cấu Hình Electron
Viết cấu hình electron cho một nguyên tố là việc xác định cách các electron được phân bố trong các lớp và phân lớp của nguyên tử. Quá trình này đòi hỏi sự tuân thủ nghiêm ngặt các quy tắc và nguyên lý đã được đề cập. Dưới đây là các bước cơ bản để viết cấu hình electron một cách chính xác.
- Xác định số electron của nguyên tố:
Bắt đầu bằng cách xác định số electron của nguyên tố dựa trên số hiệu nguyên tử (Z). Số hiệu nguyên tử cũng chính là số proton trong hạt nhân và số electron trong một nguyên tử trung hòa.
- Điền electron vào các obitan theo thứ tự năng lượng:
Theo nguyên lý vững bền, các electron sẽ lấp đầy các obitan theo thứ tự năng lượng từ thấp đến cao. Thứ tự này được biểu diễn qua sơ đồ chéo, ví dụ:
- \[1s\]
- \[2s\]
- \[2p, 3s\]
- \[3p, 4s\]
- \[3d, 4p\]
- \[5s, 4d, 5p\]
Tiếp tục điền electron vào các obitan cho đến khi bạn đã sử dụng hết số electron của nguyên tố.
- Áp dụng các quy tắc Pauli và Hund:
Đảm bảo rằng mỗi obitan chỉ chứa tối đa hai electron với spin ngược nhau theo nguyên lý Pauli. Ngoài ra, theo quy tắc Hund, trong cùng một phân lớp, electron sẽ lấp đầy các obitan trống trước khi ghép đôi.
- Viết cấu hình electron:
Sau khi điền electron vào các obitan, viết cấu hình electron bằng cách liệt kê các phân lớp theo thứ tự đã điền, kèm theo số electron trong mỗi phân lớp dưới dạng số mũ. Ví dụ:
- Carbon (Z=6): \[1s^2 2s^2 2p^2\]
- Neon (Z=10): \[1s^2 2s^2 2p^6\]
- Sắt (Fe, Z=26): \[1s^2 2s^2 2p^6 3s^2 3p^6 3d^6 4s^2\]
Sau khi thực hiện các bước trên, bạn sẽ có được cấu hình electron chính xác cho bất kỳ nguyên tố nào. Việc viết đúng cấu hình electron là cơ sở để hiểu rõ hơn về tính chất hóa học và vật lý của các nguyên tố trong bảng tuần hoàn.
4. Bảng Cấu Hình Electron của Các Nguyên Tố Thường Gặp
Để dễ dàng tra cứu và so sánh, dưới đây là bảng cấu hình electron của một số nguyên tố hóa học thường gặp. Bảng này liệt kê cấu hình electron của các nguyên tố từ hydro (Z=1) đến canxi (Z=20) và một vài nguyên tố điển hình khác, giúp bạn nhanh chóng xác định cách phân bố electron trong các phân lớp của nguyên tử.
| Nguyên tố | Ký hiệu hóa học | Số nguyên tử (Z) | Cấu hình electron |
|---|---|---|---|
| Hydro | H | 1 | 1s1 |
| Heli | He | 2 | 1s2 |
| Liti | Li | 3 | 1s2 2s1 |
| Cacbon | C | 6 | 1s2 2s2 2p2 |
| Oxy | O | 8 | 1s2 2s2 2p4 |
| Natri | Na | 11 | 1s2 2s2 2p6 3s1 |
| Nhôm | Al | 13 | 1s2 2s2 2p6 3s2 3p1 |
| Lưu huỳnh | S | 16 | 1s2 2s2 2p6 3s2 3p4 |
| Canxi | Ca | 20 | 1s2 2s2 2p6 3s2 3p6 4s2 |
| Sắt | Fe | 26 | 1s2 2s2 2p6 3s2 3p6 3d6 4s2 |
| Đồng | Cu | 29 | 1s2 2s2 2p6 3s2 3p6 3d10 4s1 |
| Bạc | Ag | 47 | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s1 |
Bảng cấu hình electron trên giúp bạn có cái nhìn tổng quan về cách phân bố electron trong các nguyên tố phổ biến, từ đó hỗ trợ trong việc học tập và nghiên cứu hóa học.

5. Ứng Dụng Của Cấu Hình Electron Trong Hóa Học
Cấu hình electron không chỉ là một khái niệm cơ bản trong hóa học mà còn có nhiều ứng dụng thực tiễn, giúp giải thích và dự đoán nhiều tính chất hóa học và vật lý của các nguyên tố và hợp chất. Dưới đây là một số ứng dụng quan trọng của cấu hình electron trong hóa học.
- Dự đoán tính chất hóa học của nguyên tố:
Cấu hình electron cho phép các nhà hóa học dự đoán tính chất hóa học của một nguyên tố, chẳng hạn như mức độ hoạt động hóa học, khả năng tạo liên kết và các phản ứng hóa học có thể xảy ra. Các nguyên tố có cấu hình electron tương tự thường có tính chất hóa học tương tự, như các nguyên tố trong cùng một nhóm của bảng tuần hoàn.
- Xác định vị trí của nguyên tố trong bảng tuần hoàn:
Dựa vào cấu hình electron, có thể xác định được nguyên tố nằm ở nhóm và chu kỳ nào trong bảng tuần hoàn. Ví dụ, các nguyên tố có cấu hình electron kết thúc ở phân lớp \(s\) thường nằm trong nhóm I và II, trong khi các nguyên tố có cấu hình electron kết thúc ở phân lớp \(p\) nằm ở nhóm III đến VIII.
- Giải thích sự hình thành liên kết hóa học:
Cấu hình electron là cơ sở để hiểu về sự hình thành liên kết ion và cộng hóa trị. Các nguyên tử có xu hướng đạt được cấu hình electron bền vững giống như khí hiếm bằng cách nhận, nhường hoặc chia sẻ electron, dẫn đến việc hình thành liên kết hóa học.
- Dự đoán hình dạng phân tử:
Cấu hình electron của nguyên tử trung tâm trong một phân tử có thể giúp dự đoán hình dạng của phân tử đó theo lý thuyết VSEPR (Valence Shell Electron Pair Repulsion). Ví dụ, nếu nguyên tử trung tâm có cấu hình electron với các cặp electron tự do, phân tử sẽ có hình dạng bị biến dạng do lực đẩy giữa các cặp electron này.
- Ứng dụng trong phân tích quang phổ:
Cấu hình electron cũng được sử dụng để giải thích các vạch quang phổ của nguyên tử. Khi electron chuyển từ mức năng lượng cao xuống mức năng lượng thấp hơn, chúng phát ra năng lượng dưới dạng ánh sáng, và bước sóng của ánh sáng này có thể được sử dụng để xác định nguyên tố.
Các ứng dụng của cấu hình electron cho thấy tầm quan trọng của khái niệm này trong việc hiểu biết và khám phá thế giới hóa học. Nhờ cấu hình electron, nhiều hiện tượng hóa học phức tạp được giải thích một cách dễ dàng và chính xác.
XEM THÊM:
6. Bài Tập Về Cấu Hình Electron
Dưới đây là một số bài tập về cấu hình electron giúp bạn củng cố kiến thức và rèn luyện kỹ năng viết cấu hình electron của các nguyên tố. Các bài tập được chia thành hai cấp độ: cơ bản và nâng cao.
6.1 Bài Tập Cơ Bản và Hướng Dẫn Giải
-
Bài 1: Viết cấu hình electron của các nguyên tố sau đây: Na (Z=11), Mg (Z=12), Al (Z=13).
Hướng dẫn:
- Na (Z=11): Cấu hình electron là \(1s^2 2s^2 2p^6 3s^1\)
- Mg (Z=12): Cấu hình electron là \(1s^2 2s^2 2p^6 3s^2\)
- Al (Z=13): Cấu hình electron là \(1s^2 2s^2 2p^6 3s^2 3p^1\)
-
Bài 2: Nguyên tử X có số hiệu nguyên tử Z=17. Hãy xác định số lượng electron, và viết cấu hình electron của nguyên tử này.
Hướng dẫn: Với Z=17, nguyên tử có 17 electron. Cấu hình electron là \(1s^2 2s^2 2p^6 3s^2 3p^5\).
-
Bài 3: Xác định nhóm nguyên tố của các nguyên tử có cấu hình electron sau: \(1s^2 2s^2 2p^6 3s^2 3p^4\).
Hướng dẫn: Cấu hình trên thuộc về nguyên tố lưu huỳnh (S) trong nhóm VIA của bảng tuần hoàn.
6.2 Bài Tập Nâng Cao và Phân Tích Kết Quả
-
Bài 4: Nguyên tử nguyên tố X có tổng số hạt cơ bản là 40. Trong đó, số hạt mang điện nhiều hơn hạt không mang điện là 12. Viết cấu hình electron của X.
Phân tích: Gọi số proton là p, số neutron là n và số electron là e. Ta có phương trình: \(p + n + e = 40\) và \(p + e = n + 12\). Từ đó, giải ra được p, e, n và viết cấu hình electron của nguyên tố X.
-
Bài 5: Viết cấu hình electron và giải thích sự khác biệt về cấu hình electron của Cr (Z=24) và Cu (Z=29).
Phân tích: Dù theo lý thuyết, Cr có cấu hình electron là \( [Ar] 3d^4 4s^2 \), nhưng thực tế Cr có cấu hình electron là \( [Ar] 3d^5 4s^1 \) do sự ổn định của bán lấp đầy phân lớp d. Tương tự, Cu có cấu hình electron là \( [Ar] 3d^{10} 4s^1 \) thay vì \( [Ar] 3d^9 4s^2 \).
-
Bài 6: Cho biết ion X2+ có cấu hình electron là \( [Ar] 3d^6 \). Xác định nguyên tố X và viết cấu hình electron của X.
Phân tích: Xác định cấu hình electron của X2+, sau đó thêm 2 electron để có cấu hình của nguyên tử X. Kết quả là nguyên tố sắt (Fe) với cấu hình electron là \( [Ar] 3d^6 4s^2 \).