Chủ đề bài tập về cấu tạo vỏ nguyên tử lớp 10: Bài viết này cung cấp một hướng dẫn chi tiết về cấu tạo vỏ nguyên tử lớp 10, bao gồm các lý thuyết cơ bản, bài tập thực hành và cách giải chi tiết. Hãy cùng khám phá để nắm vững kiến thức và tự tin vượt qua mọi bài kiểm tra hóa học.
Mục lục
- Bài Tập Về Cấu Tạo Vỏ Nguyên Tử Lớp 10
- Mục Lục Tổng Hợp Và Phân Tích Chuyên Sâu
- 1. Tổng quan về cấu tạo vỏ nguyên tử
- 2. Cấu hình electron và quy tắc sắp xếp
- 3. Phân loại và giải các bài tập cơ bản
- 4. Bài tập nâng cao về cấu tạo vỏ nguyên tử
- 5. Trắc nghiệm và câu hỏi lý thuyết
- 6. Ứng dụng của cấu tạo vỏ nguyên tử trong hóa học
- 7. Các lỗi phổ biến khi giải bài tập về cấu tạo vỏ nguyên tử
Bài Tập Về Cấu Tạo Vỏ Nguyên Tử Lớp 10
Bài tập về cấu tạo vỏ nguyên tử lớp 10 là một phần quan trọng trong chương trình Hóa học THPT. Đây là các bài tập giúp học sinh hiểu rõ hơn về cấu trúc và tính chất của các electron trong nguyên tử, từ đó có thể áp dụng vào các bài toán hóa học và hiểu sâu hơn về cơ chế của phản ứng hóa học.
Các Khái Niệm Cơ Bản
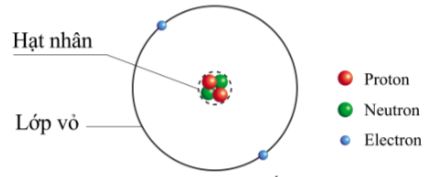
- Cấu tạo vỏ nguyên tử: Vỏ nguyên tử bao gồm các electron chuyển động xung quanh hạt nhân. Các electron này được sắp xếp theo các lớp và phân lớp với mức năng lượng khác nhau.
- Obitan nguyên tử: Obitan là khu vực không gian xung quanh hạt nhân mà tại đó xác suất tìm thấy electron là cao nhất. Các obitan được phân loại theo các dạng khác nhau như s, p, d, f.
- Lớp electron: Các electron có cùng mức năng lượng được xếp vào cùng một lớp. Mỗi lớp electron có thể chứa một số phân lớp tùy thuộc vào mức năng lượng.
Bài Tập Mẫu
- Bài 1: Một nguyên tử có 3 lớp electron, lớp thứ 2 có 8 electron. Viết cấu hình electron của nguyên tử đó.
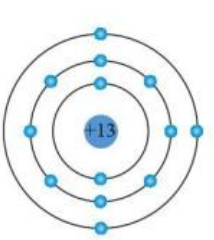
- Bài 2: Nguyên tử có số hiệu nguyên tử Z = 17. Hãy xác định số electron trên các lớp và viết cấu hình electron.
- Bài 3: Viết cấu hình electron của nguyên tử có số proton là 19.
Giải Bài Tập
Giải các bài tập trên đòi hỏi học sinh phải nắm vững các khái niệm về cấu trúc nguyên tử, cấu hình electron, cũng như các quy tắc Hund và quy tắc Aufbau.
Ví dụ, để giải Bài 1, ta xác định nguyên tử có 3 lớp electron với cấu hình electron là:
\[1s^2, 2s^2, 2p^6, 3s^1\]
Trong bài tập này, lớp thứ 3 có 1 electron, lớp thứ 2 có 8 electron, và lớp thứ nhất có 2 electron.
Kết Luận
Việc giải các bài tập về cấu tạo vỏ nguyên tử không chỉ giúp học sinh củng cố kiến thức lý thuyết mà còn rèn luyện kỹ năng tư duy logic và khả năng phân tích các vấn đề hóa học phức tạp. Đây là nền tảng để học sinh tiếp tục nghiên cứu các chủ đề hóa học nâng cao hơn trong các chương tiếp theo.

.png)
Mục Lục Tổng Hợp Và Phân Tích Chuyên Sâu
Mục lục tổng hợp và phân tích chuyên sâu sẽ giúp học sinh nắm vững kiến thức về cấu tạo vỏ nguyên tử lớp 10. Dưới đây là các nội dung quan trọng được tổng hợp một cách chi tiết và dễ hiểu, giúp học sinh ôn tập và vận dụng kiến thức vào bài tập thực tế.
1. Tổng quan về cấu tạo vỏ nguyên tử
Vỏ nguyên tử là phần bên ngoài của nguyên tử, nơi các electron chuyển động rất nhanh xung quanh hạt nhân mà không theo quỹ đạo xác định nào. Các electron này tạo thành một đám mây điện tử (electron cloud) bao quanh hạt nhân nguyên tử. Cấu tạo của vỏ nguyên tử bao gồm các lớp electron và các phân lớp electron, chúng được sắp xếp theo mức năng lượng từ thấp đến cao.
Lớp electron
Các lớp electron là các tập hợp electron có mức năng lượng gần bằng nhau. Thứ tự các lớp electron được sắp xếp từ gần hạt nhân ra xa, với mức năng lượng tăng dần. Các lớp electron được ký hiệu bằng các chữ cái: K, L, M, N, O, P, Q, tương ứng với các mức năng lượng n=1, 2, 3, 4, 5, 6, 7.
Phân lớp electron
Mỗi lớp electron lại được chia thành các phân lớp electron nhỏ hơn, bao gồm các phân lớp s, p, d, và f. Số phân lớp trong mỗi lớp phụ thuộc vào giá trị của \(n\) (mức năng lượng chính), với số lượng phân lớp tối đa là \(n\).
- Phân lớp s: Chỉ có 1 obitan hình cầu, có thể chứa tối đa 2 electron.
- Phân lớp p: Gồm 3 obitan hình số 8, mỗi obitan có thể chứa tối đa 2 electron, tổng cộng là 6 electron.
- Phân lớp d: Gồm 5 obitan, chứa tối đa 10 electron.
- Phân lớp f: Gồm 7 obitan, chứa tối đa 14 electron.
Số electron tối đa trong một lớp
Số lượng electron tối đa có thể chứa trong một lớp được xác định bởi công thức \(2n^2\), trong đó \(n\) là số thứ tự của lớp. Ví dụ:
- Lớp K (\(n=1\)) chứa tối đa \(2 \times 1^2 = 2\) electron.
- Lớp L (\(n=2\)) chứa tối đa \(2 \times 2^2 = 8\) electron.
- Lớp M (\(n=3\)) chứa tối đa \(2 \times 3^2 = 18\) electron.
Như vậy, vỏ nguyên tử là một hệ thống phức tạp, được cấu trúc bởi các lớp và phân lớp electron sắp xếp theo mức năng lượng, đảm bảo sự cân bằng và ổn định của nguyên tử.

2. Cấu hình electron và quy tắc sắp xếp
Cấu hình electron của nguyên tử là cách phân bố các electron vào các lớp và phân lớp electron khác nhau trong vỏ nguyên tử. Để xác định cấu hình electron chính xác cho một nguyên tử, chúng ta cần tuân theo ba quy tắc quan trọng: quy tắc Aufbau, nguyên lý Pauli và quy tắc Hund.
- Quy tắc Aufbau: Theo quy tắc này, các electron sẽ lấp đầy các orbital có mức năng lượng thấp hơn trước, sau đó mới lấp đầy các orbital có mức năng lượng cao hơn. Cụ thể, thứ tự lấp đầy orbital là: \(1s \rightarrow 2s \rightarrow 2p \rightarrow 3s \rightarrow 3p \rightarrow 4s \rightarrow 3d \rightarrow 4p\) và tiếp tục như vậy.
- Nguyên lý Pauli: Nguyên lý này quy định rằng mỗi orbital chỉ chứa tối đa hai electron và hai electron này phải có spin ngược chiều nhau. Ký hiệu cho hai electron này trong một orbital là \( \uparrow \downarrow \).
- Quy tắc Hund: Quy tắc này nêu rõ rằng trong một phân lớp với nhiều orbital có cùng mức năng lượng, electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa trước khi các electron bắt đầu ghép cặp. Ví dụ, đối với phân lớp \(2p\), trước tiên chúng ta sẽ có cấu hình \( \uparrow \, \uparrow \, \uparrow \) thay vì \( \uparrow \downarrow \, \uparrow \, \).
Áp dụng các quy tắc trên, ta có thể viết cấu hình electron của các nguyên tử. Ví dụ, cấu hình electron của nguyên tử carbon (C) với số thứ tự nguyên tử là 6 sẽ được viết là \(1s^2 2s^2 2p^2\). Còn đối với nguyên tử oxygen (O) với số thứ tự nguyên tử là 8, cấu hình electron sẽ là \(1s^2 2s^2 2p^4\).
Một điểm quan trọng khác là các electron trong các lớp ngoài cùng có ảnh hưởng lớn đến tính chất hóa học của nguyên tử, và cấu hình electron quyết định khả năng liên kết và phản ứng của nguyên tử với các nguyên tử khác.

3. Phân loại và giải các bài tập cơ bản
Trong phần này, chúng ta sẽ phân loại và giải các bài tập cơ bản liên quan đến cấu tạo vỏ nguyên tử lớp 10. Bài tập về cấu tạo vỏ nguyên tử thường xoay quanh các vấn đề chính như xác định số lớp electron, phân lớp, số electron tối đa trong mỗi lớp, và cấu hình electron của nguyên tử. Dưới đây là một số dạng bài tập phổ biến và cách giải chi tiết từng bước.
3.1. Xác định số lớp electron và số electron trong mỗi lớp
- Bài toán yêu cầu xác định số lớp electron của nguyên tử dựa trên số proton (Z) và số electron (E).
- Bài tập ví dụ: Một nguyên tử có 19 electron. Hãy xác định số lớp electron và số electron trong mỗi lớp.
- Giải:
- Xác định số lớp electron: Số lớp electron của một nguyên tử được xác định bởi giá trị \(n\) (số thứ tự lớp). Với 19 electron, cấu hình electron của nguyên tử là \(1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}4s^{1}\).
- Có 4 lớp electron tương ứng với các giá trị \(n = 1, 2, 3, 4\).
- Số electron trong mỗi lớp:
- Lớp K (\(n = 1\)): \(1s^{2}\) → 2 electron
- Lớp L (\(n = 2\)): \(2s^{2}2p^{6}\) → 8 electron
- Lớp M (\(n = 3\)): \(3s^{2}3p^{6}\) → 8 electron
- Lớp N (\(n = 4\)): \(4s^{1}\) → 1 electron
3.2. Xác định cấu hình electron
- Bài toán yêu cầu viết cấu hình electron đầy đủ cho một nguyên tử hoặc ion.
- Bài tập ví dụ: Viết cấu hình electron đầy đủ của nguyên tử lưu huỳnh (S, Z = 16).
- Giải:
- Xác định số electron: Lưu huỳnh có 16 electron.
- Viết cấu hình electron: \(1s^{2}2s^{2}2p^{6}3s^{2}3p^{4}\).
3.3. Xác định số electron tối đa trong các lớp và phân lớp
- Bài toán yêu cầu xác định số electron tối đa mà một lớp hoặc phân lớp có thể chứa.
- Bài tập ví dụ: Xác định số electron tối đa trong lớp L (\(n = 2\)).
- Giải:
- Lớp L có 2 phân lớp: \(2s\) và \(2p\).
- Số electron tối đa trong mỗi phân lớp:
- \(2s\): chứa tối đa 2 electron.
- \(2p\): chứa tối đa 6 electron.
- Vậy số electron tối đa trong lớp L là \(2 + 6 = 8\) electron.
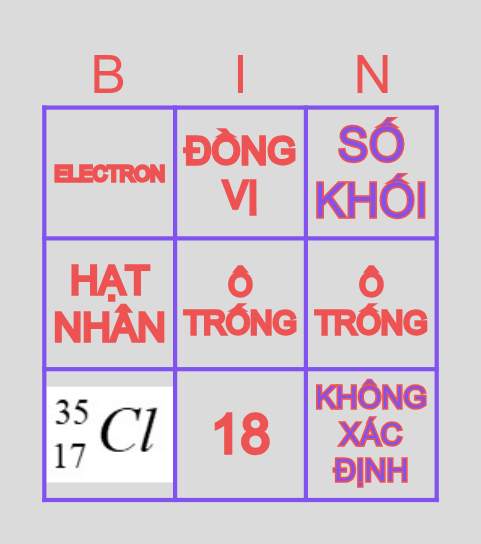
3.4. Bài tập về đồng vị và khối lượng nguyên tử
- Bài toán liên quan đến xác định kí hiệu nguyên tử, số khối, số proton, neutron và electron.
- Bài tập ví dụ: Một nguyên tử có 75 electron và 110 neutron. Hãy xác định kí hiệu nguyên tử.
- Giải:
- Xác định số proton: \(Z = 75\).
- Xác định số khối: \(A = Z + N = 75 + 110 = 185\).
- Kí hiệu nguyên tử: \[ ^{185}_{75}M \].
Qua các ví dụ và bài tập trên, chúng ta đã làm quen với các dạng bài tập cơ bản về cấu tạo vỏ nguyên tử lớp 10, đồng thời nắm vững cách giải các bài tập này theo từng bước cụ thể. Việc nắm rõ lý thuyết và áp dụng vào bài tập sẽ giúp các em học sinh củng cố kiến thức và chuẩn bị tốt hơn cho các kỳ thi.

4. Bài tập nâng cao về cấu tạo vỏ nguyên tử
Trong phần này, chúng ta sẽ đi sâu vào các bài tập nâng cao liên quan đến cấu tạo vỏ nguyên tử. Những bài tập này đòi hỏi sự hiểu biết sâu rộng về các nguyên lý cơ bản, cùng khả năng áp dụng chúng vào các tình huống phức tạp hơn.
- Bài tập 1: Xác định cấu hình electron của nguyên tử phức tạp
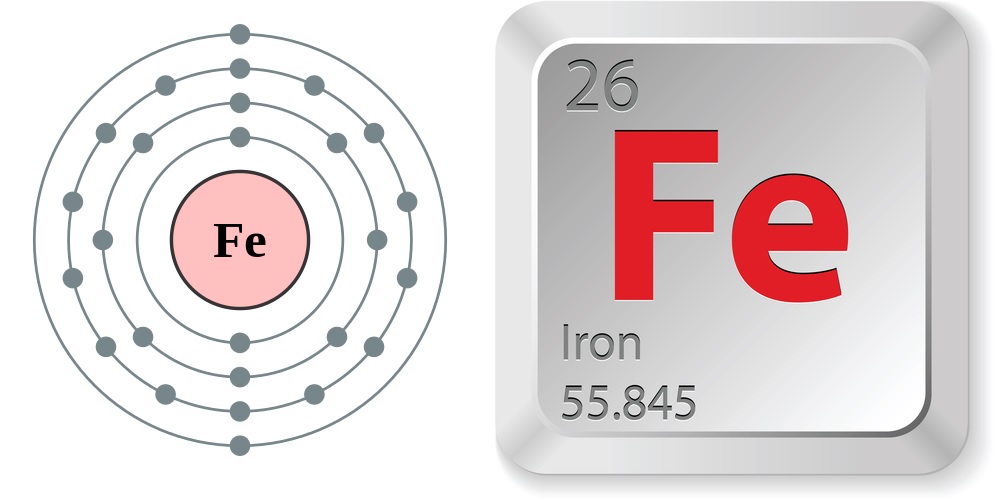
Xác định cấu hình electron cho các nguyên tử có số hiệu nguyên tử cao hơn. Ví dụ, xác định cấu hình electron của nguyên tử crom (
\(Cr\), Z = 24 ).Hướng dẫn giải:
- Xác định số electron:
\(Z = 24\) . - Viết cấu hình electron theo thứ tự mức năng lượng:
\(1s^2 2s^2 2p^6 3s^2 3p^6 4s^1 3d^5\) . - Chú ý sự đặc biệt trong cấu hình của các nguyên tố chuyển tiếp như crom.
- Xác định số electron:
- Bài tập 2: So sánh tính chất hóa học giữa các nguyên tố dựa trên cấu hình electron
So sánh tính chất hóa học giữa các nguyên tố thuộc cùng một nhóm hoặc chu kỳ dựa trên cấu hình electron. Ví dụ, so sánh tính kim loại giữa natri (
\(Na\), Z = 11 ) và kali (\(K\), Z = 19 ).Hướng dẫn giải:
- Viết cấu hình electron của natri và kali.
- Xem xét số electron lớp ngoài cùng và vị trí của chúng trong bảng tuần hoàn.
- Đưa ra kết luận về tính kim loại dựa trên cấu hình electron.
- Bài tập 3: Tính toán năng lượng ion hóa
Tính toán năng lượng ion hóa đầu tiên của một nguyên tố dựa trên cấu hình electron của nó.
Hướng dẫn giải:
- Xác định cấu hình electron của nguyên tố.
- Dựa trên cấu hình electron, xác định lớp electron ngoài cùng và mức năng lượng của chúng.
- Sử dụng công thức hoặc các giá trị đã cho để tính toán năng lượng ion hóa.
- Bài tập 4: Xác định số electron tối đa trong các phân lớp
Xác định số electron tối đa có thể tồn tại trong các phân lớp s, p, d, f và áp dụng vào các bài toán cụ thể.
Hướng dẫn giải:
- Nhớ rằng mỗi phân lớp s chứa tối đa 2 electron, phân lớp p chứa tối đa 6 electron, d chứa tối đa 10 electron và f chứa tối đa 14 electron.
- Áp dụng kiến thức này để giải quyết các bài toán liên quan đến cấu trúc phân lớp của các nguyên tử.
XEM THÊM:
5. Trắc nghiệm và câu hỏi lý thuyết
Phần này bao gồm các câu hỏi trắc nghiệm và lý thuyết nhằm củng cố kiến thức về cấu tạo vỏ nguyên tử đã học. Những câu hỏi này giúp học sinh kiểm tra và đánh giá mức độ hiểu biết của mình, từ đó chuẩn bị tốt hơn cho các kỳ thi.
- Câu hỏi 1: Nguyên tử có cấu tạo gồm những thành phần nào?
- Hạt nhân và electron
- Proton và neutron
- Hạt nhân, proton, và neutron
- Hạt nhân, proton, neutron và electron
- Câu hỏi 2: Điện tích của electron là:
- Âm
- Dương
- Trung hòa
- Không có điện tích
- Câu hỏi 3: Trong các loại hạt sau, hạt nào có khối lượng lớn nhất?
- Electron
- Proton
- Neutron
- Hạt nhân
Những câu hỏi trên chỉ là ví dụ cơ bản, học sinh cần thực hành thêm nhiều bài tập trắc nghiệm khác để làm quen với đa dạng các dạng câu hỏi có thể xuất hiện trong các bài kiểm tra và kỳ thi.

6. Ứng dụng của cấu tạo vỏ nguyên tử trong hóa học
Cấu tạo vỏ nguyên tử đóng vai trò quan trọng trong nhiều lĩnh vực của hóa học, đặc biệt là trong việc giải thích các tính chất và hiện tượng hóa học. Dưới đây là một số ứng dụng tiêu biểu:
- 1. Giải thích tính chất hóa học của các nguyên tố:
- 2. Dự đoán liên kết hóa học:
- 3. Phân tích phổ nguyên tử:
- 4. Ứng dụng trong hóa học lượng tử:
- 5. Giải thích phản ứng hóa học:
Cấu hình electron của vỏ nguyên tử giúp xác định vị trí của nguyên tố trong bảng tuần hoàn và dự đoán các tính chất hóa học của nó. Ví dụ, các nguyên tố nhóm IA có 1 electron ở lớp ngoài cùng, do đó chúng có xu hướng mất electron để tạo thành ion dương.
Cấu trúc vỏ nguyên tử cho phép dự đoán loại liên kết mà nguyên tử sẽ hình thành. Nếu nguyên tử có ít hơn 4 electron ở lớp vỏ ngoài cùng, nó có xu hướng tạo liên kết ion. Ngược lại, nếu có từ 4 electron trở lên, nó sẽ dễ dàng tạo liên kết cộng hóa trị.
Phổ nguyên tử được tạo ra khi các electron chuyển từ mức năng lượng cao xuống mức năng lượng thấp, phát ra năng lượng dưới dạng ánh sáng. Cấu tạo vỏ nguyên tử cho phép hiểu và phân tích các dải phổ này, giúp xác định nguyên tố và nghiên cứu các trạng thái năng lượng của nó.
Cấu trúc vỏ nguyên tử là nền tảng của mô hình hóa học lượng tử, cho phép mô phỏng và dự đoán các hiện tượng hóa học phức tạp. Các hàm sóng của electron được sử dụng để giải thích và dự đoán cấu trúc phân tử, năng lượng liên kết, và tính chất từ của các chất.
Hiểu biết về cấu tạo vỏ nguyên tử giúp giải thích cơ chế của nhiều phản ứng hóa học, đặc biệt là các phản ứng oxy hóa-khử, phản ứng acid-base, và phản ứng cộng hợp. Ví dụ, sự dịch chuyển electron trong các phản ứng này có thể được mô tả chính xác dựa trên cấu hình electron của các nguyên tử tham gia.
Nhờ vào các ứng dụng này, cấu tạo vỏ nguyên tử không chỉ giúp học sinh hiểu sâu hơn về bản chất của các nguyên tố và phản ứng hóa học, mà còn mở ra nhiều hướng nghiên cứu và ứng dụng trong các lĩnh vực khoa học và công nghệ.

7. Các lỗi phổ biến khi giải bài tập về cấu tạo vỏ nguyên tử
Trong quá trình giải bài tập về cấu tạo vỏ nguyên tử, học sinh thường gặp phải một số lỗi phổ biến do hiểu nhầm hoặc thiếu kiến thức cơ bản. Dưới đây là các lỗi thường gặp và cách khắc phục để giúp học sinh nâng cao kết quả học tập:
- Nhầm lẫn số lớp và số electron: Một số học sinh thường nhầm lẫn giữa số lớp electron và số electron trong từng lớp. Ví dụ, nếu cấu hình electron là \(1s^2 2s^2 2p^6 3s^2\), thì lớp thứ hai sẽ có tổng cộng 8 electron, chứ không phải chỉ có 2 electron trong phân lớp 2s.
- Không nhớ được quy tắc Hund: Quy tắc Hund yêu cầu các electron phải phân bố vào các obitan riêng biệt trước khi ghép cặp. Nhiều học sinh có xu hướng điền electron vào cùng một obitan mà không tuân thủ quy tắc này, dẫn đến sai kết quả.
- Không xác định đúng số electron tối đa trong mỗi lớp: Một lỗi khác là không tính đúng số electron tối đa mà mỗi lớp có thể chứa, theo công thức \(2n^2\). Ví dụ, lớp thứ ba có thể chứa tối đa 18 electron, nhưng học sinh có thể nhầm lẫn chỉ có thể chứa 8 electron như lớp thứ hai.
- Nhầm lẫn giữa các khái niệm phân lớp và obitan: Học sinh thường nhầm lẫn giữa phân lớp và obitan, dẫn đến việc phân bố electron không đúng. Phân lớp p có ba obitan, nhưng đôi khi học sinh chỉ điền electron vào một obitan mà không phân bố đều vào các obitan còn lại.
- Quên xét đến sự bão hòa của lớp electron: Một số học sinh không để ý rằng một lớp electron khi đã đủ số electron tối đa sẽ trở thành lớp bão hòa và không thể thêm electron nữa, dẫn đến sai sót trong việc viết cấu hình electron của nguyên tử.
Để khắc phục các lỗi trên, học sinh cần:
- Nắm vững lý thuyết về cấu tạo vỏ nguyên tử: Học sinh nên ôn tập và hiểu rõ cách phân bố electron theo các lớp, phân lớp và obitan.
- Thực hành nhiều bài tập: Thực hành là cách tốt nhất để học sinh nhớ lâu và hạn chế các lỗi phổ biến khi giải bài tập về cấu tạo vỏ nguyên tử.
- Kiểm tra lại bài làm: Sau khi hoàn thành bài tập, học sinh nên kiểm tra lại các bước tính toán và cách phân bố electron để đảm bảo không mắc phải các lỗi đã nêu.