Chủ đề 4d10 electron configuration: Cấu hình electron 4d10 đóng vai trò quan trọng trong hóa học, đặc biệt đối với các kim loại chuyển tiếp. Bài viết này sẽ cung cấp cho bạn cái nhìn tổng quan về cấu hình 4d10, các nguyên lý phân bố electron, và những ứng dụng thực tiễn của nó trong đời sống. Hãy cùng khám phá chi tiết cấu hình này và lý do tại sao nó lại ổn định và có ích đến vậy.
Mục lục
Cấu hình electron 4d10
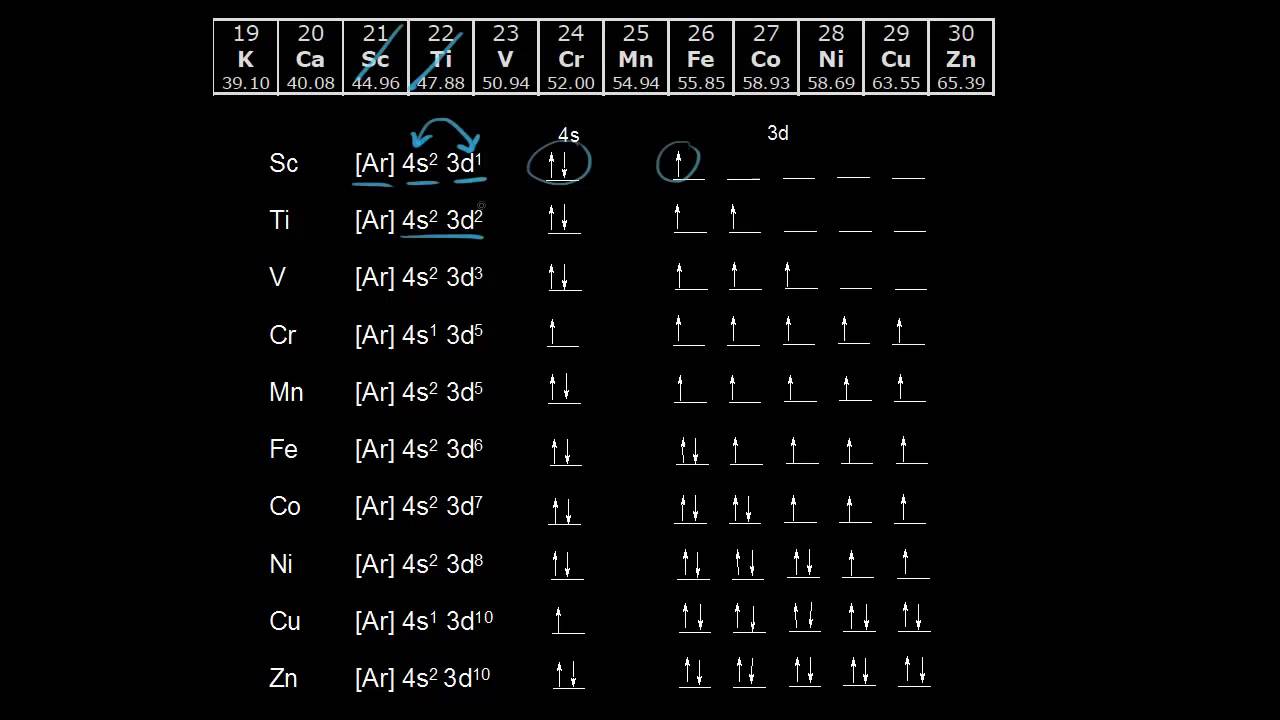
Cấu hình electron 4d10 thường xuất hiện trong các nguyên tố thuộc nhóm kim loại chuyển tiếp ở dãy nguyên tố thứ hai, đặc biệt là trong các nguyên tố bạc (Ag) và cadmium (Cd). Đây là cấu hình trong đó có mười electron điền đầy vào phân lớp d, tạo thành một cấu hình rất ổn định.
Nguyên lý và Quy tắc liên quan
- Nguyên lý Pauli: Mỗi orbital chỉ chứa tối đa hai electron có spin ngược chiều nhau.
- Quy tắc Hund: Các electron sẽ điền vào các orbital trống trước khi ghép đôi trong cùng một orbital.
- Nguyên lý Aufbau: Electron sẽ điền vào các orbital có mức năng lượng thấp hơn trước, sau đó mới điền vào các mức năng lượng cao hơn.
Ví dụ về cấu hình electron với 4d10
Dưới đây là cấu hình electron của một số nguyên tố với phân lớp 4d10:
- Ag (Z=47): [Kr] 4d10 5s1
- Cd (Z=48): [Kr] 4d10 5s2
Sự ổn định của cấu hình 4d10
Cấu hình 4d10 được xem là rất ổn định vì phân lớp d đã được lấp đầy hoàn toàn. Điều này làm giảm năng lượng tổng thể của nguyên tử và làm cho nguyên tử trở nên ít phản ứng hơn. Chính vì vậy, các nguyên tố như bạc (Ag) có tính chất hóa học rất đặc biệt và thường được sử dụng trong nhiều ứng dụng công nghiệp.
Ứng dụng trong thực tế
Nhờ cấu hình 4d10 ổn định, bạc được sử dụng rộng rãi trong các ngành công nghiệp điện tử, chế tạo pin, và đặc biệt là trong lĩnh vực kim hoàn nhờ tính chất dẫn điện tốt và khả năng chống oxy hóa.
Bảng mô tả các phân lớp electron
| Phân lớp | Số orbital | Số electron tối đa |
|---|---|---|
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Cách viết cấu hình electron 4d10
- Xác định số electron của nguyên tử (Z).
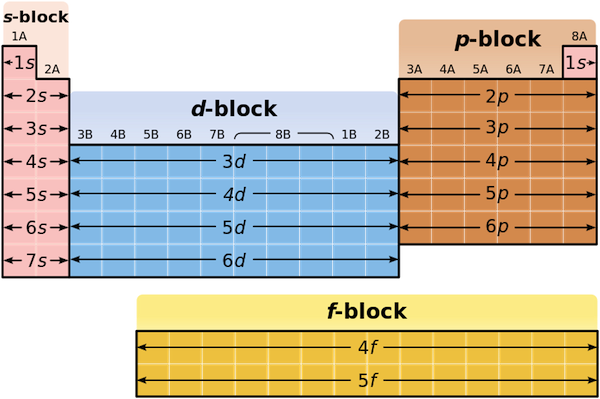
- Sắp xếp các electron theo thứ tự tăng dần mức năng lượng: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, ...
- Điền electron vào các orbital cho đến khi đạt đến cấu hình 4d10.
Ví dụ, đối với nguyên tố Ag (bạc):
Trong đó, [Kr] biểu thị cấu hình electron của khí hiếm krypton, là nguyên tố đứng trước bạc trong bảng tuần hoàn.
 10" style="object-fit:cover; margin-right: 20px;" width="760px" height="505">
10" style="object-fit:cover; margin-right: 20px;" width="760px" height="505">.png)
1. Giới thiệu về cấu hình electron 4d10
Cấu hình electron 4d10 là một trạng thái điện tử quan trọng, thường gặp ở các nguyên tố thuộc nhóm kim loại chuyển tiếp. Trong cấu hình này, có tổng cộng mười electron được phân bố đầy đủ trong phân lớp d của lớp thứ tư. Điều này tạo ra một cấu trúc rất ổn định, đặc biệt ở các nguyên tố như bạc (Ag) và cadmium (Cd).
Việc hiểu cấu hình electron 4d10 giúp chúng ta giải thích được nhiều tính chất hóa học và vật lý của các nguyên tố này. Trong quá trình phân bố electron, các nguyên tử sẽ điền electron vào các orbital theo thứ tự năng lượng từ thấp đến cao, tuân theo các nguyên lý cơ bản như nguyên lý Pauli, quy tắc Hund, và nguyên lý Aufbau.
Cấu hình electron có vai trò quan trọng trong việc xác định tính chất hóa học của nguyên tử, từ khả năng tạo liên kết, độ bền liên kết cho đến hoạt động xúc tác. Đặc biệt, cấu hình đầy đủ 4d10 mang lại sự ổn định năng lượng lớn, làm cho các nguyên tố sở hữu cấu hình này có xu hướng ít phản ứng hóa học hơn, thể hiện đặc tính hóa học độc đáo.
2. Nguyên lý phân bố electron
Việc phân bố electron trong các orbital nguyên tử tuân theo ba nguyên lý và quy tắc cơ bản: Nguyên lý Pauli, Quy tắc Hund và Nguyên lý Aufbau. Những nguyên lý này giúp xác định cách các electron sắp xếp vào các orbital và giải thích cấu hình electron của nguyên tử.
- Nguyên lý Pauli: Nguyên lý Pauli quy định rằng trong một nguyên tử, không có hai electron nào có cùng bốn số lượng tử. Điều này có nghĩa là mỗi orbital có thể chứa tối đa hai electron với spin ngược chiều nhau. Điều này giải thích tại sao mỗi orbital chỉ có thể chứa một cặp electron.
- Quy tắc Hund: Quy tắc Hund nêu rõ rằng, đối với các orbital có cùng mức năng lượng (còn gọi là degenerate orbitals), các electron sẽ điền vào từng orbital một cách đơn lẻ trước khi ghép đôi. Điều này giúp giảm thiểu sự đẩy nhau giữa các electron và duy trì trạng thái năng lượng thấp nhất.
- Nguyên lý Aufbau: Nguyên lý Aufbau quy định rằng các electron sẽ điền vào các orbital từ mức năng lượng thấp đến cao. Trình tự điền electron tuân theo chuỗi mức năng lượng: \[1s \rightarrow 2s \rightarrow 2p \rightarrow 3s \rightarrow 3p \rightarrow 4s \rightarrow 3d \rightarrow 4p \rightarrow 5s \rightarrow 4d \rightarrow 5p \rightarrow 6s \rightarrow 4f \rightarrow 5d \rightarrow 6p \rightarrow 7s\].
Việc áp dụng ba nguyên lý này không chỉ giúp xác định cấu hình electron cho các nguyên tử mà còn giúp hiểu rõ hơn về tính chất hóa học của chúng. Đối với cấu hình electron 4d10, các nguyên tử tuân theo các nguyên lý này để đạt được cấu hình ổn định nhất.

3. Cấu hình electron của các nguyên tố có 4d10
Cấu hình electron 4d10 thường xuất hiện ở các nguyên tố thuộc nhóm kim loại chuyển tiếp, đặc biệt là ở chu kỳ thứ 5 của bảng tuần hoàn. Những nguyên tố này có phân lớp d được lấp đầy hoàn toàn với 10 electron, tạo nên sự ổn định đáng kể. Dưới đây là cấu hình electron chi tiết của một số nguyên tố với cấu hình 4d10.
- Bạc (Ag): Bạc, với số hiệu nguyên tử Z = 47, có cấu hình electron là \[\text{Ag: } [Kr] 4d^{10} 5s^1\]. Mặc dù lớp 5s chỉ có 1 electron, cấu hình 4d10 mang lại sự ổn định cao do phân lớp d đã được lấp đầy.
- Cadmium (Cd): Cadmium, với số hiệu nguyên tử Z = 48, có cấu hình electron là \[\text{Cd: } [Kr] 4d^{10} 5s^2\]. Cấu hình này cho thấy lớp 5s có 2 electron và phân lớp d được lấp đầy hoàn toàn, làm cho cadmium trở nên ít phản ứng hơn.
- Palladium (Pd): Palladium, với số hiệu nguyên tử Z = 46, có cấu hình electron đặc biệt \[\text{Pd: } [Kr] 4d^{10}\]. Đây là một trong số ít nguyên tố mà cấu hình electron không có electron trong phân lớp s của lớp ngoài cùng, thay vào đó tất cả 10 electron đều nằm trong phân lớp d.
Những nguyên tố có cấu hình 4d10 đều thể hiện các tính chất hóa học đặc biệt, chẳng hạn như độ ổn định cao, tính khử mạnh (đối với bạc), và khả năng tạo hợp chất phức tạp. Sự ổn định này là kết quả của việc phân lớp d được lấp đầy hoàn toàn, làm giảm năng lượng tổng thể của nguyên tử.

4. Sự ổn định của cấu hình 4d10
Cấu hình electron 4d10 được xem là rất ổn định vì toàn bộ phân lớp d đã được lấp đầy với 10 electron. Điều này dẫn đến sự đối xứng điện tử trong phân lớp, giúp giảm thiểu sự tương tác giữa các electron và mang lại mức năng lượng thấp nhất có thể cho nguyên tử.
Nguyên lý ổn định này có thể được giải thích qua một số yếu tố sau:
- Sự đối xứng trong phân lớp d: Khi phân lớp d được lấp đầy hoàn toàn với 10 electron, các electron này có thể sắp xếp một cách đối xứng, làm giảm tối đa lực đẩy giữa chúng. Điều này giúp nguyên tử đạt được trạng thái năng lượng tối thiểu và tạo nên sự ổn định vượt trội.
- Giảm năng lượng tương tác: Sự lấp đầy hoàn toàn phân lớp d không chỉ mang lại đối xứng mà còn giảm năng lượng tương tác giữa các electron. Lực đẩy giữa các electron trong cùng một phân lớp giảm đi, dẫn đến một cấu hình năng lượng thấp và bền vững hơn.
- Tác động của mức năng lượng: Khi phân lớp d được lấp đầy, mức năng lượng của nguyên tử trở nên ổn định hơn so với khi phân lớp này chưa được lấp đầy. Điều này giải thích tại sao các nguyên tố có cấu hình 4d10 như bạc (Ag) và cadmium (Cd) ít phản ứng hơn so với các nguyên tố khác trong cùng chu kỳ.
Sự ổn định của cấu hình 4d10 không chỉ làm giảm khả năng tham gia phản ứng hóa học của nguyên tử mà còn quyết định nhiều đặc tính vật lý khác của các nguyên tố này, bao gồm độ cứng, độ dẫn điện, và tính chất quang học.

5. Ứng dụng của các nguyên tố có cấu hình 4d10
Các nguyên tố có cấu hình electron 4d10 như bạc (Ag), cadmium (Cd), và palladium (Pd) có nhiều ứng dụng quan trọng trong nhiều lĩnh vực khác nhau. Nhờ vào tính ổn định và đặc tính vật lý độc đáo, các nguyên tố này đóng vai trò quan trọng trong công nghiệp, y học và điện tử.
- Bạc (Ag):
- Trong công nghiệp: Bạc được sử dụng rộng rãi trong sản xuất gương, chất phủ bề mặt, và pin mặt trời do tính dẫn điện và phản xạ ánh sáng tốt.
- Trong y học: Bạc có tính chất kháng khuẩn mạnh, vì vậy nó được sử dụng trong sản xuất băng vết thương và các thiết bị y tế khác.
- Trong điện tử: Với khả năng dẫn điện tốt nhất trong tất cả các kim loại, bạc được sử dụng trong các linh kiện điện tử và kết nối điện.
- Cadmium (Cd):
- Trong công nghiệp: Cadmium được sử dụng trong sản xuất pin nickel-cadmium, lớp phủ chống ăn mòn, và các hợp kim chịu nhiệt.
- Trong điện tử: Cadmium sulfide (CdS) là vật liệu quan trọng trong các tế bào quang điện và điốt phát quang (LED).
- Palladium (Pd):
- Trong công nghiệp: Palladium được sử dụng rộng rãi trong ngành công nghiệp ô tô, đặc biệt là trong bộ chuyển đổi xúc tác, giúp giảm khí thải độc hại từ xe cộ.
- Trong điện tử: Palladium được sử dụng trong các tiếp điểm điện và trong sản xuất tụ điện, nhờ vào khả năng chống ăn mòn và dẫn điện tốt.
- Trong trang sức: Palladium được sử dụng như một kim loại quý trong chế tác trang sức, thay thế cho bạch kim nhờ độ cứng cao và giá thành hợp lý hơn.
Nhờ vào cấu hình electron ổn định và các đặc tính vật lý, các nguyên tố có cấu hình 4d10 đóng vai trò quan trọng trong nhiều lĩnh vực công nghiệp và đời sống hàng ngày, từ việc bảo vệ sức khỏe cho đến phát triển công nghệ hiện đại.
XEM THÊM:
6. Hướng dẫn cách viết cấu hình electron 4d10
Cấu hình electron cho các nguyên tố có phân lớp 4d10, như bạc (Ag) và cadmium (Cd), được xác định theo nguyên lý phân bố electron vào các obitan dựa trên các quy tắc cơ bản trong hóa học như nguyên lý Aufbau, nguyên lý Pauli, và quy tắc Hund. Dưới đây là hướng dẫn từng bước để viết cấu hình electron 4d10.
6.1 Các bước viết cấu hình electron
- Bước 1: Bắt đầu bằng cách điền các electron vào các obitan theo thứ tự tăng dần của mức năng lượng. Khởi đầu với obitan 1s, chứa tối đa 2 electron.
- Bước 2: Tiếp tục điền vào obitan 2s với 2 electron, sau đó là obitan 2p với 6 electron để hoàn thành mức năng lượng thứ hai.
- Bước 3: Điền tiếp vào obitan 3s với 2 electron, sau đó là 3p với 6 electron. Mức năng lượng thứ ba được hoàn thành bằng việc điền 10 electron vào obitan 3d.
- Bước 4: Điền 2 electron vào obitan 4s, tiếp đến là 6 electron vào obitan 4p.
- Bước 5: Điền 10 electron vào obitan 4d. Đây là đặc điểm chính của các nguyên tố thuộc phân lớp 4d10 như bạc và cadmium.
- Bước 6: Điền 1 electron cuối cùng vào obitan 5s đối với bạc (Ag), hoặc điền 2 electron vào obitan 5s đối với cadmium (Cd).
6.2 Ví dụ thực tiễn
Ví dụ, để viết cấu hình electron của bạc (Ag), chúng ta thực hiện như sau:
- Obitan 1s: \(2\)
- Obitan 2s: \(2\)
- Obitan 2p: \(6\)
- Obitan 3s: \(2\)
- Obitan 3p: \(6\)
- Obitan 4s: \(2\)
- Obitan 3d: \(10\)
- Obitan 4p: \(6\)
- Obitan 4d: \(10\)
- Obitan 5s: \(1\)
Vậy, cấu hình electron của bạc (Ag) là: \[ \text{[Kr]} \, 4d^{10} \, 5s^1 \]. Ký hiệu [Kr] đại diện cho cấu hình đầy đủ của các lớp bên trong đến nguyên tố krypton (Kr), và các electron trong phân lớp 4d và 5s là lớp ngoài cùng.
Nhờ vào việc hiểu và áp dụng đúng các nguyên tắc và quy tắc này, ta có thể dễ dàng viết được cấu hình electron cho bất kỳ nguyên tố nào, đặc biệt là những nguyên tố có phân lớp 4d10, từ đó hiểu rõ hơn về tính chất hóa học và các ứng dụng của chúng.