Chủ đề 1 mole electron mass: Khám phá khái niệm "1 mole electron mass" và tìm hiểu về khối lượng của electron trong lĩnh vực khoa học. Bài viết này sẽ cung cấp cho bạn những kiến thức cần thiết về cách tính khối lượng của 1 mole electron và những ứng dụng thực tế trong cuộc sống cũng như trong nghiên cứu khoa học.
Mục lục
Một Mole Electron và Khối Lượng của Nó
Trong hóa học và vật lý, khái niệm "mole" là một trong những đơn vị cơ bản để đo lượng chất. Đặc biệt, khi nói đến 1 mole electron, chúng ta đang nói đến một lượng electron có số lượng là Số Avogadro, khoảng \(6.022 \times 10^{23}\) electron.
Khối Lượng của 1 Mole Electron
Khối lượng của 1 electron đơn lẻ là khoảng \(9.109 \times 10^{-31}\) kg. Để tính khối lượng của 1 mole electron, chúng ta nhân khối lượng của một electron với số Avogadro:
\[
\text{Khối lượng của 1 mole electron} = 9.109 \times 10^{-31} \, \text{kg} \times 6.022 \times 10^{23} = 5.48 \times 10^{-7} \, \text{kg}
\]
Như vậy, khối lượng của 1 mole electron xấp xỉ 0.548 mg.
Tính Chất và Ứng Dụng
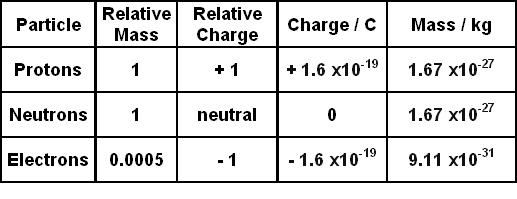
- Tính chất cơ bản: Electron là hạt mang điện âm, với điện tích đơn vị là \(1.602 \times 10^{-19}\) coulomb. Khối lượng của chúng rất nhỏ nhưng đóng vai trò quan trọng trong các phản ứng hóa học và vật lý.
- Ứng dụng trong đời sống: Khối lượng của electron tuy nhỏ nhưng hiểu rõ về nó giúp chúng ta hiểu được các hiện tượng như dòng điện, tính chất của vật liệu bán dẫn, và cơ chế của nhiều phản ứng hóa học.
Các Phương Pháp Tính Toán
Để tính toán khối lượng của các hạt hay lượng chất khác, người ta thường sử dụng công thức:
\[
\text{Số mol} = \frac{\text{Khối lượng chất (g)}}{\text{Khối lượng mol (g/mol)}}
\]
Với công thức này, nếu biết khối lượng mol của một chất, ta có thể dễ dàng tính được số mol của nó, và ngược lại.
Ví Dụ Minh Họa
Giả sử chúng ta có 1.75 mole \(S_{2}Cl_{2}\), chúng ta có thể tính khối lượng của nó như sau:
\[
\text{Khối lượng} = 1.75 \, \text{mol} \times 135.036 \, \text{g/mol} = 236.31 \, \text{g}
\]
Hy vọng rằng thông tin trên đã cung cấp cho bạn cái nhìn tổng quan về khối lượng của 1 mole electron và các ứng dụng liên quan trong khoa học.

.png)
1. Định Nghĩa và Khái Niệm về Mole trong Hóa Học
Trong hóa học, "mole" là một đơn vị đo lường quan trọng dùng để biểu thị số lượng hạt cơ bản như nguyên tử, phân tử, ion, hay electron trong một mẫu chất. Một mole bất kỳ chất nào chứa đúng số lượng hạt là Số Avogadro, khoảng \(6.022 \times 10^{23}\) hạt.
Số Avogadro được định nghĩa dựa trên số lượng nguyên tử có trong 12 gram đồng vị carbon-12. Điều này có nghĩa là một mole của bất kỳ chất nào, cho dù là nguyên tử, phân tử, hay electron, đều có cùng số lượng hạt như trong 12 gram carbon-12.
Công thức tổng quát để tính số mole (n) của một chất là:
\[
n = \frac{\text{m}}{\text{M}}
\]
Trong đó:
- n: Số mole của chất.
- m: Khối lượng của mẫu chất (tính bằng gram).
- M: Khối lượng mol của chất (tính bằng g/mol).
Ví dụ, nếu bạn có 18 gram nước (H2O), với khối lượng mol của nước là 18 g/mol, bạn sẽ có:
\[
n = \frac{18 \text{g}}{18 \text{g/mol}} = 1 \text{ mole}
\]
Do đó, trong 18 gram nước sẽ chứa \(6.022 \times 10^{23}\) phân tử nước.
2. Khối Lượng của 1 Mole Electron
Khối lượng của 1 mole electron là một khái niệm quan trọng trong vật lý và hóa học. Để hiểu rõ hơn về khối lượng này, trước tiên chúng ta cần biết khối lượng của một electron đơn lẻ. Một electron có khối lượng xấp xỉ \(9.109 \times 10^{-31}\) kg.
Với 1 mole electron, số lượng electron là bằng với số Avogadro, khoảng \(6.022 \times 10^{23}\) hạt. Do đó, khối lượng của 1 mole electron có thể được tính bằng cách nhân khối lượng của một electron với số Avogadro:
\[
\text{Khối lượng của 1 mole electron} = 9.109 \times 10^{-31} \, \text{kg} \times 6.022 \times 10^{23} = 5.48 \times 10^{-7} \, \text{kg}
\]
Khối lượng này tương đương khoảng 0.548 mg. Dù nhỏ bé, nhưng khối lượng của electron đóng vai trò quan trọng trong việc tính toán và nghiên cứu các phản ứng hóa học và hiện tượng vật lý.
Trong các ứng dụng thực tế, khối lượng của 1 mole electron thường được sử dụng để tính toán trong các phản ứng oxi hóa-khử, nơi mà electron được chuyển giao giữa các chất phản ứng. Điều này giúp các nhà khoa học và kỹ sư xác định chính xác lượng chất cần thiết cho các phản ứng mong muốn.
Hơn nữa, hiểu biết về khối lượng của 1 mole electron còn giúp chúng ta nghiên cứu sâu hơn về cấu trúc của nguyên tử, cách các electron di chuyển và tương tác, từ đó có thể ứng dụng vào việc phát triển công nghệ điện tử và vật liệu mới.

3. Tính Chất và Ứng Dụng của Electron
Electron là một trong những hạt cơ bản quan trọng nhất trong vật lý và hóa học. Electron mang điện tích âm và có khối lượng rất nhỏ, khoảng \(9.109 \times 10^{-31}\) kg. Những tính chất này giúp electron đóng vai trò thiết yếu trong nhiều hiện tượng tự nhiên và ứng dụng công nghệ.
Tính Chất Cơ Bản của Electron
- Điện tích: Electron có điện tích âm với giá trị tuyệt đối là \(1.602 \times 10^{-19}\) coulomb, đối nghịch với điện tích dương của proton.
- Khối lượng: Electron có khối lượng rất nhỏ, nhưng dù vậy, nó vẫn có ảnh hưởng lớn đến động học của nguyên tử và phân tử.
- Chuyển động: Electron chuyển động quanh hạt nhân nguyên tử trong các quỹ đạo khác nhau, điều này quyết định nhiều tính chất hóa học của nguyên tử.
- Nguyên lý bất định Heisenberg: Vị trí và động lượng của electron không thể được xác định đồng thời với độ chính xác tuyệt đối, điều này tạo ra những đặc điểm đặc biệt trong hành vi của electron ở cấp độ lượng tử.
Ứng Dụng của Electron trong Thực Tiễn
Electron không chỉ là thành phần cơ bản của nguyên tử mà còn có nhiều ứng dụng quan trọng trong công nghệ và đời sống:
- Công nghệ điện tử: Electron là nền tảng của mọi thiết bị điện tử, từ bóng bán dẫn đến vi mạch trong máy tính và điện thoại.
- Năng lượng: Electron tham gia vào quá trình sinh ra điện năng trong các pin và tế bào nhiên liệu, cũng như trong quá trình truyền tải điện qua dây dẫn.
- Phản ứng hóa học: Các phản ứng oxi hóa-khử, trong đó electron được chuyển từ chất này sang chất khác, là cơ sở của nhiều quá trình hóa học quan trọng, bao gồm cả quá trình trao đổi chất trong cơ thể sống.
- Ứng dụng trong y học: Electron được sử dụng trong các phương pháp chẩn đoán và điều trị, như trong máy chụp cắt lớp vi tính (CT) và liệu pháp xạ trị ung thư.
Nhờ vào những tính chất đặc biệt và ứng dụng rộng rãi, electron là một trong những hạt cơ bản có tầm quan trọng hàng đầu trong khoa học và công nghệ.

4. Ví Dụ Minh Họa và Bài Tập Thực Hành
Để củng cố kiến thức về khối lượng của 1 mole electron và các ứng dụng của nó trong hóa học, chúng ta sẽ xem qua một số ví dụ minh họa và bài tập thực hành. Những bài tập này giúp bạn hiểu rõ hơn về cách tính toán và áp dụng các khái niệm đã học.
4.1 Ví Dụ Minh Họa
Ví dụ 1: Tính khối lượng của 0.5 mole electron.
Bước 1: Khối lượng của 1 mole electron là \(5.48 \times 10^{-7}\) kg.
Bước 2: Sử dụng công thức:
\[
\text{Khối lượng} = 0.5 \times 5.48 \times 10^{-7} \, \text{kg} = 2.74 \times 10^{-7} \, \text{kg}
\]
Vậy khối lượng của 0.5 mole electron là \(2.74 \times 10^{-7}\) kg.
Ví dụ 2: Tính số electron trong 0.2 gram electron.
Bước 1: Khối lượng của 1 mole electron là \(5.48 \times 10^{-7}\) kg.
Bước 2: Sử dụng công thức số mole:
\[
n = \frac{m}{M} = \frac{0.2 \times 10^{-3} \, \text{kg}}{5.48 \times 10^{-7} \, \text{kg/mol}} \approx 3.65 \times 10^2 \, \text{mole}
\]
Bước 3: Số electron trong 0.2 gram electron:
\[
\text{Số electron} = 3.65 \times 10^2 \times 6.022 \times 10^{23} \approx 2.2 \times 10^{26} \, \text{electron}
\]
Vậy trong 0.2 gram electron có khoảng \(2.2 \times 10^{26}\) electron.
4.2 Bài Tập Thực Hành
- Tính khối lượng của 2 mole electron. Gợi ý: Sử dụng công thức khối lượng đã học.
- Một phản ứng hóa học sử dụng 1.5 mole electron. Tính khối lượng electron tham gia vào phản ứng.
- Tính số mole electron trong 10 mg electron. Gợi ý: Sử dụng công thức số mole và khối lượng electron.
- Cho rằng bạn có \(1.5 \times 10^{-7}\) kg electron. Tính số electron có trong khối lượng này.
Những bài tập trên giúp bạn làm quen với các phép tính cơ bản liên quan đến khối lượng và số mole electron, từ đó giúp bạn nắm vững hơn kiến thức lý thuyết đã học.

5. Tổng Kết và Kết Luận
Qua các phần trên, chúng ta đã tìm hiểu về khái niệm "mole" trong hóa học, cách tính toán khối lượng của 1 mole electron, cùng với các tính chất và ứng dụng quan trọng của electron. Những kiến thức này không chỉ giúp chúng ta hiểu rõ hơn về thế giới vi mô của nguyên tử và phân tử mà còn mở ra nhiều ứng dụng trong khoa học và công nghệ.
Việc nắm vững các khái niệm như khối lượng của 1 mole electron giúp chúng ta dễ dàng tiếp cận các vấn đề phức tạp hơn trong hóa học và vật lý. Từ những tính chất cơ bản của electron, chúng ta có thể ứng dụng trong nhiều lĩnh vực như công nghệ điện tử, năng lượng, và y học. Các ví dụ minh họa và bài tập thực hành đã cung cấp một cái nhìn cụ thể về cách áp dụng những khái niệm này vào thực tế.
Tóm lại, electron không chỉ là một hạt cơ bản mà còn là yếu tố quan trọng trong việc hiểu và ứng dụng khoa học. Hiểu biết sâu về electron và các khái niệm liên quan không chỉ giúp chúng ta trong học tập mà còn trong nghiên cứu và phát triển công nghệ mới.