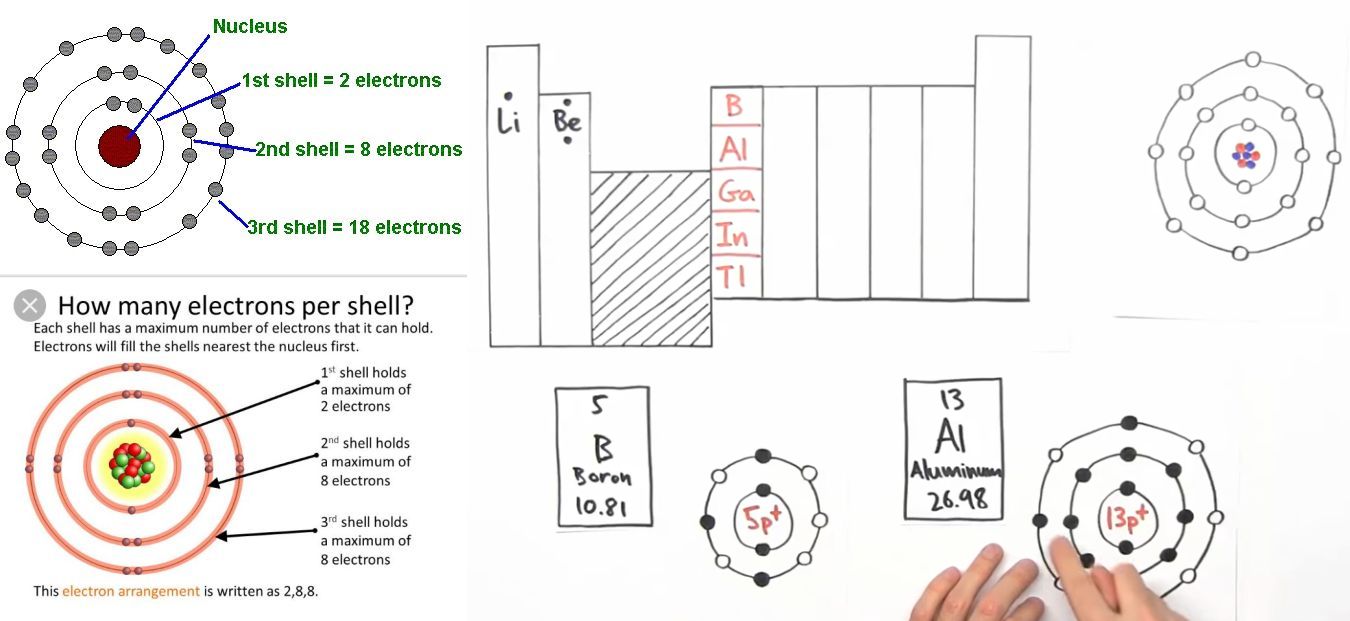
Chủ đề 3d electron configuration: Cấu hình electron 3D là khái niệm quan trọng trong hóa học giúp chúng ta hiểu rõ hơn về cấu trúc và tính chất của các nguyên tố hóa học. Bài viết này sẽ đi sâu vào cách viết cấu hình electron 3D, cách phân loại nguyên tố theo các phân lớp s, p, d, f, và ứng dụng của mô hình này trong việc giải thích các hiện tượng hóa học. Hãy cùng khám phá những bí mật thú vị của thế giới vi mô qua cấu hình electron 3D.
Mục lục
- Cấu Hình Electron 3D
- 1. Giới thiệu về cấu hình electron
- 2. Nguyên tắc sắp xếp electron
- 3. Các bước viết cấu hình electron cho nguyên tố
- 4. Cấu hình electron 3d và các nguyên tố d
- 5. Trường hợp đặc biệt trong cấu hình electron 3d
- 6. Ứng dụng của cấu hình electron trong hóa học
- 7. Mô hình hóa cấu hình electron bằng 3D
- 8. Kết luận
Cấu Hình Electron 3D
Cấu hình electron là sự sắp xếp của các electron trong một nguyên tử. Đối với các nguyên tố thuộc nhóm chuyển tiếp, việc xác định cấu hình electron trở nên quan trọng do ảnh hưởng đến các tính chất hóa học và vật lý của nguyên tố đó.
Cấu hình electron của các nguyên tố nhóm chuyển tiếp
Các nguyên tố nhóm chuyển tiếp có đặc điểm chung là các electron lấp đầy vào lớp vỏ d và f. Ví dụ, cấu hình electron của nguyên tố Vanadi (V) có số thứ tự 23 như sau:
V: [Ar] 3d³ 4s²
Cấu hình electron của một số nguyên tố
- Chromium (Cr): \([Ar] 3d^5 4s^1\)
- Copper (Cu): \([Ar] 3d^{10} 4s^1\)
- Titanium (Ti): \([Ar] 3d^2 4s^2\)
- Osmium (Os): \([Xe] 4f^{14} 5d^6 6s^2\)
Những ngoại lệ trong cấu hình electron
Một số nguyên tố như Chromium (Cr) và Copper (Cu) có cấu hình electron không theo quy tắc điền electron thông thường. Điều này do sự ổn định đặc biệt khi có cấu hình bán đầy hoặc đầy đủ trong phân lớp d:
- Chromium (Cr): Có cấu hình \([Ar] 3d^5 4s^1\) thay vì \([Ar] 3d^4 4s^2\).
- Copper (Cu): Có cấu hình \([Ar] 3d^{10} 4s^1\) thay vì \([Ar] 3d^9 4s^2\).
Ý nghĩa của cấu hình electron
Cấu hình electron giúp chúng ta hiểu được tính chất hóa học của các nguyên tố, bao gồm khả năng phản ứng và liên kết với các nguyên tố khác. Đặc biệt, các nguyên tố chuyển tiếp có tính chất linh hoạt nhờ vào các electron ở phân lớp d, điều này ảnh hưởng trực tiếp đến màu sắc, từ tính và tính dẫn điện của chúng.
Bảng tổng hợp cấu hình electron của các nguyên tố chuyển tiếp
| Nguyên tố | Ký hiệu | Cấu hình electron |
|---|---|---|
| Vanadi | V | [Ar] 3d³ 4s² |
| Chromium | Cr | [Ar] 3d⁵ 4s¹ |
| Copper | Cu | [Ar] 3d¹⁰ 4s¹ |
| Titanium | Ti | [Ar] 3d² 4s² |
Những kiến thức này giúp ích trong việc nghiên cứu và ứng dụng trong các lĩnh vực như hóa học, vật liệu và công nghệ tiên tiến.
.png)
1. Giới thiệu về cấu hình electron
Cấu hình electron là cách sắp xếp các electron xung quanh hạt nhân của nguyên tử, tuân theo các nguyên lý và quy tắc cụ thể như nguyên lý Pauli, quy tắc Hund và nguyên lý Aufbau. Quá trình viết cấu hình electron giúp xác định vị trí của các electron trong các lớp và phân lớp khác nhau, từ đó ảnh hưởng đến tính chất hóa học của nguyên tố.
Ví dụ, nguyên tố sắt (Fe) có số hiệu nguyên tử là 26. Cấu hình electron của nó được viết theo thứ tự mức năng lượng tăng dần: 1s2 2s2 2p6 3s2 3p6 3d6 4s2. Trong trường hợp của các ion, như Fe2+ và Fe3+, cấu hình electron thay đổi khi mất đi các electron, ảnh hưởng đến mức độ bền vững và phản ứng hóa học.
Các bước cơ bản để viết cấu hình electron gồm:
- Xác định số electron của nguyên tử (Z).
- Sắp xếp các electron theo thứ tự tăng dần mức năng lượng: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, ...
- Viết cấu hình electron, sắp xếp theo lớp và phân lớp.
Một số nguyên tố có cấu hình đặc biệt do hiện tượng bán bão hòa, như Cr và Cu, trong đó các electron được sắp xếp để đạt được sự ổn định cao nhất.
2. Nguyên tắc sắp xếp electron
Việc sắp xếp các electron trong các nguyên tử tuân theo một số nguyên tắc cơ bản để xác định cấu hình electron. Những nguyên tắc này giúp chúng ta hiểu rõ hơn về cách các electron được phân bố trong các lớp và phân lớp, từ đó dự đoán được tính chất hóa học của các nguyên tố.
- Nguyên tắc cấu hình electron: Electron được sắp xếp vào các mức năng lượng từ thấp đến cao. Điều này có nghĩa là các electron sẽ lấp đầy các phân lớp có mức năng lượng thấp trước khi điền vào các phân lớp có mức năng lượng cao hơn. Ví dụ: phân lớp 1s sẽ được lấp đầy trước phân lớp 2s.
- Nguyên tắc Pauli (Nguyên lý loại trừ của Pauli): Một phân lớp không thể chứa hơn hai electron, và hai electron trong cùng một phân lớp phải có spin ngược nhau. Điều này giúp tránh sự xung đột năng lượng trong cùng một phân lớp.
- Quy tắc Hund: Trong trường hợp các electron được thêm vào các orbital có cùng mức năng lượng (các orbital suy biến), electron sẽ được điền vào các orbital riêng biệt với cùng chiều spin trước khi điền vào orbital đã có electron. Điều này tạo ra sự ổn định tối đa cho nguyên tử.
Ví dụ, đối với cấu hình của các nguyên tố chuyển tiếp như sắt (Fe), chúng ta có cấu hình electron: \[ 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^6 \]. Trong trường hợp này, các electron được điền vào phân lớp 4s trước rồi mới đến 3d, mặc dù 3d có mức năng lượng cao hơn một chút.
Những nguyên tắc này không chỉ giúp xác định cấu hình electron mà còn giải thích được nhiều tính chất hóa học và vật lý của các nguyên tố, ví dụ như tính chất kim loại, phi kim, và khả năng hình thành liên kết hóa học.

3. Các bước viết cấu hình electron cho nguyên tố
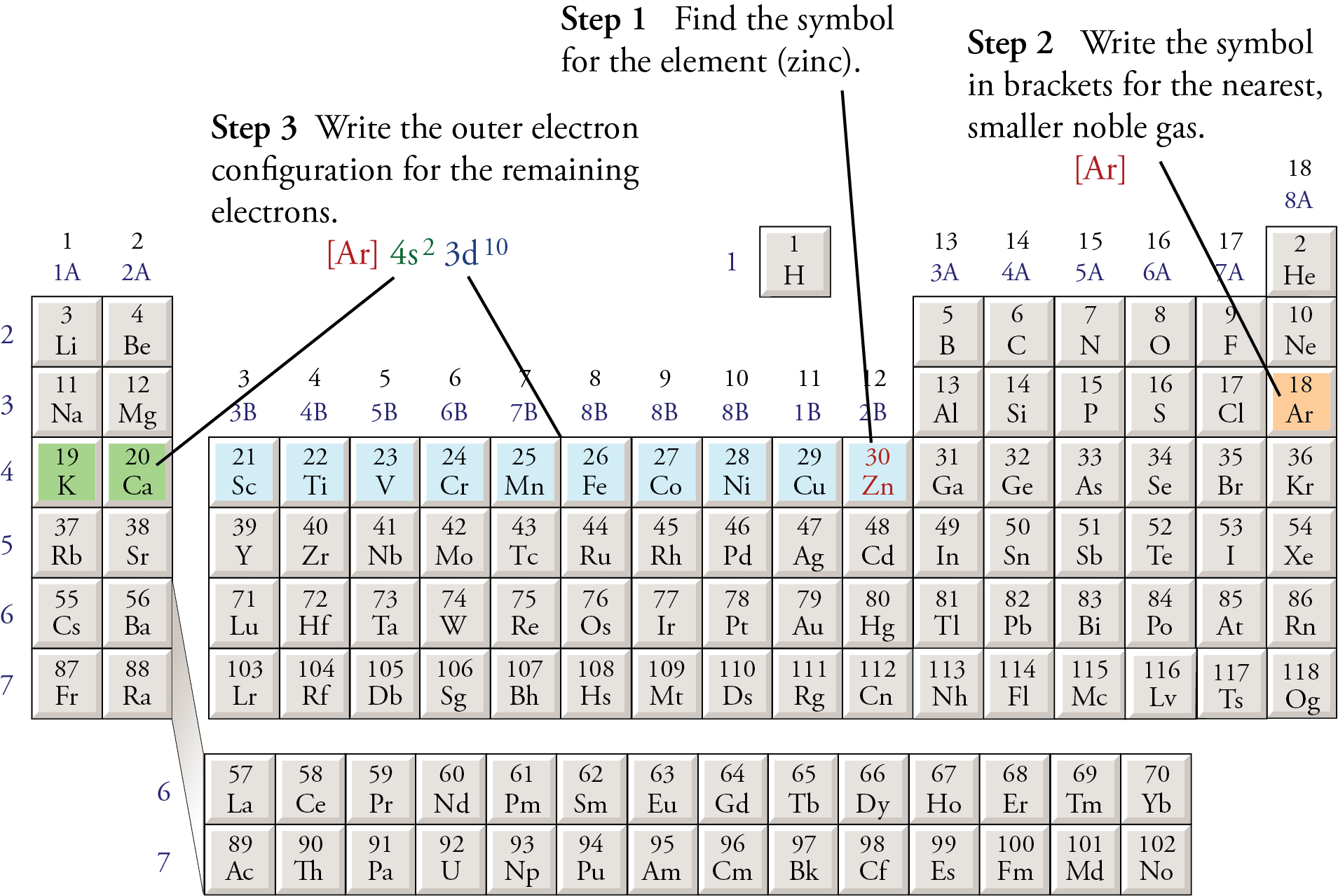
Viết cấu hình electron cho một nguyên tố hóa học là một bước quan trọng để hiểu rõ hơn về tính chất hóa học của nó. Dưới đây là các bước cơ bản để viết cấu hình electron một cách chính xác và hiệu quả.
- Xác định số electron của nguyên tử: Đầu tiên, bạn cần xác định số electron của nguyên tử đó, thường tương đương với số hiệu nguyên tử \( Z \). Ví dụ, đối với nguyên tố sắt (Fe) có số hiệu nguyên tử là 26, số electron của nó cũng là 26.
- Sắp xếp electron theo thứ tự mức năng lượng: Sử dụng quy tắc Aufbau, bạn cần sắp xếp các electron theo thứ tự tăng dần của mức năng lượng. Thứ tự thường là 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, v.v. Ví dụ, với nguyên tố Fe, cấu hình electron sẽ bắt đầu từ 1s2 đến khi các electron được sắp xếp hết.
- Viết cấu hình electron: Sau khi sắp xếp electron theo mức năng lượng, bạn sẽ viết cấu hình electron đầy đủ cho nguyên tử. Với Fe, cấu hình electron đầy đủ sẽ là \( 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^6 \). Để đơn giản hóa, có thể viết gọn thành \([Ar] 3d^6 4s^2\), trong đó \([Ar]\) đại diện cho cấu hình electron của nguyên tố argon.
Việc nắm vững các bước này giúp bạn hiểu rõ hơn về cách các electron phân bố trong nguyên tử, từ đó có thể dự đoán được tính chất hóa học và khả năng phản ứng của các nguyên tố.

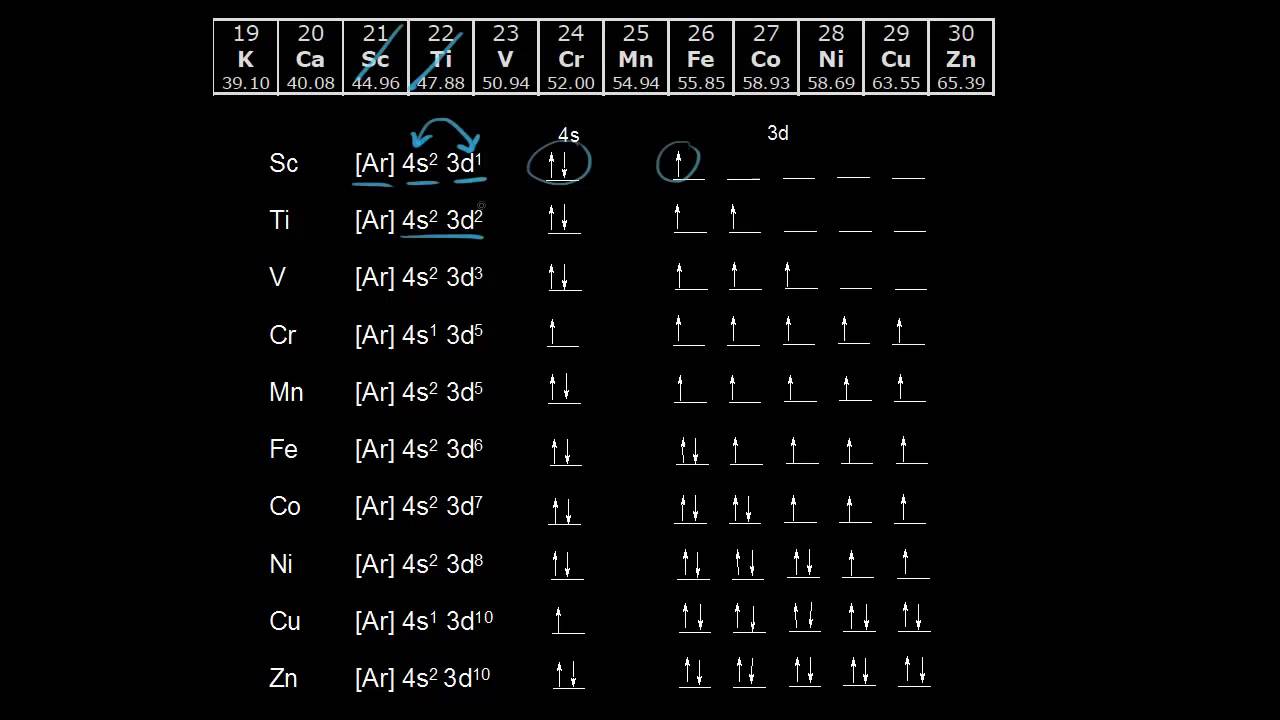
4. Cấu hình electron 3d và các nguyên tố d
Các nguyên tố thuộc khối d được gọi là các nguyên tố chuyển tiếp, và chúng có electron cuối cùng điền vào phân lớp d. Đặc biệt, phân lớp 3d có thể chứa tối đa 10 electron, tạo nên những đặc tính hóa học đặc trưng của các nguyên tố này. Việc hiểu rõ cấu hình electron của các nguyên tố d là vô cùng quan trọng, bởi nó không chỉ giúp dự đoán được tính chất hóa học mà còn ứng dụng trong nhiều lĩnh vực như vật liệu học và hóa học phức chất.
- Vị trí của các nguyên tố d: Các nguyên tố d nằm ở nhóm 3 đến nhóm 12 trong bảng tuần hoàn.
- Phân lớp 3d: Phân lớp 3d có thể chứa tối đa 10 electron, được điền đầy đủ sau khi phân lớp 4s đã được điền electron.
- Ví dụ cấu hình electron:
- Scandi (Sc): \[ \text{[Ar]} 3d^1 4s^2 \]
- Titan (Ti): \[ \text{[Ar]} 3d^2 4s^2 \]
- Chrom (Cr): Cấu hình đặc biệt \[ \text{[Ar]} 3d^5 4s^1 \]
- Các quy tắc đặc biệt: Một số nguyên tố có cấu hình electron không tuân theo thứ tự thông thường, nhằm đạt trạng thái bền vững hơn (ví dụ, Cr và Cu có cấu hình bán bão hòa và bão hòa tại phân lớp 3d).
Nhờ vào khả năng tham gia vào các liên kết hóa học khác nhau và hình thành các phức chất, các nguyên tố d có vai trò quan trọng trong nhiều ngành công nghiệp, đặc biệt là trong chế tạo vật liệu và xúc tác.

5. Trường hợp đặc biệt trong cấu hình electron 3d
Trong cấu hình electron, có một số nguyên tố chuyển tiếp với số hiệu nguyên tử gần nhau nhưng lại có cấu hình electron khác thường. Những trường hợp này thường xảy ra do nguyên tử muốn đạt được trạng thái bền vững hơn thông qua việc sắp xếp lại electron. Các nguyên tố chuyển tiếp, đặc biệt là trong dãy 3d, thường có các trạng thái bán bão hòa và bão hòa, giúp tăng sự ổn định.
- Đặc điểm bán bão hòa: Các cấu hình electron có phân lớp 3d hoặc 4s gần bão hòa sẽ có xu hướng thay đổi để đạt được trạng thái bán bão hòa. Ví dụ, trong nguyên tử Crom (Cr) với số hiệu nguyên tử 24, cấu hình dự kiến sẽ là \([Ar] 3d^4 4s^2\), nhưng để đạt trạng thái bán bão hòa, cấu hình thực tế là \([Ar] 3d^5 4s^1\).
- Đặc điểm bão hòa: Một số nguyên tố có xu hướng sắp xếp lại electron để đạt trạng thái bão hòa. Như trong trường hợp của đồng (Cu) với số hiệu nguyên tử 29, cấu hình dự kiến là \([Ar] 3d^9 4s^2\), nhưng thực tế là \([Ar] 3d^{10} 4s^1\) để đạt cấu hình bão hòa cho phân lớp 3d.
Những điều chỉnh này là kết quả của sự ổn định năng lượng mà chúng mang lại. Các trạng thái bán bão hòa (như d5) và bão hòa (như d10) giúp giảm tổng năng lượng của nguyên tử, làm cho chúng bền hơn. Do đó, khi viết cấu hình electron cho các nguyên tố thuộc nhóm d, cần chú ý đến các trường hợp đặc biệt này.
| Nguyên tố | Cấu hình dự kiến | Cấu hình thực tế |
|---|---|---|
| Crom (Cr) | [Ar] 3d4 4s2 | [Ar] 3d5 4s1 |
| Đồng (Cu) | [Ar] 3d9 4s2 | [Ar] 3d10 4s1 |
XEM THÊM:
6. Ứng dụng của cấu hình electron trong hóa học
Việc hiểu rõ cấu hình electron, đặc biệt là cấu hình 3d, đóng vai trò quan trọng trong nhiều lĩnh vực hóa học. Nó giúp giải thích sự hình thành của liên kết hóa học, tính chất hóa học của các nguyên tố và cách thức chúng phản ứng với nhau.
Cấu hình electron cho biết sự phân bố của các electron trong các lớp vỏ và orbitals xung quanh hạt nhân nguyên tử. Điều này rất quan trọng vì nó ảnh hưởng trực tiếp đến tính chất vật lý và hóa học của nguyên tố, bao gồm:
- Phản ứng hóa học: Cấu hình electron xác định khả năng một nguyên tố có thể nhường, nhận hoặc chia sẻ electron, từ đó hình thành các liên kết hóa học. Ví dụ, sự khác biệt nhỏ trong cấu hình 3d của sắt (\[Fe\]) dẫn đến các trạng thái oxy hóa khác nhau, ảnh hưởng đến cách nó tham gia vào các phản ứng oxy hóa-khử.
- Quang phổ: Sự chuyển đổi của electron giữa các mức năng lượng trong cấu hình 3d có thể giải thích hiện tượng hấp thụ và phát xạ ánh sáng, rất hữu ích trong quang phổ học để xác định cấu trúc và tính chất của các nguyên tố.
- Hợp chất phối trí: Các nguyên tố d, với cấu hình 3d bán điền đầy, có khả năng tạo thành các hợp chất phối trí phức tạp với các ligand, được sử dụng rộng rãi trong hóa học vô cơ và công nghệ.
Như vậy, việc nắm vững cấu hình electron không chỉ giúp chúng ta hiểu sâu hơn về bản chất của các nguyên tố mà còn mở ra nhiều ứng dụng trong nghiên cứu và công nghiệp.

7. Mô hình hóa cấu hình electron bằng 3D
Mô hình hóa cấu hình electron bằng 3D là một công cụ mạnh mẽ giúp chúng ta hình dung cấu trúc electron của nguyên tử và phân tử một cách trực quan và sinh động. Sử dụng mô hình 3D, chúng ta có thể dễ dàng hiểu được cách các electron được sắp xếp xung quanh hạt nhân nguyên tử và cách chúng tương tác với nhau. Dưới đây là các bước để tạo ra một mô hình 3D của cấu hình electron:
7.1 Các loại mô hình nguyên tử 3D phổ biến
- Mô hình lớp vỏ electron: Mô hình này thể hiện các lớp vỏ electron xung quanh hạt nhân, giúp chúng ta hiểu rõ cấu trúc của nguyên tử theo chiều không gian.
- Mô hình đám mây electron: Đám mây electron biểu thị xác suất tìm thấy electron trong các vùng không gian nhất định quanh hạt nhân, giúp minh họa sự phân bố không đồng nhất của electron.
- Mô hình quỹ đạo hình học: Loại mô hình này mô tả hình dạng của các quỹ đạo electron như hình cầu, hình số tám, giúp nắm bắt sự phức tạp trong cấu trúc electron.
7.2 Hướng dẫn làm mô hình nguyên tử 3D
- Chọn phần mềm mô hình hóa 3D: Đầu tiên, cần lựa chọn phần mềm hỗ trợ tạo mô hình 3D như Blender, AutoCAD, hoặc ChemSketch. Những phần mềm này cung cấp công cụ cần thiết để vẽ và chỉnh sửa các đối tượng 3D.
- Thiết kế các quỹ đạo electron: Sử dụng phần mềm, tạo các hình dạng đại diện cho quỹ đạo electron (hình cầu, hình số tám) xung quanh một điểm trung tâm tượng trưng cho hạt nhân.
- Thêm các electron vào quỹ đạo: Đặt các điểm hoặc hình nhỏ trong các quỹ đạo đã vẽ để biểu diễn các electron. Chú ý sắp xếp chúng sao cho tuân thủ các quy tắc cấu hình electron (Aufbau, Pauli, Hund).
- Chỉnh sửa và tối ưu hóa mô hình: Điều chỉnh các kích thước và khoảng cách để đảm bảo mô hình phản ánh chính xác cấu hình electron của nguyên tử. Thêm màu sắc và chi tiết để làm nổi bật các đặc điểm quan trọng.
- Xuất và sử dụng mô hình: Sau khi hoàn thành, mô hình có thể được xuất ra dưới dạng ảnh hoặc tệp 3D để sử dụng trong giáo dục hoặc nghiên cứu khoa học.
7.3 Ứng dụng của mô hình 3D trong giáo dục
Mô hình 3D của cấu hình electron có vai trò quan trọng trong giáo dục hóa học và vật lý. Chúng giúp học sinh và sinh viên:
- Hiểu rõ hơn về cấu trúc nguyên tử: Mô hình 3D cung cấp một cái nhìn trực quan về cách electron được sắp xếp xung quanh hạt nhân, giúp dễ dàng hiểu và ghi nhớ hơn.
- Minh họa các khái niệm trừu tượng: Những khái niệm như orbital, đám mây electron và cấu hình electron trở nên dễ tiếp cận hơn khi được biểu diễn qua mô hình 3D.
- Tăng cường hứng thú học tập: Việc sử dụng công nghệ 3D trong giảng dạy giúp tạo ra môi trường học tập sinh động và hấp dẫn, kích thích sự tò mò và hứng thú của học sinh.

8. Kết luận
Qua bài viết này, chúng ta đã cùng tìm hiểu về cấu hình electron và tầm quan trọng của nó trong việc hiểu rõ cấu trúc và tính chất của các nguyên tố hóa học. Cấu hình electron không chỉ là một khái niệm cơ bản trong hóa học mà còn đóng vai trò then chốt trong việc dự đoán tính chất hóa học, khả năng phản ứng, và liên kết của các nguyên tố. Việc nắm vững quy tắc và cách viết cấu hình electron giúp chúng ta hiểu sâu hơn về bản chất của nguyên tử và các hiện tượng hóa học.
Cấu hình electron 3d là một phần quan trọng của các nguyên tố chuyển tiếp, nơi mà các electron điền vào các phân lớp d. Các nguyên tố này thể hiện nhiều tính chất hóa học và vật lý đặc biệt do sự sắp xếp electron trong phân lớp d. Những trường hợp đặc biệt như cấu hình electron của Crom (Cr) và Đồng (Cu) minh họa cho sự linh hoạt và phức tạp trong cách electron sắp xếp để đạt được trạng thái bền vững nhất.
Hơn nữa, mô hình hóa cấu hình electron bằng công nghệ 3D đã mở ra nhiều hướng nghiên cứu mới, giúp chúng ta trực quan hóa và hiểu rõ hơn về cấu trúc nguyên tử. Các mô hình 3D không chỉ là công cụ giáo dục hữu ích mà còn là nền tảng cho nhiều ứng dụng trong các lĩnh vực khoa học, công nghệ và y học, như trong việc phát triển thuốc mới và nghiên cứu vật liệu mới.
Trong tương lai, với sự tiến bộ của công nghệ và khoa học, việc nghiên cứu cấu hình electron và mô hình hóa cấu trúc nguyên tử sẽ tiếp tục mang lại những khám phá và ứng dụng mới, giúp chúng ta hiểu sâu hơn về thế giới vi mô và khai thác các tiềm năng của nó để phục vụ cho cuộc sống con người.
Tóm lại, việc hiểu rõ cấu hình electron và cách chúng tương tác với nhau là nền tảng quan trọng trong hóa học và nhiều lĩnh vực khoa học khác. Đây không chỉ là kiến thức lý thuyết mà còn là công cụ thực tiễn giúp chúng ta giải quyết nhiều vấn đề trong nghiên cứu và ứng dụng khoa học. Hy vọng bài viết đã mang lại cho bạn những kiến thức bổ ích và cái nhìn toàn diện hơn về cấu hình electron và những ứng dụng của nó.