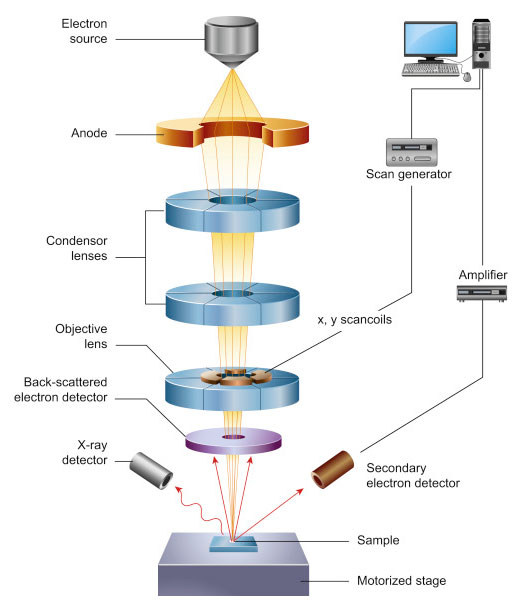
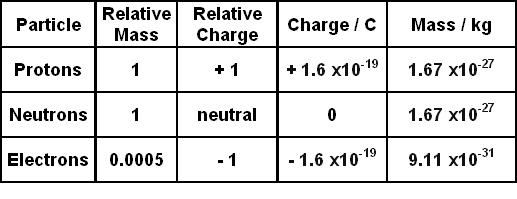
Chủ đề 23 electron configuration: 24 Cr electron configuration là một trong những yếu tố quan trọng để hiểu rõ hơn về cấu hình điện tử của nguyên tố Chrome. Bài viết này sẽ cung cấp cho bạn kiến thức chi tiết và dễ hiểu về cách xác định cấu hình điện tử của nguyên tố này, giúp bạn nắm vững kiến thức trong học tập và nghiên cứu.
Mục lục
- Cấu hình electron của nguyên tố Chromium (Cr)
- 1. Giới thiệu về nguyên tố Crom
- 2. Cấu hình electron của nguyên tử Crom (24 Cr)
- 3. Cấu hình electron của Crom ở các trạng thái oxy hóa khác nhau
- 4. So sánh cấu hình electron của Crom với các nguyên tố khác trong nhóm
- 5. Ứng dụng cấu hình electron của Crom trong thực tiễn
- 6. Câu hỏi thường gặp về cấu hình electron của Crom
Cấu hình electron của nguyên tố Chromium (Cr)
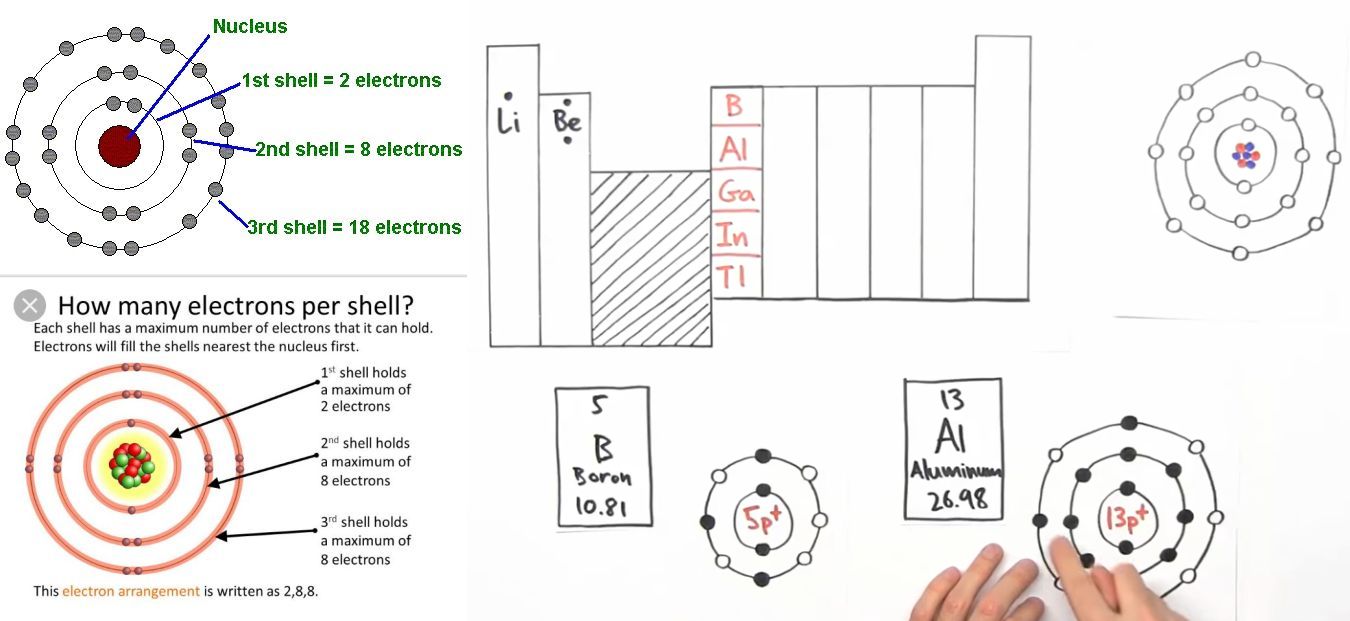
Chromium (Cr) là nguyên tố thuộc nhóm 6 trong bảng tuần hoàn, với số nguyên tử là 24. Cấu hình electron của nó có một đặc điểm thú vị, do sự sắp xếp của các electron ở các phân lớp năng lượng khác nhau.
1. Cấu hình electron chuẩn
Cấu hình electron của Cr không tuân theo quy tắc điền electron Aufbau một cách chặt chẽ như các nguyên tố khác. Thay vì có cấu hình dự kiến là \[1s^2 2s^2 2p^6 3s^2 3p^6 3d^4 4s^2\], Chromium thực tế có cấu hình electron là \[1s^2 2s^2 2p^6 3s^2 3p^6 3d^5 4s^1\]. Điều này là do sự ổn định của cấu hình bán bão hòa (3d5) được ưu tiên hơn.
2. Giải thích sự bất thường trong cấu hình electron của Cr
- Nguyên lý Hund: Nguyên lý Hund giải thích rằng, các electron sẽ được phân bố vào các orbital theo cách mà số lượng electron không cặp đôi là lớn nhất. Trong trường hợp của Cr, việc sắp xếp thành 3d5 và 4s1 giúp nguyên tố đạt được cấu hình bền vững hơn.
- Quy tắc Aufbau: Quy tắc này chỉ ra rằng các electron sẽ điền vào các orbital có năng lượng thấp hơn trước, nhưng với Cr, sự sắp xếp khác biệt xảy ra do năng lượng của 3d và 4s gần nhau, và cấu hình 3d5 mang lại sự ổn định cao hơn.
3. Tầm quan trọng trong hóa học
Cấu hình electron độc đáo của Cr đóng vai trò quan trọng trong các phản ứng hóa học, đặc biệt là trong việc hình thành các hợp chất có trạng thái oxy hóa khác nhau như Cr2+ và Cr3+. Ví dụ, trong trạng thái Cr3+, cấu hình electron sẽ trở thành \[1s^2 2s^2 2p^6 3s^2 3p^6 3d^3\], sau khi mất ba electron (2 từ 4s và 1 từ 3d).
4. Ứng dụng và ảnh hưởng
Chromium được sử dụng rộng rãi trong nhiều lĩnh vực, từ công nghiệp mạ điện đến sản xuất hợp kim thép không gỉ. Cấu hình electron đặc biệt của Cr giúp nó có tính chất hóa học và vật lý đặc trưng, làm tăng khả năng ứng dụng trong nhiều ngành công nghiệp.

.png)
1. Giới thiệu về nguyên tố Crom
Crom, ký hiệu hóa học là Cr, là nguyên tố đứng thứ 24 trong bảng tuần hoàn, thuộc nhóm 6 và có số nguyên tử là 24. Đây là một kim loại chuyển tiếp, được biết đến với tính chất vật lý và hóa học đặc biệt, giúp nó trở thành một trong những nguyên tố quan trọng trong ngành công nghiệp hiện đại.
Crom có độ cứng cao, với độ cứng trên thang Mohs đạt mức 8,5, khiến nó trở thành một trong những kim loại cứng nhất. Màu sắc đặc trưng của crom là bạc trắng và nó có khả năng dẫn điện kém hơn một số kim loại khác.
Một trong những tính chất nổi bật của crom là khả năng tạo ra lớp màng oxide mỏng khi tiếp xúc với không khí. Lớp màng này giúp bảo vệ kim loại khỏi sự oxy hóa và ăn mòn, điều này giải thích tại sao crom thường được sử dụng để sản xuất thép không gỉ và mạ bề mặt kim loại, giúp chúng có độ bền cao hơn và khả năng chống mài mòn tốt hơn.
Ứng dụng của crom không chỉ giới hạn trong ngành luyện kim mà còn lan rộng sang nhiều lĩnh vực khác như sản xuất chất nhuộm màu, da thuộc và các thiết bị y tế. Nhờ vào các đặc tính vượt trội, crom đã và đang đóng vai trò quan trọng trong nhiều ngành công nghiệp khác nhau.
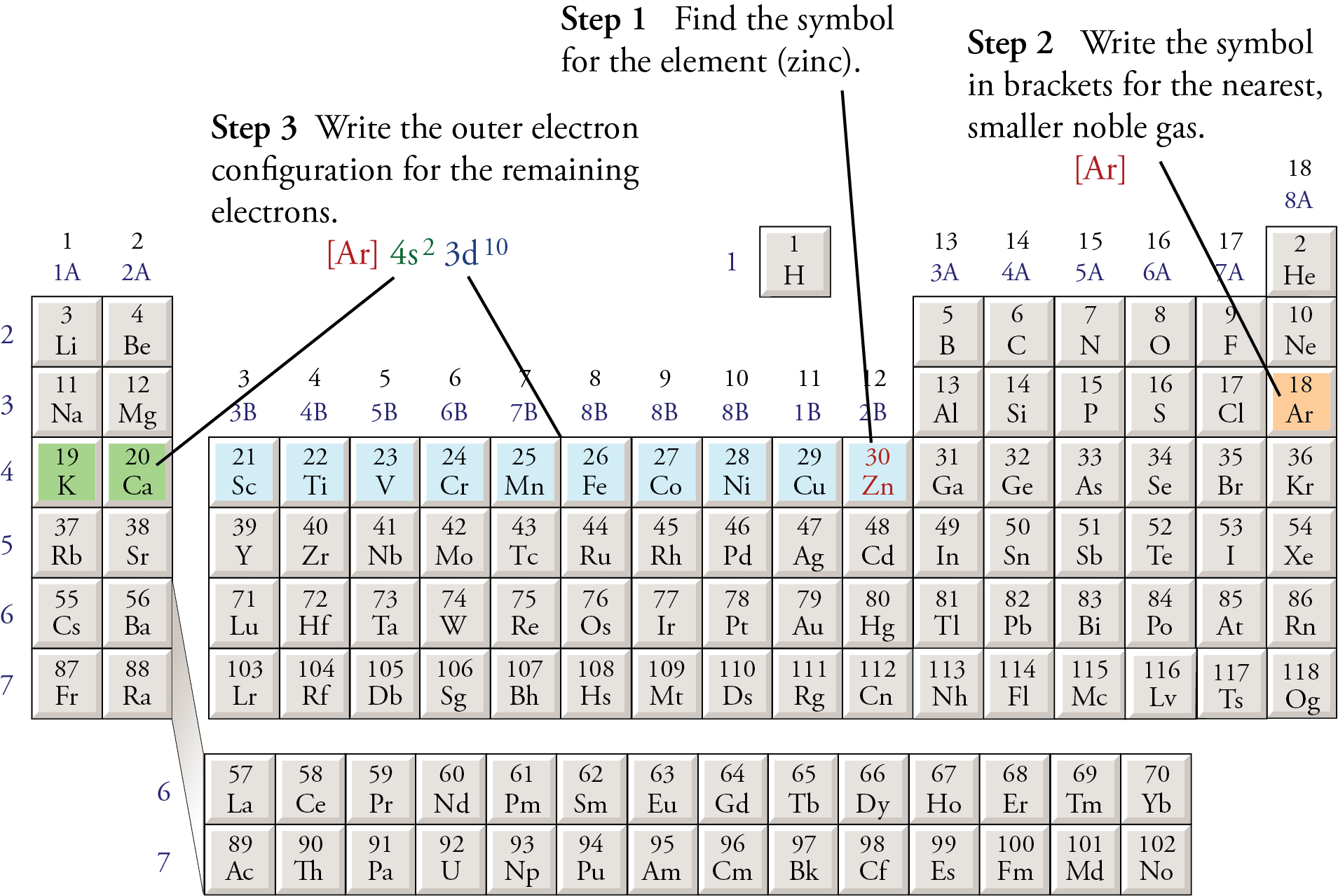
2. Cấu hình electron của nguyên tử Crom (24 Cr)
Cấu hình electron của nguyên tử Crom (\(24\) Cr) là một trong những điểm đặc biệt và khác biệt so với các nguyên tố khác trong bảng tuần hoàn. Thay vì tuân theo nguyên tắc Hund một cách thông thường, Crom có sự sắp xếp electron độc đáo để đạt được trạng thái ổn định hơn.
Ở trạng thái cơ bản, nguyên tử Crom có 24 electron. Thông thường, cấu hình electron dự kiến sẽ là \([Ar]\,4s^2\,3d^4\). Tuy nhiên, để tăng tính ổn định, một electron từ phân lớp \(4s\) sẽ chuyển sang phân lớp \(3d\), khiến cấu hình electron thực tế của Crom trở thành \([Ar]\,4s^1\,3d^5\). Sự hoán đổi này giúp cân bằng năng lượng giữa các phân lớp và tạo ra một cấu hình ổn định hơn.
Cụ thể, cấu hình electron của Crom có thể được biểu diễn như sau:
- Lớp K (1s): \(1s^2\)
- Lớp L (2s, 2p): \(2s^2\,2p^6\)
- Lớp M (3s, 3p, 3d): \(3s^2\,3p^6\,3d^5\)
- Lớp N (4s): \(4s^1\)
Sự khác biệt trong cấu hình electron của Crom làm nổi bật vai trò của yếu tố ổn định năng lượng trong các phân lớp electron. Cấu hình này giúp Crom có tính chất hóa học đặc biệt, nhất là trong việc hình thành các hợp chất có tính oxi hóa mạnh như \(CrO_3\) hoặc \(Cr_2O_7^{2-}\).

3. Cấu hình electron của Crom ở các trạng thái oxy hóa khác nhau
Crom là một nguyên tố có khả năng tạo ra nhiều trạng thái oxy hóa khác nhau, phổ biến nhất là \(+2\), \(+3\), và \(+6\). Ở mỗi trạng thái oxy hóa, cấu hình electron của Crom thay đổi để phản ánh sự mất đi của các electron trong các lớp vỏ khác nhau.
Trạng thái oxy hóa +2:
Ở trạng thái này, Crom mất đi 2 electron từ lớp \(4s\), khiến cấu hình electron trở thành \([Ar]\,3d^4\).
Trạng thái oxy hóa +3:
Khi Crom bị oxy hóa lên trạng thái \(+3\), nó mất đi tổng cộng 3 electron, bao gồm 2 electron từ lớp \(4s\) và 1 electron từ lớp \(3d\), dẫn đến cấu hình \([Ar]\,3d^3\).
Trạng thái oxy hóa +6:
Ở trạng thái \(+6\), Crom mất đi 6 electron, với 2 electron từ lớp \(4s\) và 4 electron từ lớp \(3d\), tạo ra cấu hình \([Ar]\). Đây là trạng thái oxy hóa cao nhất của Crom, và nó được thấy trong các hợp chất như \(CrO_3\) và \(K_2Cr_2O_7\).
Việc hiểu rõ cấu hình electron ở các trạng thái oxy hóa khác nhau giúp giải thích các tính chất hóa học đặc trưng của Crom, bao gồm khả năng hình thành các hợp chất có tính oxi hóa mạnh và ứng dụng rộng rãi trong công nghiệp.

4. So sánh cấu hình electron của Crom với các nguyên tố khác trong nhóm
Crom (\(24\) Cr) nằm trong nhóm VI B của bảng tuần hoàn, nơi các nguyên tố có đặc điểm chung về cấu hình electron và tính chất hóa học. Việc so sánh cấu hình electron của Crom với các nguyên tố khác trong nhóm, chẳng hạn như Molypden (\(42\) Mo) và Wolfram (\(74\) W), giúp hiểu rõ hơn về sự khác biệt và tương đồng trong cấu trúc nguyên tử.
Cấu hình electron của Molypden (\(42\) Mo):
Molypden có cấu hình electron \([Kr]\,5s^1\,4d^5\). Cấu hình này tương tự như Crom, với sự hoán đổi electron giữa các phân lớp để đạt được trạng thái ổn định, chỉ khác ở lớp vỏ ngoài cùng.
Cấu hình electron của Wolfram (\(74\) W):
Wolfram có cấu hình electron \([Xe]\,6s^2\,4f^{14}\,5d^4\). Sự khác biệt chính ở đây là Wolfram có thêm phân lớp \(4f^{14}\), khiến cấu hình phức tạp hơn nhưng vẫn duy trì tính chất tương tự Crom.
Cả ba nguyên tố đều có xu hướng đạt được cấu hình electron bán bão hòa ở phân lớp \(d\), làm tăng tính ổn định và góp phần vào các đặc tính hóa học đặc biệt của nhóm VI B. Việc so sánh này cho thấy sự nhất quán trong việc sắp xếp electron giữa các nguyên tố, nhưng cũng làm nổi bật những khác biệt do sự gia tăng số lớp vỏ electron.

5. Ứng dụng cấu hình electron của Crom trong thực tiễn
Cấu hình electron đặc biệt của Crom (\(24\,Cr\)) không chỉ tạo ra những tính chất hóa học độc đáo mà còn có nhiều ứng dụng quan trọng trong thực tiễn. Nhờ vào sự phân bố electron ở các phân lớp \(3d^5\) và \(4s^1\), Crom có tính chất bền bỉ và khả năng chống ăn mòn cao, khiến nó trở thành một thành phần quan trọng trong nhiều ngành công nghiệp.
- Thép không gỉ: Crom được sử dụng rộng rãi trong sản xuất thép không gỉ, nhờ vào khả năng tạo ra lớp oxit bền vững bảo vệ bề mặt khỏi bị oxy hóa và ăn mòn.
- Xi mạ Crom: Quá trình mạ Crom điện phân dựa trên tính chất của Crom để tạo ra lớp phủ cứng, sáng bóng, thường được sử dụng trong sản xuất phụ tùng ô tô, dụng cụ và thiết bị gia đình.
- Sản xuất hợp kim: Crom là một nguyên tố chính trong nhiều hợp kim nhờ vào độ cứng và khả năng chịu nhiệt cao, được ứng dụng trong các lĩnh vực như hàng không, vũ trụ và công nghiệp quốc phòng.
- Hóa chất: Crom cũng được sử dụng trong sản xuất các hóa chất như \(Na_2Cr_2O_7\) (Natri đicromat) và \(CrO_3\) (Crom trioxit) trong ngành công nghiệp nhuộm và sản xuất da.
Những ứng dụng này minh họa vai trò quan trọng của cấu hình electron đặc biệt của Crom trong việc tạo ra các sản phẩm và công nghệ tiên tiến, đóng góp to lớn vào sự phát triển của các ngành công nghiệp hiện đại.
XEM THÊM:
6. Câu hỏi thường gặp về cấu hình electron của Crom
- Cấu hình electron của Crom là gì?
- Tại sao cấu hình electron của Crom không tuân theo quy tắc xây dựng thông thường?
- Cấu hình electron của Crom ảnh hưởng đến tính chất hóa học như thế nào?
- Làm thế nào để viết đúng cấu hình electron của Crom?
- Tại sao Crom có khả năng tạo ra nhiều trạng thái oxy hóa?
Cấu hình electron của nguyên tử Crom (\(24\,Cr\)) là \([Ar]\,3d^5\,4s^1\). Đây là một cấu hình đặc biệt, do sự hoán đổi electron giữa các phân lớp để đạt trạng thái ổn định hơn.
Thông thường, theo quy tắc Aufbau, electron sẽ lấp đầy phân lớp \(4s\) trước khi lấp đầy \(3d\). Tuy nhiên, ở Crom, cấu hình \([Ar]\,3d^5\,4s^1\) mang lại sự ổn định cao hơn do phân lớp \(3d\) nửa đầy.
Cấu hình đặc biệt này giúp Crom có tính chất hóa học khác biệt, như khả năng tạo ra các hợp chất ở nhiều trạng thái oxy hóa và tính chất từ tính mạnh mẽ.
Để viết đúng cấu hình electron của Crom, cần nhớ rằng electron ở phân lớp \(4s\) sẽ nhường chỗ cho phân lớp \(3d\) để tạo ra cấu hình \([Ar]\,3d^5\,4s^1\), thay vì \([Ar]\,3d^4\,4s^2\).
Do có cấu hình electron \(3d^5\,4s^1\), Crom có thể dễ dàng mất hoặc chia sẻ các electron này, từ đó tạo ra nhiều trạng thái oxy hóa khác nhau như \(+2\), \(+3\), \(+6\).