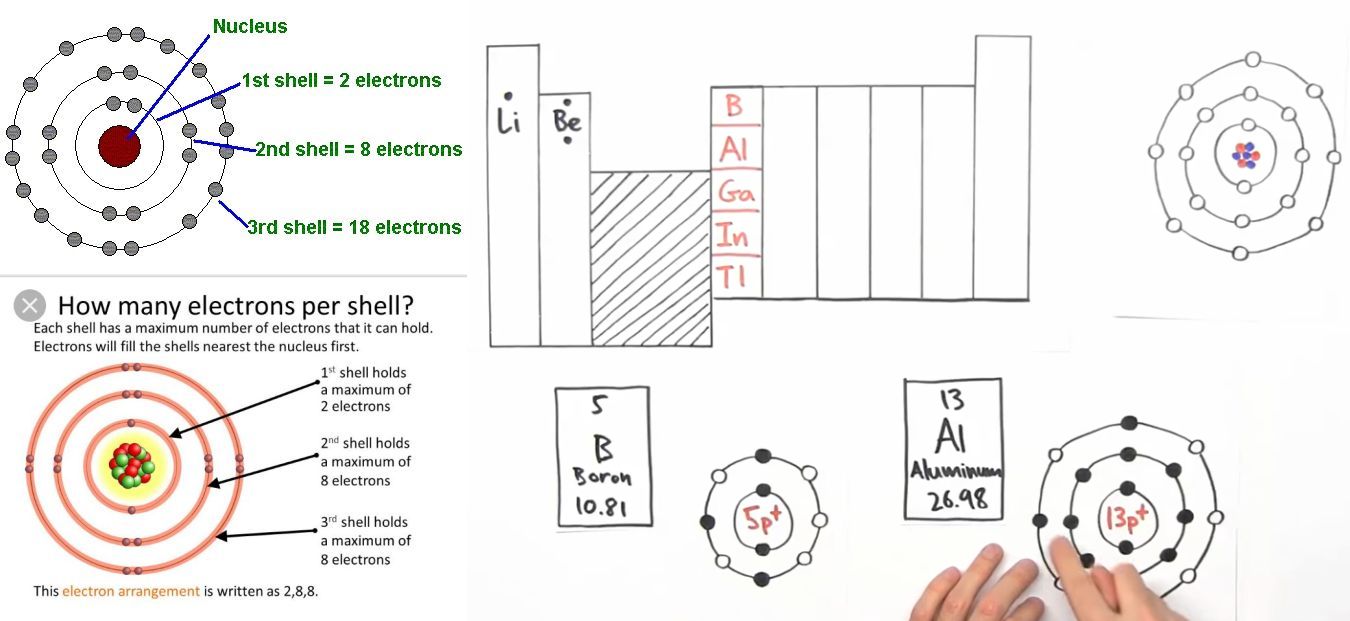
Chủ đề 3 centre 4 electron bond: Liên kết 3 tâm 4 electron là một mô hình quan trọng để giải thích liên kết trong các phân tử hypervalent như phosphorus pentafluoride, sulfur hexafluoride, và xenon fluorides. Mô hình này giúp hiểu rõ cấu trúc và tính chất của các liên kết đặc biệt, đóng vai trò quan trọng trong nghiên cứu hóa học hiện đại, giúp giải quyết những vấn đề liên quan đến cấu trúc electron và năng lượng của phân tử một cách chính xác và hiệu quả.
Mục lục
- Mô hình liên kết ba tâm bốn electron (3 Centre 4 Electron Bond)
- 1. Giới thiệu về Liên Kết Ba Tâm Bốn Electron
- 2. Nguyên lý Hoạt Động của Liên Kết Ba Tâm Bốn Electron
- 3. Ứng dụng của Liên Kết Ba Tâm Bốn Electron trong Hóa Học
- 4. Sự Khác Biệt Giữa Liên Kết Ba Tâm Bốn Electron và Liên Kết Hai Tâm Hai Electron
- 5. Phân Tích Chuyên Sâu về Các Phân Tử Điển Hình
- 6. Lợi Ích và Giới Hạn của Mô Hình Liên Kết Ba Tâm Bốn Electron
- 7. Các Công Cụ và Phương Pháp Phân Tích Liên Kết Ba Tâm Bốn Electron
- 8. Tổng Kết và Kết Luận
Mô hình liên kết ba tâm bốn electron (3 Centre 4 Electron Bond)
Liên kết ba tâm bốn electron là một mô hình hóa học dùng để giải thích cách thức các nguyên tử liên kết trong các phân tử siêu hóa trị. Liên kết này thường xuất hiện trong các phân tử có cấu trúc chứa nhiều hơn tám electron trong lớp vỏ hóa trị của nguyên tử trung tâm, như phosphorus pentafluoride (PF5), sulfur hexafluoride (SF6), và xenon fluorides (XeF2).
Nguyên lý của liên kết ba tâm bốn electron
Mô hình này mô tả liên kết của ba nguyên tử cùng nằm trên một đường thẳng (liên kết đồng trục), trong đó có ba orbital phân tử được tạo ra từ sự kết hợp của các orbital p trên mỗi nguyên tử. Các liên kết này bao gồm:
- Một orbital liên kết (bonding orbital) được điền đầy, mang năng lượng thấp nhất.
- Một orbital phi liên kết (non-bonding orbital) cũng được điền đầy, nằm ở mức năng lượng trung gian.
- Một orbital phản liên kết (antibonding orbital) không chứa electron, có năng lượng cao nhất.
Sự phân bố này dẫn đến việc tồn tại hai cặp electron trong các orbital liên kết và phi liên kết, làm cho các liên kết này ổn định mà không cần đến sự tham gia của các orbital d. Ví dụ, trong phân tử XeF2, các liên kết F-Xe-F được mô tả bằng mô hình này, với các orbital phi liên kết chủ yếu tập trung vào hai nguyên tử fluorine ở hai đầu, do fluorine có độ âm điện cao.
Ứng dụng của mô hình liên kết ba tâm bốn electron
Mô hình này rất hữu ích trong việc giải thích cấu trúc của các phân tử siêu hóa trị mà không phá vỡ quy tắc bát tử (octet rule). Một số ví dụ nổi bật bao gồm:
- Phosphorus pentafluoride (PF5): Có một liên kết ba tâm bốn electron và ba liên kết hai tâm hai electron truyền thống.
- Sulfur tetrafluoride (SF4): Sử dụng một liên kết ba tâm bốn electron cùng với hai liên kết truyền thống.
- Sulfur hexafluoride (SF6): Toàn bộ các liên kết trong phân tử này được mô tả bởi mô hình liên kết ba tâm bốn electron.
Mô hình liên kết trong toán học và hóa học lượng tử
Trong mô hình này, việc tính toán hóa học lượng tử cho thấy sự đóng góp của các orbital d là không đáng kể do chênh lệch năng lượng lớn giữa các orbital p đã điền đầy và các orbital d rỗng. Thay vào đó, mô hình liên kết ba tâm bốn electron tập trung vào việc kết hợp các orbital p để hình thành các liên kết ổn định mà không cần d orbital.
Trong toán học, liên kết này được biểu diễn bằng các orbital phân tử như sau:
Trong đó, \(\phi_1, \phi_2, \phi_3\) là các orbital p của ba nguyên tử tham gia liên kết, và các hệ số \(c_i, d_i, e_i\) xác định mức độ đóng góp của mỗi orbital trong các liên kết.
Kết luận
Mô hình liên kết ba tâm bốn electron giúp giải thích được nhiều đặc tính liên kết trong các phân tử siêu hóa trị mà các mô hình truyền thống không thể miêu tả đầy đủ. Nó đã trở thành một công cụ hữu ích và được chấp nhận rộng rãi trong hóa học hiện đại.
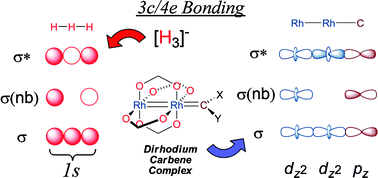
.png)
1. Giới thiệu về Liên Kết Ba Tâm Bốn Electron
Liên kết Ba Tâm Bốn Electron (3 centre 4 electron bond) là một mô hình liên kết được sử dụng để giải thích các liên kết trong các phân tử siêu hóa trị (hypervalent) như \(\text{PF}_5\) (phosphorus pentafluoride), \(\text{SF}_6\) (sulfur hexafluoride), và \(\text{XeF}_2\) (xenon difluoride). Mô hình này mô tả sự chia sẻ của bốn electron giữa ba nguyên tử, tạo ra một cấu trúc liên kết độc đáo và ổn định.
- Nguyên lý hoạt động: Liên kết ba tâm bốn electron bao gồm ba nguyên tử liên kết dọc theo một đường thẳng, với electron được phân chia trong các orbital phân tử hình thành từ các orbital p đồng phẳng của ba nguyên tử.
- Cấu trúc: Ví dụ, trong phân tử \(\text{XeF}_2\), các nguyên tử fluorine được liên kết với xenon thông qua một liên kết ba tâm bốn electron, nơi hai orbital p của fluorine và một orbital p của xenon kết hợp để tạo ra các orbital phân tử, gồm một orbital liên kết đầy đủ, một orbital không liên kết đầy đủ, và một orbital phản liên kết trống.
Liên kết này giúp giải thích tại sao một số phân tử có thể vượt quá quy tắc bát tử mà không cần sử dụng các orbital d. Điều này đặc biệt quan trọng trong việc hiểu các cấu trúc phân tử phức tạp và sự phân bố electron trong các hợp chất siêu hóa trị, đóng góp vào việc phát triển các mô hình liên kết hiện đại hơn trong hóa học.
2. Nguyên lý Hoạt Động của Liên Kết Ba Tâm Bốn Electron
Liên kết ba tâm bốn electron (3-center-4-electron bond) là một mô hình được sử dụng để giải thích các liên kết trong các phân tử siêu hoá trị như phosphor pentafluoride (PF5), sulfur hexafluoride (SF6), và các fluoride của xenon (XeF2, XeF4, XeF6).
Liên kết này thường xuất hiện trong các hệ thống có ba nguyên tử nằm trên một đường thẳng, ví dụ như trong phân tử XeF2, nơi phân tử có cấu trúc tuyến tính F-Xe-F. Mô hình liên kết này bao gồm ba orbital phân tử (MOs) được tạo ra từ các orbital p đồng trục trên mỗi nguyên tử. Cấu trúc này bao gồm:
- Một orbital liên kết đầy electron.
- Một orbital không liên kết đầy electron.
- Một orbital phản liên kết trống (không có electron).
Các electron được phân bố như sau: hai orbital có năng lượng thấp hơn sẽ được lấp đầy hoàn toàn với hai cặp electron (tổng cộng 4 electron), và orbital cao nhất (HOMO) tập trung chủ yếu ở hai nguyên tử ở đầu (ví dụ, fluor trong trường hợp XeF2), làm tăng mật độ electron ở những nguyên tử này.
Mô hình này cũng giải thích tại sao các phân tử siêu hoá trị như SF6 không cần đến sự tham gia của các orbital d, điều mà các mô hình trước đây thường yêu cầu. Trong thực tế, các tính toán hóa học lượng tử chỉ ra rằng sự tham gia của các orbital d là không đáng kể do sự chênh lệch lớn về năng lượng giữa các orbital p (đã lấp đầy) và các orbital d (trống).
Ví dụ cụ thể về liên kết ba tâm bốn electron:
- Trong phân tử XeF2, liên kết giữa các nguyên tử có thể được biểu diễn bằng cách kết hợp một orbital p đầy đủ electron ở nguyên tử xenon trung tâm với hai orbital p bán đầy ở các nguyên tử fluor đầu trục.
- Các liên kết này tạo ra một hệ thống với một orbital liên kết, một orbital không liên kết và một orbital phản liên kết.
- Các orbital thấp hơn sẽ chứa hai cặp electron, trong khi orbital phản liên kết vẫn trống, phù hợp với mô hình liên kết ba tâm bốn electron.
Mô hình liên kết ba tâm bốn electron không chỉ giải thích sự tồn tại của các liên kết này mà còn giúp duy trì nguyên tắc bát tử mà không cần đến các orbital d. Do đó, mô hình này được chấp nhận rộng rãi hơn trong việc mô tả các liên kết trong các phân tử siêu hoá trị.

3. Ứng dụng của Liên Kết Ba Tâm Bốn Electron trong Hóa Học
Liên kết ba tâm bốn electron (3-center-4-electron bond) là một khái niệm quan trọng trong hóa học, đặc biệt trong việc mô tả cấu trúc và tính chất của các phân tử siêu hoá trị. Ứng dụng của liên kết này không chỉ giới hạn trong các phân tử có cấu trúc đặc biệt mà còn mở rộng đến nhiều lĩnh vực khác nhau trong hóa học. Dưới đây là một số ứng dụng tiêu biểu:
- 1. Mô tả cấu trúc của các phân tử siêu hoá trị:
- Liên kết ba tâm bốn electron giúp giải thích sự tồn tại của các phân tử như xenon difluoride (XeF2), phosphor pentafluoride (PF5), và sulfur hexafluoride (SF6), nơi các liên kết không thể được mô tả chỉ bằng các liên kết hai tâm thông thường.
- 2. Ứng dụng trong các hợp chất chứa halogen:
- Liên kết ba tâm bốn electron giải thích sự hình thành của các hợp chất chứa halogen như I3- (anion triiodide), nơi ba nguyên tử iod tạo thành một cấu trúc tuyến tính với phân bố electron ổn định.
- 3. Phát triển lý thuyết liên kết hóa học:
- Liên kết ba tâm bốn electron đóng vai trò quan trọng trong việc phát triển và hoàn thiện các lý thuyết liên kết hóa học, giúp các nhà khoa học hiểu rõ hơn về cấu trúc electron và tương tác giữa các nguyên tử trong phân tử.
- 4. Ứng dụng trong hóa học hợp chất cao cấp:
- Trong hóa học của các hợp chất chứa kim loại chuyển tiếp, mô hình này được áp dụng để giải thích cấu trúc của các phức hợp có liên kết cầu ba tâm, đặc biệt trong các chất xúc tác và hợp chất có tính chất đặc biệt.
- 5. Tối ưu hóa và thiết kế phân tử:
- Kiến thức về liên kết ba tâm bốn electron được sử dụng để tối ưu hóa cấu trúc phân tử và thiết kế các phân tử mới với tính chất mong muốn, phục vụ trong các ngành công nghiệp dược phẩm, vật liệu, và hóa chất đặc biệt.
Nhìn chung, liên kết ba tâm bốn electron không chỉ là một mô hình lý thuyết mà còn là công cụ hữu ích trong nghiên cứu và ứng dụng thực tiễn. Nó giúp mở rộng hiểu biết về cấu trúc phân tử và cung cấp cơ sở cho các phát triển mới trong hóa học hiện đại.

4. Sự Khác Biệt Giữa Liên Kết Ba Tâm Bốn Electron và Liên Kết Hai Tâm Hai Electron
Liên kết ba tâm bốn electron (3-center-4-electron bond) và liên kết hai tâm hai electron (2-center-2-electron bond) là hai kiểu liên kết hóa học cơ bản với các đặc điểm và ứng dụng khác nhau trong hóa học. Dưới đây là sự khác biệt chính giữa hai loại liên kết này:
| Tiêu Chí | Liên Kết Ba Tâm Bốn Electron | Liên Kết Hai Tâm Hai Electron |
|---|---|---|
| Cấu trúc liên kết | Liên kết ba tâm bốn electron bao gồm ba nguyên tử và bốn electron chia sẻ chung, tạo thành các liên kết phi truyền thống trong các phân tử siêu hoá trị như XeF2, PF5. | Liên kết hai tâm hai electron là liên kết cơ bản nhất, với hai electron được chia sẻ giữa hai nguyên tử, như trong các liên kết đơn của H2, Cl2, hoặc các liên kết C-H trong hydrocacbon. |
| Đặc điểm điện tử | Các electron được phân bố qua ba tâm, với một orbital liên kết, một orbital không liên kết và một orbital phản liên kết. Mô hình này giúp ổn định các cấu trúc phân tử có dạng tuyến tính hoặc cấu trúc không chuẩn. | Một cặp electron nằm trong orbital liên kết giữa hai nguyên tử, giúp tạo thành liên kết ổn định và dễ hiểu nhất trong mô hình liên kết truyền thống. |
| Ứng dụng | Thường được tìm thấy trong các phân tử siêu hoá trị, hợp chất chứa halogen, và các hệ thống phức hợp kim loại. Liên kết ba tâm bốn electron giúp mô tả các cấu trúc phức tạp mà liên kết hai tâm không thể giải thích. | Ứng dụng rộng rãi trong tất cả các hợp chất hóa học thông thường, bao gồm hợp chất hữu cơ và vô cơ, từ đơn giản đến phức tạp. |
| Nguyên tắc hoạt động | Liên kết này tuân theo nguyên lý siêu hoá trị, cho phép các nguyên tử vượt quá quy tắc bát tử thông thường, như trong các hợp chất của nhóm nguyên tố chính và các hợp chất xenon. | Tuân theo quy tắc bát tử, tối ưu hóa sự chia sẻ electron để đạt được cấu hình vỏ electron bền vững với tám electron trong lớp vỏ ngoài cùng. |
| Ví dụ cụ thể | XeF2, SF6, I3- | H2, HCl, CH4 |
Liên kết ba tâm bốn electron giúp mở rộng hiểu biết về các liên kết phi truyền thống và cấu trúc phân tử phức tạp, đóng góp quan trọng trong nghiên cứu hóa học hiện đại và ứng dụng trong các lĩnh vực như xúc tác, vật liệu tiên tiến và hợp chất siêu hoá trị.

5. Phân Tích Chuyên Sâu về Các Phân Tử Điển Hình
Liên kết ba tâm bốn electron (3-center-4-electron bond) là một loại liên kết đặc biệt xuất hiện trong nhiều phân tử và hợp chất có cấu trúc siêu hoá trị. Dưới đây là phân tích chuyên sâu về một số phân tử điển hình có sử dụng liên kết này:
- 1. Phân tử Xenon Difluoride (XeF2):
XeF2 là một ví dụ điển hình về liên kết ba tâm bốn electron. Cấu trúc của XeF2 được mô tả bởi một liên kết ba tâm, trong đó hai nguyên tử fluor chia sẻ electron với nguyên tử xenon trung tâm.
- Cấu trúc liên kết: Xenon nằm ở trung tâm với hai nguyên tử fluor ở hai bên, tạo thành một cấu trúc tuyến tính.
- Phân bố electron: Bốn electron được phân bố trong một orbital liên kết mở rộng qua cả ba nguyên tử, giúp ổn định cấu trúc.
- 2. Phân tử Phosphor Pentafluoride (PF5):
PF5 sử dụng liên kết ba tâm bốn electron để giải thích cấu trúc của nó, với ba liên kết phi truyền thống để tạo nên hình học bipyramid tam giác.
- Cấu trúc: Một nguyên tử phosphor ở trung tâm với năm nguyên tử fluor xung quanh, ba trong số đó tạo liên kết ba tâm với phosphor.
- Đặc điểm liên kết: Hai liên kết đôi và ba liên kết ba tâm giúp phosphor vượt qua quy tắc bát tử, tạo nên sự bền vững cho phân tử.
- 3. Anion Triiodide (I3-):
Anion triiodide là một ví dụ khác về liên kết ba tâm bốn electron, trong đó ba nguyên tử iod tạo thành một cấu trúc tuyến tính với sự chia sẻ electron đồng đều.
- Cấu trúc liên kết: I3- có cấu trúc tuyến tính với hai liên kết ba tâm bốn electron giữa các nguyên tử iod.
- Phân bố electron: Bốn electron chia sẻ trên ba nguyên tử iod giúp duy trì sự ổn định của anion.
- 4. Phân tử Diborane (B2H6):
Diborane là một ví dụ phức tạp hơn với hai liên kết ba tâm bốn electron giữa nguyên tử bor và hydrogen tạo cầu nối, đặc trưng cho các phân tử boron.
- Cấu trúc: Diborane bao gồm hai nguyên tử boron được liên kết với nhau thông qua các nguyên tử hydrogen cầu nối.
- Đặc điểm liên kết: Liên kết ba tâm bốn electron xuất hiện giữa boron và các hydrogen cầu nối, làm cho phân tử có tính chất đặc biệt.
Những phân tử trên đều thể hiện rõ ràng vai trò quan trọng của liên kết ba tâm bốn electron trong việc tạo nên các cấu trúc phân tử độc đáo và ổn định. Khả năng vượt qua các giới hạn của liên kết thông thường giúp các phân tử này có những tính chất hóa học đặc biệt, đóng góp quan trọng trong các nghiên cứu hóa học hiện đại.
XEM THÊM:
6. Lợi Ích và Giới Hạn của Mô Hình Liên Kết Ba Tâm Bốn Electron
Mô hình Liên Kết Ba Tâm Bốn Electron (3 Centre 4 Electron Bond) đóng vai trò quan trọng trong việc hiểu rõ cấu trúc và tính chất của các phân tử siêu hóa trị. Tuy nhiên, mô hình này cũng có những lợi ích và giới hạn cần được xem xét kỹ lưỡng.
6.1 Lợi ích trong việc mô tả phân tử phức tạp
- Mô tả chính xác các phân tử siêu hóa trị: Liên kết ba tâm bốn electron cho phép mô tả một cách chính xác cấu trúc của các phân tử siêu hóa trị như \(\text{XeF}_2\), \(\text{PF}_5\), và \(\text{SF}_6\). Mô hình này giải thích sự tồn tại của các phân tử có số electron lớn hơn so với số liên kết thông thường, giúp cho việc phân tích và dự đoán cấu trúc của các hợp chất phức tạp trở nên khả thi.
- Giảm độ phức tạp của liên kết: Thay vì phải sử dụng nhiều mô hình khác nhau để mô tả liên kết trong các phân tử phức tạp, mô hình này cung cấp một cách tiếp cận nhất quán, giảm thiểu độ phức tạp và tăng độ chính xác trong việc dự đoán cấu trúc phân tử.
- Hỗ trợ trong nghiên cứu và giáo dục: Việc sử dụng mô hình này giúp sinh viên và nhà nghiên cứu dễ dàng tiếp cận và hiểu rõ hơn về bản chất của các liên kết phi truyền thống trong hóa học hiện đại, từ đó mở rộng kiến thức và khả năng áp dụng vào các nghiên cứu thực tiễn.
6.2 Những giới hạn và tranh luận khoa học
- Khó khăn trong việc mô tả các hệ thống phức tạp hơn: Mặc dù mô hình liên kết ba tâm bốn electron có thể mô tả tốt các phân tử siêu hóa trị đơn giản, nhưng khi đối mặt với các hệ thống phức tạp hơn, mô hình này gặp khó khăn trong việc mô phỏng chính xác tương tác giữa các electron và hạt nhân.
- Sự tồn tại của các mô hình thay thế: Một số nhà khoa học đề xuất rằng mô hình liên kết ba tâm bốn electron không phải là phương pháp duy nhất hoặc tốt nhất để mô tả cấu trúc của các phân tử siêu hóa trị. Các mô hình khác như mô hình orbital phân tử và lý thuyết nhóm có thể cung cấp cái nhìn sâu sắc hơn về bản chất của các liên kết trong các phân tử này.
- Tranh luận về tính chính xác: Một số nghiên cứu chỉ ra rằng mô hình này có thể không phản ánh hoàn toàn chính xác sự phân bố electron trong các phân tử, dẫn đến một số dự đoán sai lệch về tính chất hóa học và vật lý của chúng.
Tóm lại, mô hình liên kết ba tâm bốn electron đã đóng góp không nhỏ vào sự phát triển của hóa học hiện đại, đặc biệt trong việc mô tả các phân tử siêu hóa trị. Tuy nhiên, việc hiểu rõ các giới hạn và liên tục đánh giá lại mô hình này là cần thiết để đảm bảo sự chính xác trong nghiên cứu và ứng dụng thực tiễn.

7. Các Công Cụ và Phương Pháp Phân Tích Liên Kết Ba Tâm Bốn Electron
Việc phân tích liên kết ba tâm bốn electron đòi hỏi sự sử dụng của nhiều công cụ và phương pháp phức tạp, nhằm mô tả chính xác cấu trúc và tính chất của các phân tử liên quan. Dưới đây là một số phương pháp và công cụ tiêu biểu:
7.1 Kỹ thuật tính toán hóa học lượng tử
Các kỹ thuật tính toán hóa học lượng tử, như phương pháp Density Functional Theory (DFT) và Molecular Orbital Theory (MO), đóng vai trò quan trọng trong việc xác định sự phân bố mật độ electron trong liên kết ba tâm. Các mô hình này cho phép tính toán và dự đoán tính chất của phân tử, từ đó giúp hiểu rõ hơn về bản chất của liên kết ba tâm bốn electron.
- Phương pháp DFT: Giúp mô tả sự phân bố mật độ electron và năng lượng liên kết của các phân tử.
- Phương pháp MO: Cung cấp cái nhìn sâu sắc về sự chồng lấn của các orbital trong liên kết ba tâm.
7.2 Mô hình và công cụ phần mềm
Các phần mềm như Gaussian, Spartan và ChemDraw là những công cụ không thể thiếu trong việc mô phỏng và minh họa các phân tử có liên kết ba tâm bốn electron. Chúng cho phép người dùng tạo ra các mô hình 3D, mô phỏng phổ học, và thực hiện các tính toán liên quan đến cấu trúc và năng lượng.
- Gaussian: Một phần mềm mạnh mẽ trong việc tính toán các thuộc tính phân tử dựa trên DFT và MO.
- Spartan: Cung cấp khả năng mô phỏng cấu trúc phân tử và phổ học, hỗ trợ việc phân tích liên kết.
- ChemDraw: Giúp tạo ra các sơ đồ phân tử và minh họa các liên kết ba tâm một cách trực quan.
7.3 Phương pháp phổ học và phân tích cấu trúc
Phổ học (spectroscopy) là một công cụ quan trọng khác, giúp xác định cấu trúc và tính chất của các liên kết trong phân tử. Các phương pháp như phổ hồng ngoại (IR) và phổ cộng hưởng từ hạt nhân (NMR) cho phép quan sát các tương tác ở mức độ nguyên tử, từ đó xác nhận sự tồn tại và tính chất của liên kết ba tâm bốn electron.
- Phổ IR: Cung cấp thông tin về các dao động phân tử, từ đó xác định các nhóm chức và liên kết đặc trưng.
- Phổ NMR: Cho phép quan sát sự phân bố mật độ electron và cấu trúc không gian của phân tử.
Với sự phát triển không ngừng của công nghệ và phương pháp nghiên cứu, việc phân tích và hiểu rõ hơn về liên kết ba tâm bốn electron ngày càng trở nên dễ dàng và chính xác hơn, mở ra nhiều cơ hội mới trong việc nghiên cứu và ứng dụng trong hóa học.

8. Tổng Kết và Kết Luận
Liên kết ba tâm với bốn electron (3c-4e) là một khái niệm quan trọng để giải thích sự liên kết trong các phân tử siêu liên kết, chẳng hạn như phosphor pentafluoride (PF5), sulfur hexafluoride (SF6), và các fluoride của xenon. Mô hình này cung cấp một cách tiếp cận hiệu quả trong việc hiểu rõ cơ chế liên kết trong các phân tử có nhiều hơn tám electron xung quanh nguyên tử trung tâm, vốn thường vi phạm quy tắc bát tử.
Trong mô hình này, ba nguyên tử thẳng hàng được mô tả bằng một tập hợp các quỹ đạo phân tử (\(...\)), nơi mà quỹ đạo p của nguyên tử trung tâm kết hợp với quỹ đạo p bán đầy của hai nguyên tử biên. Sự kết hợp này tạo ra ba quỹ đạo phân tử: một quỹ đạo liên kết, một quỹ đạo không liên kết và một quỹ đạo phản liên kết, trong đó hai quỹ đạo có năng lượng thấp hơn sẽ được chiếm đóng bởi bốn electron.
Liên kết 3c-4e giúp giải thích tại sao các liên kết trong các phân tử như XeF2 lại có đặc tính khác biệt so với các liên kết đôi hoặc liên kết đơn thông thường. Cụ thể, trong các phân tử này, electron không tập trung ở nguyên tử trung tâm mà lan tỏa ra hai nguyên tử biên, làm tăng mật độ electron tại các nguyên tử này.
Kết quả là, mô hình này không chỉ cung cấp sự hiểu biết sâu sắc về cấu trúc liên kết mà còn giúp đơn giản hóa việc giải thích cấu trúc electron của các phân tử siêu liên kết mà không cần phải sử dụng đến quỹ đạo d, vốn đã được chứng minh là có vai trò rất nhỏ trong quá trình liên kết này.
Như vậy, mô hình liên kết ba tâm bốn electron đã trở thành một công cụ hữu hiệu và phổ biến trong hóa học hiện đại để mô tả và dự đoán tính chất của các phân tử phức tạp. Việc áp dụng mô hình này không chỉ giới hạn ở các phân tử siêu liên kết mà còn có thể mở rộng sang các hệ thống khác như trạng thái chuyển tiếp trong phản ứng SN2 và một số liên kết hydrogen cộng hưởng.
Tổng kết lại, mô hình liên kết 3c-4e đóng vai trò quan trọng trong việc giải thích các hiện tượng hóa học phức tạp và mở ra nhiều hướng nghiên cứu mới trong hóa học lượng tử và hóa học lý thuyết.