Chủ đề 3d6 electron configuration: Cấu hình electron 3d6 đóng vai trò quan trọng trong hóa học và vật lý, đặc biệt liên quan đến các kim loại chuyển tiếp. Bài viết này sẽ giải thích chi tiết về cấu hình 3d6, cách xác định nó, và những ứng dụng thực tiễn trong cuộc sống hằng ngày.
Mục lục
- Cấu hình Electron 3d6 và Ý nghĩa của nó
- 1. Giới thiệu về Cấu Hình Electron 3d6
- 2. Cấu Hình Electron của Sắt (Fe) - Một Trường Hợp Điển Hình
- 3. So sánh Cấu Hình Electron 3d6 với Các Nguyên Tố Khác
- 4. Vai Trò Của Cấu Hình Electron 3d6 Trong Các Phản Ứng Hóa Học
- 5. Ứng Dụng Thực Tế của Nguyên Tố Có Cấu Hình 3d6
- 6. Tổng Kết và Những Điều Cần Ghi Nhớ
Cấu hình Electron 3d6 và Ý nghĩa của nó
Cấu hình electron 3d6 thường liên quan đến các nguyên tố kim loại chuyển tiếp, đặc biệt là sắt (Fe). Trong cấu hình này, lớp vỏ electron d có 6 electron, đóng vai trò quan trọng trong các tính chất hóa học và vật lý của nguyên tố.
1. Cấu hình Electron của Sắt (Fe)
Nguyên tố sắt (Fe) có số nguyên tử là 26. Cấu hình electron đầy đủ của sắt là:
\[ \text{Fe: [Ar] 3d}^6 \text{4s}^2 \]
Trong đó, sắt có hai trạng thái oxi hóa phổ biến là Fe2+ và Fe3+. Các trạng thái này có cấu hình electron như sau:
- Fe2+: \[ \text{[Ar] 3d}^6 \]
- Fe3+: \[ \text{[Ar] 3d}^5 \]
2. Ứng dụng và Tầm quan trọng của Cấu hình Electron 3d6
- Trong hóa học: Cấu hình 3d6 của sắt làm cho nó trở thành một kim loại chuyển tiếp với tính chất đặc trưng như khả năng tạo phức chất, tính dẫn điện và từ tính.
- Trong công nghiệp: Sắt là một nguyên tố quan trọng trong sản xuất thép, một trong những vật liệu xây dựng chủ yếu.
- Trong sinh học: Sắt là thành phần thiết yếu trong hemoglobin, giúp vận chuyển oxy trong máu.
3. Cấu hình Electron và Phản ứng Hóa học
Cấu hình electron của sắt giải thích lý do tại sao Fe có thể dễ dàng mất 2 hoặc 3 electron để tạo ra ion Fe2+ hoặc Fe3+, điều này ảnh hưởng đến phản ứng hóa học của sắt, đặc biệt trong các quá trình oxi hóa-khử.
4. Bảng Tổng hợp Cấu hình Electron của một số nguyên tố liên quan
| Nguyên tố | Số nguyên tử | Cấu hình electron |
|---|---|---|
| Sắt (Fe) | 26 | \[ \text{[Ar] 3d}^6 \text{4s}^2 \] |
| Đồng (Cu) | 29 | \[ \text{[Ar] 3d}^10 \text{4s}^1 \] |
| Kẽm (Zn) | 30 | \[ \text{[Ar] 3d}^10 \text{4s}^2 \] |

.png)
1. Giới thiệu về Cấu Hình Electron 3d6
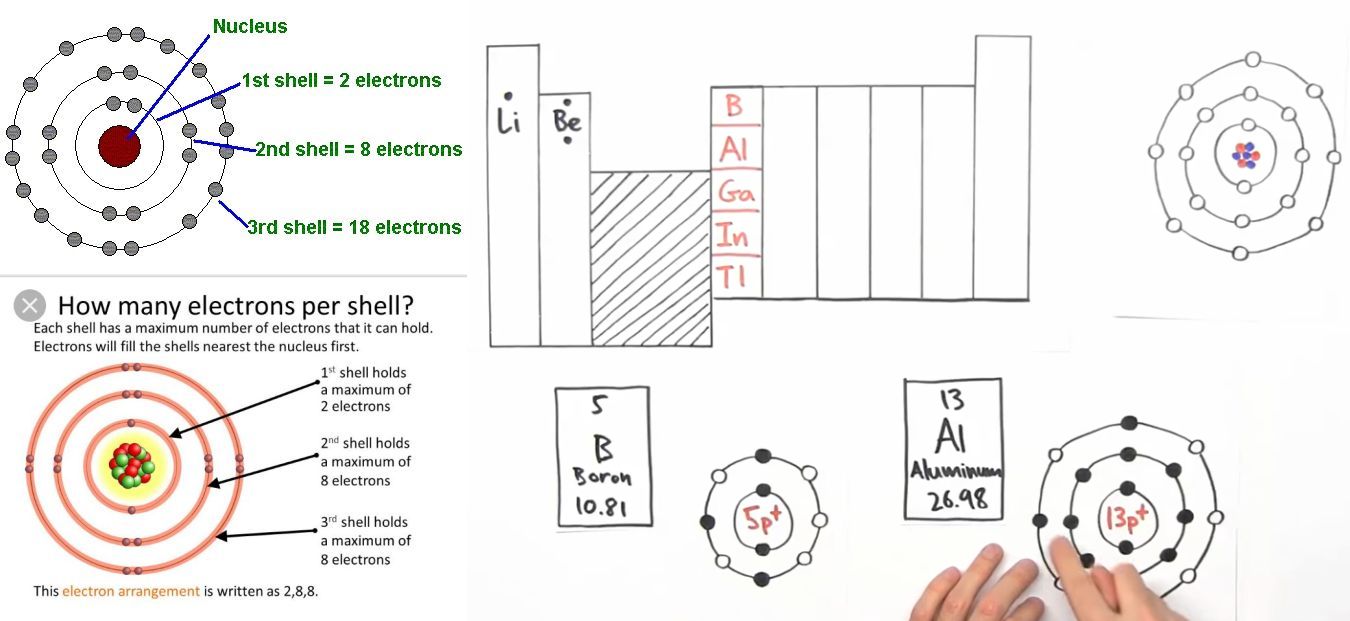
Cấu hình electron 3d6 là một thuật ngữ quan trọng trong hóa học, thường gặp ở các nguyên tố kim loại chuyển tiếp, đặc biệt là sắt (Fe). Cấu hình này mô tả sự phân bố của electron trong các phân lớp năng lượng của nguyên tử.
Trong hóa học, cấu hình electron giúp hiểu rõ hơn về tính chất hóa học và vật lý của nguyên tố. Ví dụ, sắt có cấu hình electron \[ \text{[Ar] 3d}^6 \text{4s}^2 \], cho thấy nó có 6 electron trong phân lớp d và 2 electron trong phân lớp s ở mức năng lượng cao nhất.
Điều này ảnh hưởng trực tiếp đến tính chất hóa học của sắt, như khả năng tạo ra các ion Fe2+ và Fe3+, cũng như tham gia vào các phản ứng oxi hóa-khử quan trọng. Hiểu rõ cấu hình electron như 3d6 là cơ sở để nghiên cứu và ứng dụng trong nhiều lĩnh vực khoa học và công nghệ.
2. Cấu Hình Electron của Sắt (Fe) - Một Trường Hợp Điển Hình
Sắt (Fe) là một trong những nguyên tố kim loại chuyển tiếp tiêu biểu với số nguyên tử là 26. Cấu hình electron của sắt ở trạng thái cơ bản là \[ \text{[Ar] 3d}^6 \text{4s}^2 \]. Điều này có nghĩa là sắt có 6 electron ở phân lớp 3d và 2 electron ở phân lớp 4s, sau khí hiếm Argon (Ar).
Trong các phản ứng hóa học, sắt có thể mất 2 hoặc 3 electron từ lớp ngoài cùng, dẫn đến việc hình thành hai ion phổ biến:
- Fe2+: \[ \text{[Ar] 3d}^6 \]
- Fe3+: \[ \text{[Ar] 3d}^5 \]
Fe2+ có 6 electron ở phân lớp 3d, trong khi Fe3+ có 5 electron. Điều này dẫn đến sự khác biệt trong tính chất hóa học của chúng. Fe2+ có xu hướng dễ bị oxi hóa thành Fe3+, và quá trình này đóng vai trò quan trọng trong các phản ứng oxi hóa-khử, như trong quá trình ăn mòn sắt.
Hiểu về cấu hình electron của sắt giúp giải thích được nhiều tính chất quan trọng của nguyên tố này, từ việc hình thành phức chất đến ứng dụng trong các ngành công nghiệp khác nhau như luyện kim và sản xuất thép.

3. So sánh Cấu Hình Electron 3d6 với Các Nguyên Tố Khác
Cấu hình electron 3d6 là một đặc điểm quan trọng không chỉ riêng của sắt (Fe), mà còn có thể xuất hiện ở các nguyên tố khác trong bảng tuần hoàn. Tuy nhiên, cách mà các electron được sắp xếp trong các lớp vỏ khác nhau của từng nguyên tố sẽ ảnh hưởng đến tính chất hóa học của chúng.
Dưới đây là một so sánh về cách cấu hình 3d6 xuất hiện trong các nguyên tố khác:
- Fe (Sắt): Với cấu hình [Ar] 4s2 3d6, sắt là một nguyên tố chuyển tiếp có nhiều trạng thái oxy hóa khác nhau, từ Fe2+ đến Fe3+.
- Co (Coban): Cấu hình electron của coban là [Ar] 4s2 3d7. Mặc dù chỉ chênh lệch một electron, điều này tạo nên sự khác biệt rõ rệt trong tính chất từ tính và hóa học của coban so với sắt.
- Mn (Mangan): Mangan có cấu hình [Ar] 4s2 3d5, với chỉ một electron ít hơn trong orbital d. Sự thiếu hụt này dẫn đến tính chất hóa học và khả năng oxy hóa khác biệt hoàn toàn.
Thông qua sự so sánh này, ta thấy rằng mặc dù các nguyên tố có thể có cấu hình gần giống nhau, nhưng chỉ một thay đổi nhỏ trong số electron cũng có thể dẫn đến những thay đổi lớn về tính chất hóa học và vật lý của nguyên tố đó.

4. Vai Trò Của Cấu Hình Electron 3d6 Trong Các Phản Ứng Hóa Học
Cấu hình electron 3d6 đóng vai trò quan trọng trong việc xác định tính chất và khả năng tham gia các phản ứng hóa học của các nguyên tố như sắt (Fe). Các electron trong phân lớp 3d của sắt có thể tham gia vào nhiều phản ứng khác nhau, tùy thuộc vào điều kiện phản ứng và các tác nhân hóa học.
Vai trò của cấu hình 3d6 trong các phản ứng hóa học có thể được phân tích qua các yếu tố sau:
- Khả năng tạo phức chất: Sắt với cấu hình 3d6 có khả năng tạo ra nhiều phức chất khác nhau, đặc biệt là trong môi trường nước, với sự kết hợp của các ligand. Điều này rất quan trọng trong các ứng dụng công nghiệp và sinh học.
- Phản ứng oxi hóa-khử: Cấu hình 3d6 của sắt cho phép nó dễ dàng tham gia vào các phản ứng oxi hóa-khử, ví dụ như quá trình chuyển đổi giữa Fe2+ và Fe3+. Đây là yếu tố then chốt trong nhiều quá trình sinh học, chẳng hạn như hô hấp tế bào.
- Tính chất từ tính: Sự phân bố của các electron trong phân lớp 3d cũng ảnh hưởng đến tính chất từ tính của sắt. Điều này làm cho sắt trở thành một nguyên tố quan trọng trong sản xuất nam châm và các thiết bị điện từ.
Như vậy, cấu hình electron 3d6 không chỉ xác định tính chất hóa học của sắt mà còn ảnh hưởng mạnh mẽ đến khả năng tham gia vào các phản ứng hóa học khác nhau, đóng góp vào nhiều ứng dụng quan trọng trong khoa học và công nghiệp.

5. Ứng Dụng Thực Tế của Nguyên Tố Có Cấu Hình 3d6
Các nguyên tố có cấu hình electron 3d6, như sắt (Fe), đóng vai trò quan trọng trong nhiều ứng dụng thực tế trong cuộc sống hàng ngày và trong công nghiệp. Dưới đây là một số ứng dụng nổi bật:
- Sản xuất thép: Sắt là nguyên tố chính trong quá trình sản xuất thép, một trong những vật liệu xây dựng quan trọng nhất. Thép có cấu trúc bền vững và được sử dụng trong các công trình xây dựng, chế tạo máy móc, và các sản phẩm tiêu dùng.
- Ứng dụng trong y học: Sắt là thành phần quan trọng trong hemoglobin, một protein trong máu có chức năng vận chuyển oxy từ phổi đến các cơ quan khác trong cơ thể. Điều này làm cho sắt trở thành yếu tố cần thiết trong các phương pháp điều trị thiếu máu.
- Ngành công nghiệp điện tử: Sắt và các hợp kim của nó được sử dụng rộng rãi trong các thiết bị điện tử, đặc biệt là trong việc sản xuất nam châm vĩnh cửu và các linh kiện điện từ.
- Ngành hóa học: Cấu hình 3d6 cho phép sắt tham gia vào nhiều phản ứng hóa học khác nhau, bao gồm các quá trình xúc tác, tạo phức chất và phản ứng oxi hóa-khử, làm tăng hiệu quả trong sản xuất hóa chất.
Những ứng dụng này cho thấy tầm quan trọng của nguyên tố có cấu hình electron 3d6 trong việc nâng cao chất lượng cuộc sống và phát triển công nghệ.
XEM THÊM:
6. Tổng Kết và Những Điều Cần Ghi Nhớ
Trong suốt bài viết này, chúng ta đã cùng tìm hiểu về cấu hình electron 3d6 và các ứng dụng thực tế của nó. Việc nắm vững cấu hình electron của một nguyên tố không chỉ giúp chúng ta hiểu rõ hơn về tính chất hóa học của nguyên tố đó mà còn mở ra nhiều ứng dụng quan trọng trong các ngành công nghiệp và khoa học.
Dưới đây là những điều cần ghi nhớ về cấu hình 3d6:
- Tính ổn định của sắt: Sắt với cấu hình electron 3d6 đóng vai trò quan trọng trong việc xác định tính chất từ tính và khả năng tham gia các phản ứng oxi hóa-khử của nó.
- Ứng dụng công nghiệp: Sắt và các nguyên tố có cấu hình tương tự đóng góp lớn vào sản xuất thép, nam châm vĩnh cửu, và các sản phẩm công nghệ cao khác.
- Vai trò sinh học: Sắt là một nguyên tố không thể thiếu trong cơ thể con người, đặc biệt trong việc hình thành hemoglobin, giúp vận chuyển oxy trong máu.
- Những khác biệt nhỏ, tác động lớn: Sự khác biệt chỉ trong một hoặc vài electron có thể dẫn đến sự thay đổi lớn về tính chất hóa học và ứng dụng của nguyên tố, như trường hợp của Fe, Co, và Mn.
Nhìn chung, việc hiểu rõ cấu hình electron của các nguyên tố như 3d6 không chỉ là nền tảng cơ bản trong hóa học mà còn mang lại nhiều lợi ích trong các lĩnh vực ứng dụng thực tiễn.